
El punto de fusión (o, en raras ocasiones, el punto de licuefacción ) de una sustancia es la temperatura a la que cambia de estado de sólido a líquido . En el punto de fusión, la fase sólida y la líquida existen en equilibrio . El punto de fusión de una sustancia depende de la presión y, por lo general, se especifica a una presión estándar, como 1 atmósfera o 100 kPa .
Cuando se considera como la temperatura del cambio inverso de líquido a sólido, se la denomina punto de congelación o punto de cristalización . Debido a la capacidad de las sustancias para sobreenfriarse , el punto de congelación puede parecer fácilmente inferior a su valor real. Cuando se determina el "punto de congelación característico" de una sustancia, de hecho, la metodología real es casi siempre "el principio de observar la desaparición en lugar de la formación de hielo, es decir, el punto de fusión". [1]

Para la mayoría de las sustancias, los puntos de fusión y congelación son aproximadamente iguales. Por ejemplo, los puntos de fusión y congelación del mercurio son 234,32 kelvins (−38,83 °C ; −37,89 °F ). [2] Sin embargo, ciertas sustancias poseen diferentes temperaturas de transición sólido-líquido. Por ejemplo, el agar se funde a 85 °C (185 °F; 358 K) y se solidifica a partir de 31 °C (88 °F; 304 K); dicha dependencia de la dirección se conoce como histéresis . El punto de fusión del hielo a 1 atmósfera de presión está muy cerca [3] de 0 °C (32 °F; 273 K); esto también se conoce como punto de hielo. En presencia de sustancias nucleantes , el punto de congelación del agua no siempre es el mismo que el punto de fusión. En ausencia de nucleadores, el agua puede existir como un líquido superenfriado hasta -48,3 °C (-54,9 °F; 224,8 K) antes de congelarse. [4]
El metal con el punto de fusión más alto es el tungsteno , a 3414 °C (6177 °F; 3687 K); [5] esta propiedad hace que el tungsteno sea excelente para su uso como filamentos eléctricos en lámparas incandescentes . El carbono, citado a menudo, no se funde a presión ambiente, sino que sublima a unos 3700 °C (6700 °F; 4000 K); solo existe una fase líquida por encima de presiones de 10 MPa (99 atm) y una presión estimada de 4030–4430 °C (7290–8010 °F; 4300–4700 K) (véase el diagrama de fases del carbono ). El carbonitruro de hafnio (HfCN) es un compuesto refractario con el punto de fusión más alto conocido de cualquier sustancia hasta la fecha y el único confirmado que tiene un punto de fusión superior a 4273 K (4000 °C; 7232 °F) a presión ambiente. Las simulaciones por computadora de mecánica cuántica predijeron que esta aleación (HfN 0,38 C 0,51 ) tendría un punto de fusión de aproximadamente 4400 K. [6] Esta predicción fue confirmada posteriormente mediante experimentos, aunque aún no se ha confirmado una medición precisa de su punto de fusión exacto. [7] En el otro extremo de la escala, el helio no se congela en absoluto a presión normal, incluso a temperaturas arbitrariamente cercanas al cero absoluto ; es necesaria una presión de más de veinte veces la presión atmosférica normal.

Existen muchas técnicas de laboratorio para determinar los puntos de fusión. Una mesa Kofler es una tira de metal con un gradiente de temperatura (rango desde temperatura ambiente hasta 300 °C). Cualquier sustancia puede colocarse sobre una sección de la tira, revelando su comportamiento térmico a la temperatura en ese punto. La calorimetría diferencial de barrido proporciona información sobre el punto de fusión junto con su entalpía de fusión .

Un aparato básico para el análisis del punto de fusión de sólidos cristalinos consiste en un baño de aceite con una ventana transparente (el diseño más básico: un tubo de Thiele ) y una lupa simple. Se colocan varios granos de un sólido en un tubo de vidrio delgado y se sumergen parcialmente en el baño de aceite. El baño de aceite se calienta (y se agita) y con la ayuda de la lupa (y una fuente de luz externa) se puede observar la fusión de los cristales individuales a una temperatura determinada. Se puede utilizar un bloque de metal en lugar de un baño de aceite. Algunos instrumentos modernos tienen detección óptica automática.
La medición también se puede realizar de forma continua con un proceso operativo. Por ejemplo, las refinerías de petróleo miden el punto de congelación del combustible diésel "en línea", lo que significa que la muestra se toma del proceso y se mide automáticamente. Esto permite mediciones más frecuentes, ya que no es necesario recoger la muestra manualmente y llevarla a un laboratorio remoto. [ cita requerida ]
En el caso de los materiales refractarios (por ejemplo, platino, tungsteno, tantalio, algunos carburos y nitruros, etc.), el punto de fusión extremadamente alto (que se considera normalmente superior a 1.800 °C) se puede determinar calentando el material en un horno de cuerpo negro y midiendo la temperatura del cuerpo negro con un pirómetro óptico . En el caso de los materiales con el punto de fusión más alto, esto puede requerir una extrapolación de varios cientos de grados. Se sabe que la radiancia espectral de un cuerpo incandescente es una función de su temperatura. Un pirómetro óptico hace coincidir la radiancia de un cuerpo en estudio con la radiancia de una fuente que se ha calibrado previamente en función de la temperatura. De esta manera, no es necesaria la medición de la magnitud absoluta de la intensidad de la radiación. Sin embargo, se deben utilizar temperaturas conocidas para determinar la calibración del pirómetro. Para temperaturas superiores al rango de calibración de la fuente, se debe emplear una técnica de extrapolación. Esta extrapolación se logra utilizando la ley de radiación de Planck . Las constantes de esta ecuación no se conocen con la suficiente precisión, lo que hace que los errores en la extrapolación sean mayores a temperaturas más altas. Sin embargo, se han desarrollado técnicas estándar para realizar esta extrapolación. [ cita requerida ]
Consideremos el caso de utilizar oro como fuente (pf = 1.063 °C). En esta técnica, la corriente a través del filamento del pirómetro se ajusta hasta que la intensidad de la luz del filamento coincida con la de un cuerpo negro en el punto de fusión del oro. Esto establece la temperatura de calibración primaria y puede expresarse en términos de corriente a través de la lámpara del pirómetro. Con el mismo ajuste de corriente, el pirómetro se apunta a otro cuerpo negro a una temperatura más alta. Un medio absorbente de transmisión conocida se inserta entre el pirómetro y este cuerpo negro. La temperatura del cuerpo negro se ajusta entonces hasta que exista una coincidencia entre su intensidad y la del filamento del pirómetro. La verdadera temperatura más alta del cuerpo negro se determina entonces a partir de la Ley de Planck. A continuación, se retira el medio absorbente y la corriente a través del filamento se ajusta para que coincida con la intensidad del filamento con la del cuerpo negro. Esto establece un segundo punto de calibración para el pirómetro. Este paso se repite para llevar la calibración a temperaturas más altas. Ahora, se conocen las temperaturas y las corrientes correspondientes del filamento del pirómetro y se puede dibujar una curva de temperatura en función de la corriente. Esta curva se puede extrapolar a temperaturas muy altas.
Para determinar los puntos de fusión de una sustancia refractaria mediante este método, es necesario disponer de condiciones de cuerpo negro o conocer la emisividad del material que se está midiendo. La contención del material de alto punto de fusión en estado líquido puede introducir dificultades experimentales. Por ello, las temperaturas de fusión de algunos metales refractarios se han medido observando la radiación procedente de una cavidad de cuerpo negro en muestras de metal sólido que eran mucho más largas que anchas. Para formar dicha cavidad, se perfora un orificio perpendicular al eje largo en el centro de una varilla del material. A continuación, estas varillas se calientan haciendo pasar una corriente muy grande a través de ellas y se observa la radiación emitida por el orificio con un pirómetro óptico. El punto de fusión se indica mediante el oscurecimiento del orificio cuando aparece la fase líquida, destruyendo las condiciones de cuerpo negro. Hoy en día, se emplean técnicas de calentamiento por láser sin recipiente, combinadas con pirómetros rápidos y espectropirómetros, para permitir un control preciso del tiempo durante el cual la muestra se mantiene a temperaturas extremas. Estos experimentos de duración inferior a un segundo abordan varios de los desafíos asociados con las mediciones del punto de fusión más tradicionales realizadas a temperaturas muy altas, como la vaporización de la muestra y la reacción con el recipiente.
Para que un sólido se funda, se necesita calor para elevar su temperatura hasta el punto de fusión. Sin embargo, es necesario suministrar más calor para que se produzca la fusión: esto se denomina calor de fusión y es un ejemplo de calor latente . [10]
Desde un punto de vista termodinámico, en el punto de fusión el cambio en la energía libre de Gibbs (ΔG) del material es cero, pero la entalpía ( H ) y la entropía ( S ) del material están aumentando (ΔH, ΔS > 0). El fenómeno de fusión ocurre cuando la energía libre de Gibbs del líquido se vuelve menor que la del sólido para ese material. A varias presiones esto sucede a una temperatura específica. También se puede demostrar que:
Aquí T , ΔS y ΔH son respectivamente la temperatura en el punto de fusión, el cambio de entropía de fusión y el cambio de entalpía de fusión.
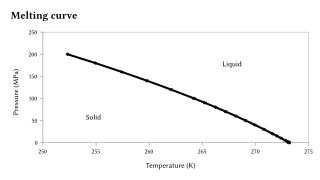
El punto de fusión es sensible a cambios extremadamente grandes en la presión , pero generalmente esta sensibilidad es órdenes de magnitud menor que la del punto de ebullición , porque la transición sólido-líquido representa solo un pequeño cambio en el volumen. [11] [12] Si, como se observa en la mayoría de los casos, una sustancia es más densa en el estado sólido que en el líquido, el punto de fusión aumentará con los aumentos de presión. De lo contrario, ocurre el comportamiento inverso. En particular, este es el caso del agua, como se ilustra gráficamente a la derecha, pero también del Si, Ge, Ga, Bi. Con cambios extremadamente grandes en la presión, se observan cambios sustanciales en el punto de fusión. Por ejemplo, el punto de fusión del silicio a presión ambiente (0,1 MPa) es 1415 °C, pero a presiones superiores a 10 GPa disminuye a 1000 °C. [13]
Los puntos de fusión se utilizan a menudo para caracterizar compuestos orgánicos e inorgánicos y determinar su pureza. El punto de fusión de una sustancia pura siempre es más alto y tiene un rango más pequeño que el punto de fusión de una sustancia impura o, más generalmente, de mezclas. Cuanto mayor sea la cantidad de otros componentes, más bajo será el punto de fusión y más amplio será el rango del punto de fusión, a menudo denominado "rango pastoso". La temperatura a la que comienza la fusión de una mezcla se conoce como solidus, mientras que la temperatura en la que la fusión se completa se llama liquidus . Los eutécticos son tipos especiales de mezclas que se comportan como fases individuales. Se funden bruscamente a una temperatura constante para formar un líquido de la misma composición. Alternativamente, al enfriarse, un líquido con la composición eutéctica se solidificará como cristales mixtos pequeños (de grano fino) uniformemente dispersos con la misma composición.
A diferencia de los sólidos cristalinos, los vidrios no tienen punto de fusión; al calentarlos, experimentan una transición vítrea suave hasta convertirse en un líquido viscoso . Al calentarlos nuevamente, se ablandan gradualmente, lo que se caracteriza por ciertos puntos de ablandamiento .
El punto de congelación de un disolvente disminuye cuando se añade otro compuesto, lo que significa que una solución tiene un punto de congelación más bajo que un disolvente puro. Este fenómeno se utiliza en aplicaciones técnicas para evitar la congelación, por ejemplo, añadiendo sal o etilenglicol al agua. [ cita requerida ]
En química orgánica , la regla de Carnelley , establecida en 1882 por Thomas Carnelley , establece que la alta simetría molecular está asociada con un alto punto de fusión . [14] Carnelley basó su regla en el examen de 15.000 compuestos químicos. Por ejemplo, para tres isómeros estructurales con fórmula molecular C 5 H 12 el punto de fusión aumenta en la serie isopentano −160 °C (113 K) n-pentano −129,8 °C (143 K) y neopentano −16,4 °C (256,8 K). [15] Del mismo modo, en los xilenos y también en los diclorobencenos, el punto de fusión aumenta en el orden meta, orto y luego para . La piridina tiene una simetría menor que el benceno, de ahí su punto de fusión más bajo, pero el punto de fusión aumenta de nuevo con la diazina y las triazinas . Muchos compuestos tipo jaula, como el adamantano y el cubano, con alta simetría tienen puntos de fusión relativamente altos.
Un punto de fusión alto es el resultado de un calor de fusión alto , una entropía de fusión baja o una combinación de ambos. En moléculas altamente simétricas, la fase cristalina está densamente poblada con muchas interacciones intermoleculares eficientes que dan como resultado un cambio de entalpía más alto en la fusión.

Frederick Lindemann intentó por primera vez predecir el punto de fusión de los materiales cristalinos en 1910. [17] La idea detrás de la teoría fue la observación de que la amplitud promedio de las vibraciones térmicas aumenta con el aumento de la temperatura . La fusión se inicia cuando la amplitud de la vibración se vuelve lo suficientemente grande como para que los átomos adyacentes ocupen parcialmente el mismo espacio. El criterio de Lindemann establece que se espera la fusión cuando la amplitud cuadrática media de la vibración excede un valor umbral.
Suponiendo que todos los átomos de un cristal vibran con la misma frecuencia ν , la energía térmica promedio se puede estimar utilizando el teorema de equipartición como [18]
donde m es la masa atómica , ν es la frecuencia , u es la amplitud de vibración promedio, k B es la constante de Boltzmann y T es la temperatura absoluta . Si el valor umbral de u 2 es c 2 a 2 donde c es la constante de Lindemann y a es el espaciamiento atómico , entonces el punto de fusión se estima como
Se pueden obtener otras expresiones para la temperatura de fusión estimada en función de la estimación de la energía térmica promedio. Otra expresión comúnmente utilizada para el criterio de Lindemann es [19]
De la expresión para la frecuencia de Debye para ν ,
donde θ D es la temperatura de Debye y h es la constante de Planck . Los valores de c varían de 0,15 a 0,3 para la mayoría de los materiales. [20]
En febrero de 2011, Alfa Aesar publicó más de 10 000 puntos de fusión de compuestos de su catálogo como datos abiertos [21] y se han extraído datos similares de patentes . [22] Los datos de Alfa Aesar y de patentes se han resumido en (respectivamente) bosques aleatorios [21] y máquinas de vectores de soporte . [22]