Legionella pneumophila es una bacteria aeróbica , pleomórfica, flagelada , no formadora de esporas y gramnegativa . [1] [2] Existen catorce serotipos de L. pneumophila L. pneumophila es un parásito intracelular facultativo que infecta a las amebas del suelo y a los ameboflagelados de agua dulce para replicarse. [3] [4] Por lo tanto, este patógeno se encuentra comúnmente cerca de entornos de agua dulce [5] e invade la vida unicelular , utilizándolos para realizar funciones metabólicas. [6] Debido a la capacidad de L. pneumophila de prosperar en el agua, puede crecer en sistemas de filtración de agua, llegando a grifos, duchas y otros accesorios y luego propagarse a través de gotitas de agua aerosolizadas. [6]
L. pneumophila también es el agente causal de la enfermedad del legionario , también conocida como legionelosis. [4] Debido a la naturaleza de la replicación de la bacteria, es capaz de reproducirse libremente en los macrófagos humanos. [4] Una vez infectada, esta bacteria puede causar neumonía con síntomas como fiebre, delirio, diarrea y disminución de la función hepática y renal. [7] L. pneumophila se puede diagnosticar en pacientes mediante anticuerpos marcados con fluorescencia en una muestra de orina. [8] [9] La bacteria se puede tratar con fluoroquinolonas y antibióticos de azitromicina . [8]
L. pneumophila es un cocobacilo . Es una bacteria aeróbica gramnegativa incapaz de hidrolizar gelatina o producir ureasa . Tampoco es fermentativa . L. pneumophila no está pigmentada ni es autofluorescente . [10] Es oxidasa y catalasa positiva, y produce beta-lactamasa . La morfología de la colonia de L. pneumophila es de color blanco grisáceo con una apariencia texturizada, como de vidrio tallado; también requiere cisteína y hierro para prosperar. [11] Crece en agar con extracto de levadura , así como en ambientes húmedos, como el agua del grifo, en colonias "similares al ópalo". [11]
Aunque L. pneumophila se clasifica como un organismo gramnegativo, se tiñe mal debido a su contenido único de lipopolisacáridos en la hoja externa de la membrana celular externa. [12] Las bases para la especificidad antigénica somática de este organismo se encuentran en las cadenas laterales de su pared celular. La composición química de estas cadenas laterales, tanto con respecto a los componentes como a la disposición de los diferentes azúcares, determina la naturaleza de los determinantes somáticos u O-antigénicos , que son medios importantes para clasificar serológicamente muchas bacterias gramnegativas. Se han descrito al menos 35 serovares diferentes de L. pneumophila , así como varias otras especies subdivididas en varios serovares. [ cita requerida ]

L. pneumophila es una bacteria que se puede encontrar en diversas condiciones ambientales. Puede vivir en temperaturas que oscilan entre 0 y 63 °C, en un rango de pH de 5,0 a 8,5 y en niveles de oxígeno disuelto de 0,2 a 15,0 mg/litro. [5]
Se puede encontrar en ambientes de agua dulce con un amplio rango de temperaturas. Aunque se puede encontrar en este rango más amplio, solo se multiplica dentro de un rango de temperatura de 25 y 42 °C. [5] Con su capacidad de residir en el agua, también pueden resistir la cloración del agua y pasar fácilmente a los sistemas de control de agua. [5] Con esta capacidad de infiltrarse en los sistemas de agua, pueden formar biopelículas en las paredes de las tuberías que pueden hacer que esta bacteria se aerosolice a través de grifos, duchas, rociadores y otros accesorios, lo que provoca una infección después de una exposición prolongada. [6] La principal fuente de contaminación por L. pneumophila es la red de suministro de agua y esto ha permitido que L. pneumophila crezca y prolifere en lugares como torres de refrigeración, sistemas de agua de hospitales, hoteles y cruceros. [5]
Como parásito intracelular facultativo , L. pneumophila puede invadir y replicarse dentro de protozoos en el ambiente, especialmente dentro de las especies de los géneros Acanthamoeba y Naegleria , que pueden así servir como reservorio para L. pneumophila. Estos huéspedes proporcionarán entonces protección contra condiciones físicas y químicas desfavorables, como la cloración. [3]
Las biopelículas son comunidades especializadas que se adhieren a la superficie y que pueden estar formadas por un microbio o por varios diferentes, desde bacterias hasta algas y protozoos . Las biopelículas en los sistemas de plomería y en los sistemas de distribución de agua son donde puede sobrevivir una gran cantidad de L. pneumophila . [5] Entre 2009 y 2010, L. pneumophila contribuyó al 58% de los brotes totales de enfermedades transmitidas por el agua asociadas con el agua potable en los Estados Unidos, lo que provocó un aumento en la investigación en torno a las biopelículas y la proliferación de L. pneumophila . [13] El material también juega un papel en la proliferación de biopelículas. En las tuberías de agua, L. pneumophila se encontró más comúnmente en tuberías de plástico a 40 °C, en lugar de en una tubería de cobre, lo que en realidad inhibió el crecimiento. [5]
Legionella es un género que se sabe que infecta y se multiplica dentro de especies de protistas ambientales. Conocemos al menos 20 especies diferentes de protozoos que apoyan la replicación intracelular de L. pneumophila. [14] Esta bacteria puede infectar y sobrevivir dentro de géneros de protozoos como Acanthamoeba , Vermamoeba y Naegleria . Las bacterias están rodeadas por un quiste resistente mientras residen dentro de la célula huésped, lo que les permite sobrevivir a condiciones ambientales adversas como el cloro, que se usa comúnmente en los sistemas de tratamiento de agua. [15]
Aunque se sabe que los protozoos juegan un papel importante en la ecología de L. pneumophila , hay pocos datos sobre cómo estos organismos interactúan con otros microbios en el medio ambiente y cómo esto afecta a L. pneumophila en general. [14]
L. pneumophila es el principal organismo causante (>90%) de la enfermedad del legionario . [16] Aproximadamente 2 de cada 100.000 personas se infectan cada año en la UE. [17] L. pneumophila a menudo infecta a las personas a través de fuentes de agua de mala calidad. Aproximadamente el 20% de los casos de enfermedad del legionario notificados provienen de centros de atención médica, residencias para personas mayores o instalaciones de viajes que han estado expuestas a agua contaminada con L. pneumophila. [16] También puede haber un mayor riesgo de contraer L. pneumophila a partir de pozos privados, ya que a menudo no están regulados y no se desinfectan tan rigurosamente como los sistemas de agua municipales. [18] Varios brotes importantes de enfermedad del legionario han provenido de jacuzzis públicos debido a que el rango de temperatura del agua es ideal para el crecimiento de Legionella . [19] [20]

En los seres humanos, L. pneumophila invade y se replica dentro de los macrófagos . La internalización de las bacterias puede mejorarse con la presencia de anticuerpos y complemento , pero no es absolutamente necesaria. La internalización de las bacterias parece ocurrir a través de la fagocitosis . Sin embargo, L. pneumophila también es capaz de infectar células no fagocíticas a través de un mecanismo desconocido. Se ha descrito una forma rara de fagocitosis conocida como fagocitosis en espiral para L. pneumophila , pero esta no depende del sistema de secreción bacteriana Dot/Icm (defecto en el tráfico de orgánulos/genes de multiplicación intracelular) y se ha observado para otros patógenos. [21] Una vez internalizado, el sistema Dot/Icm comienza a secretar proteínas efectoras bacterianas que reclutan factores del huésped a la vacuola que contiene Legionella (LCV) transformando la membrana en una que es indistinguible de la membrana del RE. Este proceso evita que la LCV se fusione con los lisosomas que de otro modo degradarían las bacterias. La replicación bacteriana se produce en el interior del LCV. La integridad de la membrana del LCV requiere un suministro constante de lípidos del huésped. [22] Los estudios han demostrado que el colesterol celular y el ácido graso cis-monoinsaturado, el ácido palmitoleico, son lípidos importantes derivados del huésped que promueven la expansión de la membrana del LCV. [23] [24]
L. pneumophila exhibe una estructura única de lipopolisacárido (LPS) que es altamente hidrofóbica debido a que está densamente llena de ácidos grasos ramificados y niveles elevados de grupos O -acetilo y N -acetilo. [25] Esta estructura ayuda a prevenir la interacción con un correceptor común del sistema inmunológico de LPS, CD14. [25] También existe una correlación entre un LPS con un alto peso molecular y la inhibición de la fusión fagosoma-lisosoma. [25] L. pneumophila produce pili de longitudes variables. Las dos proteínas de pili: PilE y Prepilin peptidase (PilD) son responsables de la producción de pili tipo IV y, posteriormente, de la proliferación intracelular. [26] L. pneumophila posee un flagelo polar singular que se utiliza para la motilidad celular, la adhesión, la invasión del huésped y la formación de biopelículas. [25] Los mismos reguladores que controlan la flagelación también controlan la evitación de los lisosomas y la citotoxicidad . [25] El potenciador de la infectividad de los macrófagos es otro componente clave de la invasión de la célula huésped y la replicación intracelular. El MIP muestra actividad de peptidil-prolil cis/trans isomerasa (PPIasa), que es crucial para la supervivencia dentro del macrófago, junto con la transmigración a través de la barrera epitelial pulmonar. [25] [26]
Las bacterias utilizan un sistema de secreción de tipo IVB conocido como Dot/Icm para inyectar proteínas efectoras en el huésped. Estos efectores participan en el aumento de la capacidad de las bacterias para sobrevivir dentro de la célula huésped. L. pneumophila codifica más de 330 proteínas "efectoras", [27] que son secretadas por el sistema de translocación Dot/Icm para interferir con los procesos de la célula huésped y ayudar a la supervivencia bacteriana. Se ha predicho que el género Legionella codifica más de 10.000 y posiblemente hasta ~18.000 efectores que tienen una alta probabilidad de ser secretados en sus células huésped. [28] [29]
Una de las principales formas en que L. pneumophila utiliza sus proteínas efectoras es para interferir con la fusión de la vacuola que contiene Legionella con los endosomas del huésped , y así protegerse contra la lisis. [30] Los estudios de eliminación de efectores translocados Dot/Icm indican que son vitales para la supervivencia intracelular de la bacteria, pero se cree que muchas proteínas efectoras individuales funcionan de manera redundante, en el sentido de que la eliminación de un solo efector rara vez impide la supervivencia intracelular. Este alto número de proteínas efectoras translocadas y su redundancia es probablemente el resultado de que la bacteria haya evolucionado en muchos huéspedes protozoarios diferentes . [31]
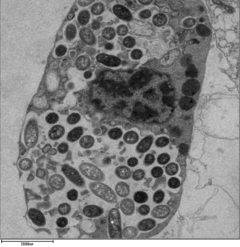
Para que Legionella sobreviva dentro de los macrófagos y protozoos, debe crear un compartimento especializado conocido como la vacuola que contiene Legionella (LCV). [32] A través de la acción del sistema de secreción Dot/Icm, las bacterias pueden evitar la degradación por la vía de tráfico endosómico normal y, en su lugar, replicarse. Poco después de la internalización, las bacterias reclutan específicamente vesículas derivadas del retículo endoplásmico y mitocondrias al LCV mientras previenen el reclutamiento de marcadores endosómicos como Rab5a y Rab7a . La formación y el mantenimiento de las vacuolas son cruciales para la patogénesis; las bacterias que carecen del sistema de secreción Dot/Icm no son patógenas y no pueden replicarse dentro de las células, mientras que la eliminación del efector Dot/Icm SdhA da como resultado la desestabilización de la membrana vacuolar y la no replicación bacteriana. [33] [34]
L. pneumophila utiliza la glucólisis , la vía de Entner-Doudoroff (ED), la vía de las pentosas fosfato (PP) y el ciclo del ácido cítrico (TCA). [35] Aunque L. pneumophila también puede realizar gluconeogénesis , no tiene los genes para codificar 1,6-bifosfatasas. Por lo tanto, se utilizan otras enzimas para completar la gluconeogénesis. Una enzima utilizada en su lugar es la fructosa 6-fosfato aldolasa. [35] Esta tendencia también está presente cuando se trata de la vía PP que puede ocurrir sin sustratos como la 6-fosfogluconato deshidrogenasa. [35] Las vías ED y PP son las principales vías para el metabolismo de la glucosa en este organismo. Junto con estas vías, se descubrió que la serina era un nutriente importante debido a su capacidad para convertirse en piruvato, que es un intermediario importante en las vías metabólicas de L. pneumophila . [35]
Aunque se utiliza el metabolismo de la glucosa, no es una de las principales vías de síntesis dentro del organismo. Al utilizar medios que contenían glucosa, el crecimiento de L. pneumophila no aumentó y los carbohidratos no se consideraron una fuente importante de carbono dentro de L. pneumophila. La glucosa puede actuar como cosustrato solo en ciertas condiciones, ya que este microbio utiliza los aminoácidos con mayor frecuencia y eficiencia. [35]
Legionella es auxotrófica para siete aminoácidos: cisteína, leucina, metionina, valina, treonina, isoleucina y arginina. Una vez dentro de la célula huésped, Legionella necesita nutrientes para crecer y reproducirse. Dentro de la vacuola, la disponibilidad de nutrientes es baja; la alta demanda de aminoácidos no es cubierta por el transporte de aminoácidos libres que se encuentran en el citoplasma del huésped . Para mejorar la disponibilidad de aminoácidos, el parásito promueve los mecanismos del huésped de degradación proteasomal . Este proceso en L. pneumophila incluye la ubiquitina ligasa SCF1 y el efector AnkB F-Box , que es farnesilado por la actividad de tres enzimas del huésped localizadas en la membrana de la LCV: farnesiltransferasa , proteasa de enzima convertidora de Ras-1 e ICMT . La farnesilación permite que AnkB se ancle en el lado citoplasmático de la vacuola. SCF1 y AnkB interactúan entre sí para degradar las proteínas poliubiquitinadas ligadas a Lys. [36] Esto genera un exceso de aminoácidos libres en el citoplasma de las células infectadas por L. pneumophila que pueden usarse para la proliferación intravacuolar del parásito.
La poliubiquitinación ligada a K48 es un marcador de degradación proteasomal que libera péptidos de 2 a 24 aminoácidos de longitud, que se degradan rápidamente a aminoácidos por diversas oligopeptidasas y aminopeptidasas presentes en el citoplasma. Los aminoácidos se importan al LCV a través de varios transportadores de aminoácidos, como el transportador de aminoácidos neutros B(0) . [36]
Los aminoácidos son la fuente principal de carbono y energía de L. pneumophila , que tiene casi 12 clases de transportadores ABC , permeasas de aminoácidos y muchas proteasas para explotarlos. L. pneumophila utiliza los aminoácidos importados para generar energía a través del ciclo del TCA (ciclo de Krebs) y como fuentes de carbono y nitrógeno. Debido a que la degradación de aminoácidos actúa como la principal fuente de carbono para L. pneumophila, este microbio no depende tanto de la glucosa. A pesar de esto, L. pneumophila contiene múltiples amilasas, como LamB, que hidroliza los polisacáridos en monómeros de glucosa para el metabolismo. La pérdida de LamB puede provocar graves problemas de crecimiento para L. pneumophila. [37]
Sin embargo, la promoción de la degradación proteosomal para la obtención de aminoácidos y la hidrolización de polisacáridos pueden no ser las únicas estrategias de virulencia para obtener fuentes de carbono y energía del huésped. Las enzimas degradativas secretadas por el tipo II pueden proporcionar una estrategia adicional para generar fuentes de carbono y energía. [38] L. pneumophila es el único patógeno intracelular conocido que tiene un sistema de secreción de tipo II (secretoma). En la secreción de tipo II, las proteínas se translocan primero a través de la membrana interna hacia el espacio periplásmico. Este proceso está mediado por la vía Sec o Tat. Poco después, las mismas proteínas se transportan a través de un poro específico en la membrana externa hacia el exterior de la célula. Se cree que este secretoma tiene hasta 60 proteínas incorporadas al sistema. [38]
La determinación y publicación de las secuencias genómicas completas de tres aislamientos clínicos de L. pneumophila en 2004 allanó el camino para la comprensión de la biología molecular de L. pneumophila en particular y de Legionella en general. En 2007, se descubrió una cuarta cepa: la cepa Corby de L. pneumophila . [39] Estas cuatro cepas se asemejan a un tamaño muy similar, con la cepa Lens alrededor de 3,3 Mb y la cepa Paris y Corby alrededor de 3,5 Mb. Este mayor tamaño refleja un mayor número de genes, lo que se corresponde con la capacidad de Legionella para adaptarse a diferentes huéspedes y entornos. En las cuatro cepas de L. pneumophila , hay una abundancia relativamente alta de proteínas similares a eucariotas (ELP), lo que sugiere que estas ELP son beneficiosas para su función diaria. De hecho, se predice que muchas de estas ELP benefician al patógeno en la modulación de la célula huésped. Un análisis comparativo profundo del genoma utilizando matrices de ADN para estudiar el contenido genético de 180 cepas de Legionella reveló una alta plasticidad genómica y frecuentes eventos de transferencia horizontal de genes . Se obtuvo más información sobre el ciclo de vida de L. pneumophila investigando el perfil de expresión genética de L. pneumophila en Acanthamoeba castellanii , una especie hospedadora común. L. pneumophila exhibe un ciclo de vida bifásico y define rasgos transmisivos y replicativos según los perfiles de expresión genética. [2]
La transformación es una adaptación bacteriana que implica la transferencia de ADN de una bacteria a otra a través del medio líquido circundante. La transformación es una forma bacteriana de reproducción sexual . [40] Para que una bacteria se una, absorba y recombine ADN exógeno en su cromosoma, debe entrar en un estado fisiológico especial denominado " competencia ".
Para determinar qué moléculas pueden inducir competencia en L. pneumophila , se probaron 64 moléculas tóxicas. [41] Solo seis de estas moléculas, todas agentes que dañan el ADN, causaron una fuerte inducción de competencia. Estas fueron mitomicina C (que introduce enlaces cruzados entre cadenas de ADN), norfloxacina , ofloxacina y ácido nalidíxico (inhibidores de la ADN girasa que causan roturas de doble cadena), biciclomicina (causa roturas de doble cadena) e hidroxiurea (causa oxidación de bases de ADN). Estos resultados sugieren que la competencia para la transformación en L. pneumophila evolucionó como una respuesta al daño del ADN . [41] Quizás la inducción de competencia proporciona una ventaja de supervivencia en un huésped natural, como ocurre con otras bacterias patógenas. [40]
Se han propuesto varias enzimas en las bacterias como objetivos farmacológicos tentativos. Por ejemplo, se han sugerido enzimas en la vía de captación de hierro como objetivos farmacológicos importantes. [42] Además, una clase cN-II de 5'-nucleotidasa específica de IMP/GMP que se ha caracterizado cinéticamente de forma extensa. La enzima tetramérica muestra aspectos de cooperatividad homotrópica positiva , activación del sustrato y presenta un sitio alostérico único que puede ser el objetivo para diseñar fármacos efectivos contra la enzima y, por lo tanto, contra el organismo. Además, la enzima es distinta de su contraparte humana, lo que la convierte en un objetivo atractivo para el desarrollo de fármacos.
Los antisueros se han utilizado tanto para estudios de aglutinación en portaobjetos como para la detección directa de bacterias en tejidos mediante inmunofluorescencia a través de anticuerpos marcados con fluorescencia . Los anticuerpos específicos en pacientes se pueden determinar mediante la prueba de anticuerpos fluorescentes indirectos. Las pruebas ELISA y de microaglutinación también se han aplicado con éxito. [9] Un método consistente que se ha utilizado para detectar la enfermedad es la prueba de antígenos en orina. [8]
El tratamiento antibiótico eficaz para la neumonía por Legionella incluye fluoroquinolonas ( levofloxacino o moxifloxacino ) o, alternativamente, azitromicina . [8] No se han encontrado diferencias significativas entre el uso de una fluoroquinolona o azitromicina para tratar la neumonía por Legionella . [8] Se están probando tratamientos combinados con rifampicina como respuesta a la resistencia a los antibióticos durante los monotratamientos, aunque su eficacia sigue siendo incierta. [8]
Estos antibióticos funcionan mejor porque L. pneumophila es un patógeno intracelular . [43] La levofloxacina y la azitromicina tienen una gran actividad intracelular y pueden penetrar en las células infectadas por Legionella . La Sociedad de Enfermedades Infecciosas de Estados Unidos recomienda un tratamiento de 5 a 10 días con levofloxacina o de 3 a 5 días con azitromicina; sin embargo, los pacientes inmunodeprimidos o con una enfermedad grave pueden requerir un tratamiento más prolongado. [43]
{{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace )