El deuterio ( hidrógeno-2 , símbolo 2H o D , también conocido como hidrógeno pesado ) es uno de los dos isótopos estables del hidrógeno ; el otro es el protio, o hidrógeno-1, 1H . El núcleo de deuterio , llamado deuterón , contiene un protón y un neutrón , mientras que el mucho más común 1H no tiene neutrones. El deuterio tiene una abundancia natural en los océanos de la Tierra de aproximadamente un átomo de deuterio por cada 6.420 átomos de hidrógeno. Por lo tanto, el deuterio representa aproximadamente el 0,0156% en número (0,0312% en masa) de todo el hidrógeno del océano:4,85 × 10 13 toneladas de deuterio, principalmente como HOD (o 1 HO 2 H o 1 H 2 HO) y solo raramente como D 2 O (o 2 H 2 O), en1,4 × 10 18 toneladas de agua. La abundancia de 2 H varía ligeramente de un tipo de agua natural a otro (véase la norma de Viena sobre el agua oceánica media ).
El nombre deuterio proviene del griego deuteros , que significa "segundo". [3] [4] El químico estadounidense Harold Urey descubrió el deuterio en 1931. Urey y otros produjeron muestras de agua pesada en las que el 2 H se había concentrado en gran medida. El descubrimiento del deuterio le valió a Urey un Premio Nobel en 1934.
El deuterio se destruye en el interior de las estrellas a un ritmo mayor que el que se produce. Se cree que otros procesos naturales producen solo una cantidad insignificante de deuterio. Casi todo el deuterio que se encuentra en la naturaleza se produjo en el Big Bang hace 13.800 millones de años, ya que la proporción básica o primordial de 2 H a 1 H (≈26 átomos de deuterio por 10 6 átomos de hidrógeno) tiene su origen en esa época. Esta es la proporción que se encuentra en los planetas gigantes gaseosos, como Júpiter. El análisis de las proporciones deuterio-protio ( 2 H 1 HR) en los cometas arrojó resultados muy similares a la proporción media en los océanos de la Tierra (156 átomos de deuterio por 10 6 átomos de hidrógeno). Esto refuerza las teorías de que gran parte del agua de los océanos de la Tierra es de origen cometario. [5] [6] La concentración de 2 H 1 del cometa 67P/Churyumov–Gerasimenko , medida por la sonda espacial Rosetta , es aproximadamente tres veces la del agua terrestre. Esta cifra es la más alta medida hasta ahora en un cometa. [7] Por lo tanto, las concentraciones de 2 H 1 siguen siendo un tema activo de investigación tanto en astronomía como en climatología.

El deuterio se representa a menudo con el símbolo químico D. Dado que es un isótopo del hidrógeno con número de masa 2, también se representa con 2 H. La IUPAC permite tanto D como 2 H, aunque se prefiere 2 H. [8] Se utiliza un símbolo químico distinto por conveniencia debido al uso común del isótopo en varios procesos científicos. Además, su gran diferencia de masa con el protio ( 1 H) confiere diferencias químicas no despreciables con los compuestos de 1 H. El deuterio tiene una masa de2.014 102 Da , aproximadamente el doble del peso atómico medio del hidrógeno .1.007 947 Da , o el doble de la masa del protio.1.007 825 Da . Las relaciones de peso de los isótopos dentro de otros elementos químicos son en gran medida insignificantes a este respecto.
En mecánica cuántica , los niveles de energía de los electrones en los átomos dependen de la masa reducida del sistema formado por el electrón y el núcleo. En el caso del átomo de hidrógeno , el papel de la masa reducida se ve de forma más sencilla en el modelo atómico de Bohr, donde la masa reducida aparece en un cálculo simple de la constante de Rydberg y la ecuación de Rydberg, pero la masa reducida también aparece en la ecuación de Schrödinger y en la ecuación de Dirac para calcular los niveles de energía atómica.
La masa reducida del sistema en estas ecuaciones es cercana a la masa de un solo electrón, pero difiere de ella en una pequeña cantidad aproximadamente igual a la relación entre la masa del electrón y el núcleo. Para el hidrógeno normal, esta cantidad es aproximadamente 1837/1836 , o 1,000545, y para el deuterio es aún menor: 3671/3670 , o 1,0002725. Por lo tanto, las energías de las líneas de los espectros electrónicos para 2 H y 1 H difieren en la relación de estos dos números, que es 1,000272. Las longitudes de onda de todas las líneas espectroscópicas del deuterio son más cortas que las líneas correspondientes del hidrógeno ligero, en un 0,0272 %. En la observación astronómica, esto corresponde a un desplazamiento Doppler azul del 0,0272 % de la velocidad de la luz , o 81,6 km/s. [9]
Las diferencias son mucho más pronunciadas en la espectroscopia vibracional, como la espectroscopia infrarroja y la espectroscopia Raman , [10] y en los espectros rotacionales, como la espectroscopia de microondas , porque la masa reducida del deuterio es notablemente mayor que la del protio. En la espectroscopia de resonancia magnética nuclear , el deuterio tiene una frecuencia de RMN muy diferente (por ejemplo, 61 MHz cuando el protio está a 400 MHz) y es mucho menos sensible. Los disolventes deuterados se utilizan habitualmente en la RMN de protio para evitar que el disolvente se superponga con la señal, aunque la RMN de deuterio por derecho propio también es posible.
Se cree que el deuterio jugó un papel importante en el establecimiento del número y las proporciones de los elementos que se formaron en el Big Bang . Combinando la termodinámica y los cambios provocados por la expansión cósmica, se puede calcular la fracción de protones y neutrones en función de la temperatura en el punto en que el universo se enfrió lo suficiente como para permitir la formación de núcleos . Este cálculo indica siete protones por cada neutrón al comienzo de la nucleogénesis , una proporción que permanecería estable incluso después de que la nucleogénesis terminara. Esta fracción favorecía a los protones inicialmente, principalmente porque la menor masa del protón favorecía su producción. A medida que el Universo se expandió, se enfrió. Los neutrones y protones libres son menos estables que los núcleos de helio , y los protones y neutrones tenían una fuerte razón energética para formar helio-4 . Sin embargo, la formación de helio-4 requiere el paso intermedio de formar deuterio.
Durante gran parte de los pocos minutos posteriores al Big Bang durante los cuales podría haber ocurrido la nucleosíntesis, la temperatura era lo suficientemente alta como para que la energía media por partícula fuera mayor que la energía de enlace del deuterio débilmente unido; por lo tanto, cualquier deuterio que se formara se destruía inmediatamente. Esta situación se conoce como el cuello de botella del deuterio . El cuello de botella retrasó la formación de cualquier helio-4 hasta que el Universo se enfrió lo suficiente como para formar deuterio (a una temperatura equivalente a aproximadamente 100 keV ). En este punto, hubo un estallido repentino de formación de elementos (primero deuterio, que inmediatamente se fusionó con helio). Sin embargo, muy poco después, a los veinte minutos después del Big Bang, el Universo se volvió demasiado frío para que ocurriera cualquier otra fusión nuclear y nucleosíntesis. En este punto, las abundancias elementales estaban casi fijas, con el único cambio de que algunos de los productos radiactivos de la nucleosíntesis del Big Bang (como el tritio ) se desintegraron. [11] El cuello de botella del deuterio en la formación del helio, junto con la falta de vías estables para que el helio se combinara con el hidrógeno o consigo mismo (ningún núcleo estable tiene un número de masa de 5 u 8), significó que una cantidad insignificante de carbono, o de cualquier elemento más pesado que el carbono, se formara en el Big Bang. Por lo tanto, estos elementos requirieron su formación en estrellas. Al mismo tiempo, el fracaso de gran parte de la nucleogénesis durante el Big Bang aseguró que habría mucho hidrógeno en el universo posterior disponible para formar estrellas de larga duración, como el Sol.

El deuterio se encuentra en cantidades traza de forma natural como gas deuterio ( 2 H 2 o D 2 ), pero la mayoría de los átomos de deuterio en el Universo están unidos con 1 H para formar un gas llamado deuteruro de hidrógeno (HD o 1 H 2 H). [12] De manera similar, el agua natural contiene moléculas deuteradas, casi todas como agua semipesada HDO con un solo deuterio.
La existencia de deuterio en la Tierra, en otras partes del Sistema Solar (como lo confirman las sondas planetarias) y en los espectros de las estrellas es también un dato importante en cosmología . La radiación gamma de la fusión nuclear ordinaria disocia el deuterio en protones y neutrones, y no hay procesos naturales conocidos aparte de la nucleosíntesis del Big Bang que pudieran haber producido deuterio en algo cercano a su abundancia natural observada. El deuterio se produce por la rara desintegración de cúmulos y la absorción ocasional de neutrones naturales por hidrógeno ligero, pero estas son fuentes triviales. Se cree que hay poco deuterio en el interior del Sol y otras estrellas, ya que a estas temperaturas las reacciones de fusión nuclear que consumen deuterio ocurren mucho más rápido que la reacción protón-protón que crea deuterio. Sin embargo, el deuterio persiste en la atmósfera solar exterior en aproximadamente la misma concentración que en Júpiter, y esto probablemente no ha cambiado desde el origen del Sistema Solar. La abundancia natural de 2 H parece ser una fracción muy similar a la del hidrógeno, dondequiera que se encuentre, a menos que haya procesos obvios en juego que lo concentren.
La existencia de deuterio en una fracción primordial baja pero constante en todo el hidrógeno es otro de los argumentos a favor de la teoría del Big Bang sobre la teoría del estado estacionario del universo. Las proporciones observadas de hidrógeno, helio y deuterio en el universo son difíciles de explicar excepto con un modelo del Big Bang. Se estima que las abundancias de deuterio no han evolucionado significativamente desde su producción hace unos 13.800 millones de años. [13] Las mediciones del deuterio galáctico de la Vía Láctea a partir del análisis espectral ultravioleta muestran una proporción de hasta 23 átomos de deuterio por millón de átomos de hidrógeno en nubes de gas no perturbadas, que es solo un 15% inferior a la proporción primordial estimada por WMAP de unos 27 átomos por millón desde el Big Bang. Esto se ha interpretado como que se ha destruido menos deuterio en la formación de estrellas en la Vía Láctea de lo esperado, o tal vez el deuterio se ha repuesto mediante una gran caída de hidrógeno primordial desde fuera de la galaxia. [14] En el espacio a unos cientos de años luz del Sol, la abundancia de deuterio es de sólo 15 átomos por millón, pero este valor presumiblemente está influenciado por la adsorción diferencial de deuterio sobre granos de polvo de carbono en el espacio interestelar. [15]
La abundancia de deuterio en la atmósfera de Júpiter ha sido medida directamente por la sonda espacial Galileo como 26 átomos por millón de átomos de hidrógeno. Las observaciones de ISO-SWS encuentran 22 átomos por millón de átomos de hidrógeno en Júpiter. [16] y se piensa que esta abundancia representa una proporción cercana a la del Sistema Solar primigenio. [6] Esto es aproximadamente el 17% de la proporción terrestre de 156 átomos de deuterio por millón de átomos de hidrógeno.
Se ha medido que cuerpos cometarios como el cometa Hale-Bopp y el cometa Halley contienen más deuterio (unos 200 átomos por millón de hidrógenos), proporciones que están enriquecidas con respecto a la presunta proporción de la nebulosa protosolar, probablemente debido al calentamiento, y que son similares a las proporciones encontradas en el agua marina de la Tierra. La reciente medición de cantidades de deuterio de 161 átomos por millón de hidrógeno en el cometa 103P/Hartley (un antiguo objeto del cinturón de Kuiper ), una proporción casi exactamente igual a la de los océanos de la Tierra (155,76 ± 0,1, pero en realidad de 153 a 156 ppm), enfatiza la teoría de que el agua superficial de la Tierra puede derivar en gran medida de cometas. [5] [6] Más recientemente, la HR 2 H 1 de 67P/Churyumov–Gerasimenko medida por Rosetta es aproximadamente tres veces la del agua de la Tierra. [7] Esto ha provocado un renovado interés en las sugerencias de que el agua de la Tierra puede ser en parte de origen asteroidal.
También se ha observado que el deuterio se concentra por encima de la abundancia solar media en otros planetas terrestres, en particular Marte y Venus. [17]
El deuterio se produce para fines industriales, científicos y militares, comenzando con agua común (una pequeña fracción de la cual es agua pesada natural ) y luego separando el agua pesada mediante el proceso de sulfuro de Girdler , destilación u otros métodos. [18]
En teoría, el deuterio para agua pesada podría crearse en un reactor nuclear, pero su separación del agua ordinaria es el proceso de producción en masa más barato.
Hasta 1997, año en que se cerró la última planta de agua pesada, el principal proveedor mundial de deuterio fue Atomic Energy of Canada Limited . Canadá utiliza agua pesada como moderador de neutrones para el funcionamiento del reactor CANDU .
Otro importante productor de agua pesada es la India. Todas las plantas de energía atómica de la India, salvo una, son plantas de agua pesada presurizada, que utilizan uranio natural (es decir, no enriquecido). La India tiene ocho plantas de agua pesada, de las cuales siete están en funcionamiento. Seis plantas, de las cuales cinco están en funcionamiento, se basan en el intercambio D–H en gas amoniaco. Las otras dos plantas extraen deuterio del agua natural en un proceso que utiliza gas de sulfuro de hidrógeno a alta presión.
Si bien la India es autosuficiente en agua pesada para su propio uso, también exporta agua pesada para reactores.
Fórmula: D 2 o2
1yo
2
Datos a aproximadamente 18 K para 2 H 2 ( punto triple ):
En comparación con el hidrógeno en su composición natural en la Tierra, el deuterio puro ( 2H2 ) tiene un punto de fusión más alto (18,72 K frente a 13,99 K), un punto de ebullición más alto (23,64 frente a 20,27 K), una temperatura crítica más alta (38,3 frente a 32,94 K) y una presión crítica más alta (1,6496 frente a 1,2858 MPa). [19]
Las propiedades físicas de los compuestos de deuterio pueden exhibir efectos isotópicos cinéticos significativos y otras diferencias de propiedades físicas y químicas con respecto a los análogos del protio. El 2H2O , por ejemplo, es más viscoso que el H2O normal . [20] Existen diferencias en la energía y longitud de enlace para los compuestos de isótopos pesados de hidrógeno en comparación con el protio, que son mayores que las diferencias isotópicas en cualquier otro elemento. Los enlaces que involucran deuterio y tritio son algo más fuertes que los enlaces correspondientes en el protio, y estas diferencias son suficientes para causar cambios significativos en las reacciones biológicas. Las empresas farmacéuticas están interesadas en el hecho de que el 2H es más difícil de eliminar del carbono que el 1H. [21]
El deuterio puede reemplazar 1 H en las moléculas de agua para formar agua pesada ( 2 H2O ), que es aproximadamente un 10,6% más densa que el agua normal (de modo que el hielo hecho con ella se hunde en agua normal). El agua pesada es ligeramente tóxica en animales eucariotas , con un 25% de sustitución del agua corporal que causa problemas de división celular y esterilidad, y un 50% de sustitución que causa la muerte por síndrome citotóxico (insuficiencia de la médula ósea y del revestimiento gastrointestinal). Sin embargo, los organismos procariotas pueden sobrevivir y crecer en agua pesada pura, aunque se desarrollan lentamente. [22] A pesar de esta toxicidad, el consumo de agua pesada en circunstancias normales no supone una amenaza para la salud de los seres humanos. Se estima que una persona de 70 kg (154 lb) podría beber 4,8 litros (1,3 galones estadounidenses) de agua pesada sin consecuencias graves. [23] Pequeñas dosis de agua pesada (unos pocos gramos en humanos, que contienen una cantidad de deuterio comparable a la que normalmente está presente en el cuerpo) se utilizan rutinariamente como trazadores metabólicos inofensivos en humanos y animales.
El deuterón tiene espín +1 (" estado triplete ") y, por lo tanto, es un bosón . La frecuencia de RMN del deuterio es significativamente diferente de la del hidrógeno normal. La espectroscopia infrarroja también diferencia fácilmente muchos compuestos deuterados, debido a la gran diferencia en la frecuencia de absorción IR observada en la vibración de un enlace químico que contiene deuterio, frente al hidrógeno ligero. Los dos isótopos estables del hidrógeno también se pueden distinguir mediante espectrometría de masas .
El nucleón triplete deuterónico está apenas unido en E B =2,23 MeV y ninguno de los estados de energía superiores está ligado. El deuterón singlete es un estado virtual, con una energía de enlace negativa de~60 keV . No existe tal partícula estable, pero esta partícula virtual existe transitoriamente durante la dispersión inelástica neutrón-protón, lo que explica la sección transversal de dispersión de neutrones inusualmente grande del protón. [24]
El núcleo del deuterio se llama deuterón y tiene una masa de2.013 553 212 544 (15) Da 25] (poco más1,875 GeV/ c 2 [26] ).
El radio de carga del deuterón es2,127 78 (27) × 10 −15 m . [27]
Al igual que el radio del protón , las mediciones que utilizan deuterio muónico producen un resultado más pequeño:2.125 62 (78) fm . [28]
El deuterio es uno de los cinco únicos nucleidos estables con un número impar de protones y un número impar de neutrones. ( 2 H, 6 Li , 10 B , 14 N , 180m Ta ; los radionucleidos de larga vida 40 K , 50 V , 138 La , 176 Lu también se producen de forma natural). La mayoría de los núcleos impar-impares son inestables a la desintegración beta , porque los productos de desintegración son pares-pares y, por lo tanto, están más fuertemente unidos, debido a los efectos de apareamiento nuclear . El deuterio, sin embargo, se beneficia de tener su protón y neutrón acoplados a un estado de espín 1, lo que da una atracción nuclear más fuerte; el estado de espín 1 correspondiente no existe en el sistema de dos neutrones o dos protones, debido al principio de exclusión de Pauli que requeriría que una u otra partícula idéntica con el mismo espín tuviera algún otro número cuántico diferente, como el momento angular orbital . Pero el momento angular orbital de cualquiera de las partículas da una energía de enlace menor para el sistema, debido principalmente al aumento de la distancia de las partículas en el pronunciado gradiente de la fuerza nuclear. En ambos casos, esto hace que el diprotón y el dineutrón sean inestables .
El protón y el neutrón del deuterio pueden disociarse mediante interacciones de corriente neutra con neutrinos . La sección eficaz de esta interacción es comparativamente grande, y el deuterio se utilizó con éxito como objetivo de neutrinos en el experimento del Observatorio de Neutrinos de Sudbury .
El deuterio diatómico (D 2 o 2 H 2 ) tiene isómeros de espín nuclear orto y para como el hidrógeno diatómico, pero con diferencias en el número y población de estados de espín y niveles rotacionales , que ocurren porque el deuterón es un bosón con espín nuclear igual a uno. [29]
Debido a la similitud en masa y propiedades nucleares entre el protón y el neutrón, a veces se los considera como dos tipos simétricos del mismo objeto, un nucleón . Si bien solo el protón tiene carga eléctrica, esta suele ser insignificante debido a la debilidad de la interacción electromagnética en relación con la interacción nuclear fuerte . La simetría que relaciona al protón y al neutrón se conoce como isospín y se denota I (o, a veces, T ).
El isospín es una simetría SU(2) , como el espín ordinario , por lo que es completamente análogo a él. El protón y el neutrón, cada uno de los cuales tiene espín iso-1/2 , forman un doblete de isospín (análogo a un doblete de espín ), con un estado "abajo" (↓) siendo un neutrón y un estado "arriba" (↑) siendo un protón. [ cita requerida ] Un par de nucleones puede estar en un estado antisimétrico de isospín llamado singlete , o en un estado simétrico llamado triplete . En términos del estado "abajo" y el estado "arriba", el singlete es
Se trata de un núcleo con un protón y un neutrón, es decir, un núcleo de deuterio. El triplete es
y por lo tanto consta de tres tipos de núcleos, que se supone que son simétricos: un núcleo de deuterio (en realidad un estado muy excitado ), un núcleo con dos protones y un núcleo con dos neutrones. Estos estados no son estables.
La función de onda del deuterón debe ser antisimétrica si se utiliza la representación isospín (ya que un protón y un neutrón no son partículas idénticas, la función de onda no necesita ser antisimétrica en general). Aparte de su isospín, los dos nucleones también tienen distribuciones espaciales y de espín de su función de onda. Esta última es simétrica si el deuterón es simétrico bajo paridad (es decir, tiene una paridad "par" o "positiva"), y antisimétrica si el deuterón es antisimétrico bajo paridad (es decir, tiene una paridad "impar" o "negativa"). La paridad está completamente determinada por el momento angular orbital total de los dos nucleones: si es par, entonces la paridad es par (positiva), y si es impar, entonces la paridad es impar (negativa).
El deuterón, al ser un singlete de isospín, es antisimétrico ante el intercambio de nucleones debido al isospín y, por lo tanto, debe ser simétrico ante el doble intercambio de su espín y posición. Por lo tanto, puede estar en cualquiera de los dos estados diferentes siguientes:
En el primer caso, el deuterón es un triplete de espín, por lo que su espín total s es 1. Además, tiene paridad par y, por lo tanto, momento angular orbital par l . Cuanto menor sea su momento angular orbital, menor será su energía. Por lo tanto, el estado de energía más bajo posible tiene s = 1 , l = 0 .
En el segundo caso, el deuterón es un singlete de espín, por lo que su espín total s es 0. También tiene una paridad impar y, por lo tanto, un momento angular orbital impar l . Por lo tanto, el estado de energía más bajo posible tiene s = 0 , l = 1 .
Dado que s = 1 produce una atracción nuclear más fuerte, el estado fundamental del deuterio está en el estado s = 1 , l = 0 .
Las mismas consideraciones conducen a los posibles estados de un triplete de isospín que tienen s = 0 , l = par o s = 1 , l = impar . Por lo tanto, el estado de energía más baja tiene s = 1 , l = 1 , mayor que el del singlete de isospín.
El análisis que acabamos de dar es, de hecho, sólo aproximado, tanto porque el isospín no es una simetría exacta, y más importante aún, porque la interacción nuclear fuerte entre los dos nucleones está relacionada con el momento angular en la interacción espín-órbita que mezcla diferentes estados s y l . Es decir, s y l no son constantes en el tiempo (no conmutan con el hamiltoniano ), y con el tiempo un estado como s = 1 , l = 0 puede convertirse en un estado de s = 1 , l = 2 . La paridad sigue siendo constante en el tiempo, por lo que estos no se mezclan con estados l impares (como s = 0 , l = 1 ). Por lo tanto, el estado cuántico del deuterio es una superposición (una combinación lineal) del estado s = 1 , l = 0 y el estado s = 1 , l = 2 , aunque el primer componente sea mucho mayor. Como el momento angular total j también es un buen número cuántico (es una constante en el tiempo), ambos componentes deben tener el mismo j y, por lo tanto, j = 1. Este es el espín total del núcleo de deuterio.
En resumen, el núcleo de deuterio es antisimétrico en términos de isospín y tiene paridad de espín 1 e incluso (+1). El momento angular relativo de sus nucleones l no está bien definido y el deuterón es una superposición de l = 0 en su mayoría con algo de l = 2 .
Para encontrar teóricamente el momento dipolar magnético del deuterio μ , se utiliza la fórmula para el momento magnético nuclear
con
g ( l ) y g ( s ) son factores g de los nucleones.
Como el protón y el neutrón tienen valores diferentes para g ( l ) y g ( s ) , se deben separar sus contribuciones. Cada uno obtiene la mitad del momento angular orbital y el espín del deuterio . Se llega a
donde los subíndices p y n representan el protón y el neutrón, y g (l) n = 0 .
Utilizando las mismas identidades que aquí y utilizando el valor g (l) p = 1 , se obtiene el siguiente resultado, en unidades del magnetón nuclear μ N
Para el estado s = 1 , l = 0 ( j = 1 ), obtenemos
Para el estado s = 1 , l = 2 ( j = 1 ), obtenemos
El valor medido del momento dipolar magnético del deuterio es0,857 μ N , que es el 97,5% de laEl valor de 0,879 μN se obtiene simplemente sumando los momentos del protón y el neutrón. Esto sugiere que el estado del deuterio es, en una buena aproximación, el estado s = 1 , l = 0 , que se produce cuando ambos nucleones giran en la misma dirección, pero sus momentos magnéticos se restan debido al momento negativo del neutrón.
Pero el número experimental ligeramente inferior al que resulta de la simple adición de los momentos del protón y del neutrón (negativo) muestra que el deuterio es en realidad una combinación lineal del estado s = 1 , l = 0 con una ligera mezcla del estado s = 1 , l = 2 .
El dipolo eléctrico es cero como de costumbre .
El cuadrupolo eléctrico medido del deuterio es0,2859 e · fm 2 . Si bien el orden de magnitud es razonable, ya que el radio del deuterón es del orden de 1 femtómetro (ver más abajo) y su carga eléctrica es e, el modelo anterior no es suficiente para su cálculo. Más específicamente, el cuadrupolo eléctrico no obtiene una contribución del estado l = 0 (que es el dominante) y sí obtiene una contribución de un término que mezcla los estados l = 0 y l = 2 , porque el operador del cuadrupolo eléctrico no conmuta con el momento angular .
La última contribución es dominante en ausencia de una contribución pura de l = 0 , pero no se puede calcular sin conocer la forma espacial exacta de la función de onda de los nucleones dentro del deuterio.
Los momentos multipolares magnéticos y eléctricos más elevados no se pueden calcular mediante el modelo anterior, por razones similares.

El deuterio se utiliza en reactores de fisión moderados por agua pesada , generalmente como 2 H 2 O líquido, para ralentizar los neutrones sin la alta absorción de neutrones del hidrógeno ordinario. [30] Este es un uso comercial común para grandes cantidades de deuterio.
En los reactores de investigación , se utiliza 2 H 2 líquido en fuentes frías para moderar los neutrones a energías muy bajas y longitudes de onda apropiadas para experimentos de dispersión .
Experimentalmente, el deuterio es el nucleido más común utilizado en los diseños de reactores de fusión , especialmente en combinación con tritio , debido a la gran velocidad de reacción (o sección eficaz nuclear ) y el alto rendimiento energético de la reacción deuterio-tritio (DT). Existe una reacción de fusión 2 H– 3 He con un rendimiento aún mayor , aunque el punto de equilibrio de 2 H– 3 He es más alto que el de la mayoría de las demás reacciones de fusión; junto con la escasez de 3 He, esto lo hace improbable como fuente de energía práctica, al menos hasta que la DT y la fusión deuterio-deuterio (DD) se hayan realizado a escala comercial. La fusión nuclear comercial aún no es una tecnología consumada.
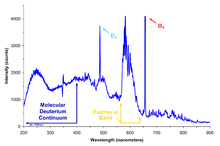
El deuterio se utiliza con mayor frecuencia en la espectroscopia de resonancia magnética nuclear de hidrógeno ( RMN de protones ) de la siguiente manera. La RMN normalmente requiere que los compuestos de interés se analicen disueltos en solución. Debido a que las propiedades de espín nuclear del deuterio difieren de las del hidrógeno ligero que suele estar presente en las moléculas orgánicas, los espectros de RMN de hidrógeno/protio son muy diferenciables de los del deuterio y, en la práctica, el deuterio no se "ve" con un instrumento de RMN ajustado para 1 H. Por lo tanto, los disolventes deuterados (incluida el agua pesada, pero también compuestos como el cloroformo deuterado , CDCl3 o C2HCl3 ) se utilizan rutinariamente en la espectroscopia de RMN, para permitir que solo se midan los espectros de hidrógeno ligero del compuesto de interés, sin interferencia de la señal del disolvente.
La espectroscopia de resonancia magnética nuclear también se puede utilizar para obtener información sobre el entorno del deuterón en muestras marcadas isotópicamente ( RMN de deuterio ). Por ejemplo, la configuración de las cadenas de hidrocarburos en las bicapas lipídicas se puede cuantificar utilizando RMN de deuterio en estado sólido con moléculas lipídicas marcadas con deuterio. [31]
Los espectros de RMN del deuterio son especialmente informativos en el estado sólido debido a su momento cuadrupolar relativamente pequeño en comparación con los de núcleos cuadrupolares más grandes, como el cloro-35, por ejemplo.
Los compuestos deuterados (es decir, en los que todos o algunos átomos de hidrógeno se reemplazan con deuterio) se utilizan a menudo como estándares internos en espectrometría de masas . Al igual que otras especies marcadas isotópicamente , estos estándares mejoran la precisión , aunque a menudo a un costo mucho menor que otros estándares marcados isotópicamente. Las moléculas deuteradas generalmente se preparan mediante reacciones de intercambio de isótopos de hidrógeno. [32] [33]
En química , bioquímica y ciencias ambientales , el deuterio se utiliza como un trazador isotópico estable y no radiactivo , por ejemplo, en la prueba del agua doblemente marcada . En las reacciones químicas y las vías metabólicas , el deuterio se comporta de manera algo similar al hidrógeno ordinario (con algunas diferencias químicas, como se señaló). Se puede distinguir del hidrógeno normal más fácilmente por su masa, utilizando espectrometría de masas o espectrometría infrarroja . El deuterio se puede detectar mediante espectroscopia infrarroja de femtosegundos , ya que la diferencia de masa afecta drásticamente la frecuencia de las vibraciones moleculares; las vibraciones del enlace 2H -carbono se encuentran en regiones espectrales libres de otras señales.
Las mediciones de pequeñas variaciones en las abundancias naturales de deuterio, junto con las de los isótopos pesados estables de oxígeno 17 O y 18 O, son importantes en hidrología , para rastrear el origen geográfico de las aguas de la Tierra. Los isótopos pesados de hidrógeno y oxígeno en el agua de lluvia ( agua meteórica ) se enriquecen en función de la temperatura ambiental de la región en la que cae la precipitación (y, por lo tanto, el enriquecimiento está relacionado con la latitud). El enriquecimiento relativo de los isótopos pesados en el agua de lluvia (como se hace referencia al agua media del océano), cuando se representa gráficamente en función de la temperatura, cae de manera predecible a lo largo de una línea llamada línea global de agua meteórica (GMWL). Este gráfico permite identificar muestras de agua originada por precipitación junto con información general sobre el clima en el que se originó. Los procesos de evaporación y otros procesos en los cuerpos de agua, y también los procesos de agua subterránea, también alteran diferencialmente las proporciones de isótopos pesados de hidrógeno y oxígeno en aguas dulces y saladas, de formas características y a menudo regionalmente distintivas. [34] La relación de concentración de 2 H a 1 H se indica generalmente con un delta como δ 2 H y los patrones geográficos de estos valores se representan en mapas denominados isopaisajes. Los isótopos estables se incorporan a las plantas y los animales y un análisis de las proporciones en un ave migratoria o un insecto puede ayudar a sugerir una guía aproximada de sus orígenes. [35] [36]
Las técnicas de dispersión de neutrones se benefician especialmente de la disponibilidad de muestras deuteradas: las secciones eficaces de 1 H y 2 H son muy distintas y de signo diferente, lo que permite la variación del contraste en dichos experimentos. Además, un problema molesto del hidrógeno normal es su gran sección eficaz incoherente de neutrones, que es nula para 2 H. La sustitución del hidrógeno normal por deuterio reduce así el ruido de dispersión.
El hidrógeno es un componente importante y principal en todos los materiales de la química orgánica y las ciencias de la vida, pero apenas interactúa con los rayos X. Como los átomos de hidrógeno (incluido el deuterio) interactúan fuertemente con los neutrones, las técnicas de dispersión de neutrones, junto con una instalación de deuteración moderna, [37] llenan un nicho en muchos estudios de macromoléculas en biología y muchas otras áreas.
Véase más abajo. La mayoría de las estrellas, incluido el Sol, generan energía durante la mayor parte de sus vidas fusionando hidrógeno para formar elementos más pesados; sin embargo, esta fusión de hidrógeno ligero (protio) nunca ha tenido éxito en las condiciones que se pueden alcanzar en la Tierra. Por lo tanto, toda fusión artificial, incluida la fusión de hidrógeno en las bombas de hidrógeno, requiere hidrógeno pesado (deuterio, tritio o ambos).
Un fármaco deuterado es un medicamento de molécula pequeña en el que uno o más de los átomos de hidrógeno de la molécula del fármaco han sido reemplazados por deuterio. Debido al efecto isotópico cinético , los fármacos que contienen deuterio pueden tener tasas de metabolismo significativamente más bajas y, por lo tanto, una vida media más larga . [38] [39] [40] En 2017, la deutetrabenazina se convirtió en el primer fármaco deuterado en recibir la aprobación de la FDA. [41]
El deuterio se puede utilizar para reforzar enlaces C–H vulnerables a la oxidación específicos dentro de nutrientes esenciales o condicionalmente esenciales , [42] como ciertos aminoácidos o ácidos grasos poliinsaturados (PUFA), haciéndolos más resistentes al daño oxidativo. Los ácidos grasos poliinsaturados deuterados , como el ácido linoleico , ralentizan la reacción en cadena de la peroxidación lipídica que daña las células vivas. [43] [44] El éster etílico deuterado del ácido linoleico ( RT001 ), desarrollado por Retrotope, se encuentra en un ensayo de uso compasivo en la distrofia neuroaxonal infantil y ha completado con éxito un ensayo de fase I/II en la ataxia de Friedreich . [45] [41]
Las vacunas vivas, como la vacuna oral contra la polio , se pueden estabilizar con deuterio, ya sea solo o en combinación con otros estabilizadores como MgCl 2 . [46]
Se ha demostrado que el deuterio alarga el período de oscilación del reloj circadiano cuando se dosifica en ratas, hámsteres y dinoflagelados Gonyaulax . [47] [48] [49] [50] En ratas, la ingesta crónica de 25% de 2 H 2 O altera el ritmo circadiano al alargar el período circadiano de los ritmos dependientes del núcleo supraquiasmático en el hipotálamo del cerebro. [49] Los experimentos en hámsteres también respaldan la teoría de que el deuterio actúa directamente sobre el núcleo supraquiasmático para alargar el período circadiano de libre funcionamiento. [51]
La existencia de isótopos no radiactivos de elementos más ligeros se había sospechado en estudios del neón ya en 1913, [ cita requerida ] y se demostró mediante espectrometría de masas de elementos ligeros en 1920. [ cita requerida ] En ese momento aún no se había descubierto el neutrón, y la teoría predominante era que los isótopos de un elemento difieren por la existencia de protones adicionales en el núcleo acompañados de un número igual de electrones nucleares . En esta teoría, el núcleo de deuterio con masa dos y carga uno contendría dos protones y un electrón nuclear. Sin embargo, se esperaba que el elemento hidrógeno con una masa atómica promedio medida muy cercana a1 Da , la masa conocida del protón, siempre tiene un núcleo compuesto por un solo protón (una partícula conocida) y no podía contener un segundo protón. Por lo tanto, se pensaba que el hidrógeno no tenía isótopos pesados. [ cita requerida ]

Fue detectado por primera vez espectroscópicamente a fines de 1931 por Harold Urey , un químico de la Universidad de Columbia . El colaborador de Urey, Ferdinand Brickwedde , destiló cinco litros de hidrógeno líquido producido criogénicamente para1 ml de líquido, utilizando el laboratorio de física de baja temperatura que se había establecido recientemente en la Oficina Nacional de Normas (ahora Instituto Nacional de Normas y Tecnología ) en Washington, DC. La técnica se había utilizado anteriormente para aislar isótopos pesados de neón. La técnica de ebullición criogénica concentró la fracción del isótopo de masa 2 del hidrógeno a un grado que hizo que su identificación espectroscópica fuera inequívoca. [52] [53]
Urey creó los nombres protio , deuterio y tritio en un artículo publicado en 1934. El nombre se basa en parte en el consejo de Gilbert N. Lewis, quien había propuesto el nombre "deutio". El nombre proviene del griego deuteros 'segundo', y el núcleo se llamaría "deuterón" o "deutón". Tradicionalmente, a los isótopos y elementos nuevos se les daba el nombre que su descubridor decidía. Algunos científicos británicos, como Ernest Rutherford , querían llamar al isótopo "diplogen", del griego diploos 'doble', y al núcleo se le llamaría "diplon". [4] [54]
La cantidad inferida para la abundancia normal de deuterio era tan pequeña (solo alrededor de 1 átomo en 6400 átomos de hidrógeno en agua de mar [156 partes por millón]) que no había afectado notablemente las mediciones anteriores de la masa atómica (promedio) del hidrógeno. Esto explica por qué no se había sospechado antes. Urey fue capaz de concentrar agua para mostrar un enriquecimiento parcial de deuterio. Lewis , el asesor de posgrado de Urey en Berkeley , había preparado y caracterizado las primeras muestras de agua pesada pura en 1933. El descubrimiento del deuterio, que se produjo antes del descubrimiento del neutrón en 1932, fue un shock experimental para la teoría ; pero cuando se informó sobre el neutrón, lo que hizo más explicable la existencia del deuterio, Urey recibió el Premio Nobel de Química solo tres años después del aislamiento del isótopo. Lewis estaba profundamente decepcionado por la decisión del Comité Nobel en 1934 y varios administradores de alto rango en Berkeley creyeron que esta decepción jugó un papel central en su suicidio una década después. [55] [56] [57] [4]
Poco antes de la guerra, Hans von Halban y Lew Kowarski trasladaron sus investigaciones sobre moderación de neutrones de Francia a Gran Bretaña, contrabandeando todo el suministro mundial de agua pesada (que se había fabricado en Noruega) en veintiséis bidones de acero. [58] [59]
Durante la Segunda Guerra Mundial , se sabía que la Alemania nazi estaba realizando experimentos utilizando agua pesada como moderador para el diseño de un reactor nuclear . Dichos experimentos eran motivo de preocupación porque podrían permitirles producir plutonio para una bomba atómica . En última instancia, esto condujo a la operación aliada llamada " sabotaje noruego con agua pesada ", cuyo propósito era destruir la planta de producción y enriquecimiento de deuterio de Vemork en Noruega. En ese momento, esto se consideró importante para el posible progreso de la guerra.
Después de terminar la Segunda Guerra Mundial, los aliados descubrieron que Alemania no estaba poniendo tanto esfuerzo serio en el programa como se había pensado anteriormente. Los alemanes habían completado solo un pequeño reactor experimental parcialmente construido (que había estado escondido) y no habían podido sostener una reacción en cadena. Al final de la guerra, los alemanes ni siquiera tenían una quinta parte de la cantidad de agua pesada necesaria para hacer funcionar el reactor, [ aclaración necesaria ] en parte debido a la operación de sabotaje con agua pesada de Noruega. Sin embargo, incluso si los alemanes hubieran tenido éxito en poner en funcionamiento un reactor (como lo hizo EE. UU. con Chicago Pile-1 a fines de 1942), todavía habrían estado al menos a varios años de desarrollar una bomba atómica . El proceso de ingeniería, incluso con el máximo esfuerzo y financiación, requirió aproximadamente dos años y medio (desde el primer reactor crítico hasta la bomba) tanto en EE. UU. como en la URSS , por ejemplo.

El dispositivo Ivy Mike de 62 toneladas construido por los Estados Unidos y que explotó el 1 de noviembre de 1952, fue la primera " bomba de hidrógeno " (bomba termonuclear) completamente exitosa. En este contexto, fue la primera bomba en la que la mayor parte de la energía liberada provino de etapas de reacción nuclear que siguieron a la etapa de fisión nuclear primaria de la bomba atómica . La bomba Ivy Mike era un edificio similar a una fábrica, más que un arma lanzable. En su centro, un frasco de vacío cilíndrico muy grande y aislado o criostato , contenía deuterio líquido criogénico en un volumen de aproximadamente 1000 litros (160 kilogramos de masa, si este volumen se hubiera llenado por completo). Luego, se utilizó una bomba atómica convencional (la "primaria") en un extremo de la bomba para crear las condiciones de temperatura y presión extremas que se necesitaban para desencadenar la reacción termonuclear .
En pocos años se desarrollaron las llamadas bombas de hidrógeno "secas" que no necesitaban hidrógeno criogénico. La información publicada sugiere que todas las armas termonucleares construidas desde entonces contienen compuestos químicos de deuterio y litio en sus etapas secundarias. El material que contiene el deuterio es principalmente deuteruro de litio , y el litio consiste en el isótopo litio-6 . Cuando el litio-6 es bombardeado con neutrones rápidos de la bomba atómica, se produce tritio (hidrógeno-3), y luego el deuterio y el tritio entran rápidamente en fusión termonuclear , liberando abundante energía, helio-4 e incluso más neutrones libres. Se cree que las armas de fusión "puras" como la Bomba del Zar están obsoletas. En la mayoría de las armas termonucleares modernas ("potenciadas"), la fusión proporciona directamente solo una pequeña fracción de la energía total. La fisión de un uranio-238 alterado natural por neutrones rápidos producidos a partir de la fusión D-T representa una liberación de energía mucho mayor (es decir, potenciada) que la propia reacción de fusión.
En agosto de 2018, los científicos anunciaron la transformación del deuterio gaseoso en una forma metálica líquida . Esto puede ayudar a los investigadores a comprender mejor los planetas gigantes gaseosos , como Júpiter, Saturno y algunos exoplanetas , ya que se cree que estos planetas contienen una gran cantidad de hidrógeno metálico líquido, que puede ser responsable de sus poderosos campos magnéticos observados . [60] [61]
Un antideuterón es la contraparte de antimateria del núcleo de deuterio, que consta de un antiprotón y un antineutrón . El antideuterón se produjo por primera vez en 1965 en el Sincrotrón de Protones del CERN [62] y en el Sincrotrón de Gradiente Alternado del Laboratorio Nacional de Brookhaven . [63] Un átomo completo, con un positrón orbitando el núcleo, se llamaría antideuterio , pero a fecha de 2019 [actualizar]aún no se ha creado el antideuterio. El símbolo propuesto para el antideuterio es
D
, es decir, D con barra superior. [64]