El etilenglicol ( nombre IUPAC : etano-1,2-diol) es un compuesto orgánico (un diol vecinal [7] ) con la fórmula ( CH2OH ) 2 . Se utiliza principalmente para dos fines: como materia prima en la fabricación de fibras de poliéster y para formulaciones anticongelantes . Es un líquido inodoro, incoloro, inflamable y viscoso. Tiene un sabor dulce, pero es tóxico en altas concentraciones . Esta molécula ha sido observada en el espacio exterior. [8]
El etilenglicol se produce a partir del etileno (eteno), a través del intermedio óxido de etileno . El óxido de etileno reacciona con el agua para producir etilenglicol según la ecuación química :
C 2 H 4 O + H 2 O → HO − CH 2 CH 2 −OH
Esta reacción puede ser catalizada por ácidos o bases , o puede ocurrir a pH neutro bajo temperaturas elevadas. Los mayores rendimientos de etilenglicol se dan a pH ácido o neutro con un gran exceso de agua. Bajo estas condiciones, se pueden lograr rendimientos de etilenglicol del 90%. Los principales subproductos son los oligómeros dietilenglicol , trietilenglicol y tetraetilenglicol . La separación de estos oligómeros y agua requiere mucha energía. La producción mundial de etilenglicol fue de ~20 Mt en 2010. [9]
Se logra una mayor selectividad mediante el uso del proceso OMEGA de Shell . En el proceso OMEGA, el óxido de etileno se convierte primero con dióxido de carbono (CO 2 ) en carbonato de etileno . Luego, este anillo se hidroliza con un catalizador de base en un segundo paso para producir monoetilenglicol con una selectividad del 98 %. [10] El dióxido de carbono se libera nuevamente en este paso y se puede volver a introducir en el circuito del proceso. El dióxido de carbono proviene en parte de la producción de óxido de etileno, donde una parte del etileno se oxida completamente .
El etilenglicol se produce a partir de monóxido de carbono en países con grandes reservas de carbón y regulaciones ambientales menos estrictas. La carbonilación oxidativa del metanol a oxalato de dimetilo ofrece un enfoque prometedor para la producción de C
1-etilenglicol a base de oxalato de dimetilo. [11] El oxalato de dimetilo se puede convertir en etilenglicol con altos rendimientos (94,7%) [12] mediante hidrogenación con un catalizador de cobre: [13]
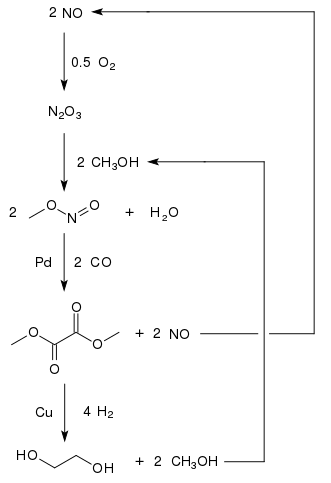
Como el metanol se recicla, solo se consumen monóxido de carbono, hidrógeno y oxígeno. Una planta con una capacidad de producción de 200 000 toneladas de etilenglicol por año se encuentra en Mongolia Interior , y una segunda planta en la provincia china de Henan con una capacidad de 250 000 toneladas por año estaba programada para 2012. [14] En 2015 [actualizar], cuatro plantas en China con una capacidad de 200 000 t/a cada una estaban operando y al menos 17 más seguirán su ejemplo. [15]
El etilenglicol se puede producir reciclando sus derivados poliméricos, como el tereftalato de polietileno . [16]
Según la mayoría de las fuentes, el químico francés Charles-Adolphe Wurtz ( 1817-1884) preparó por primera vez etilenglicol en 1856. [17] Primero trató el "yoduro de etileno" ( C2H4I2 ) con acetato de plata y luego hidrolizó el "diacetato de etileno" resultante con hidróxido de potasio . Wurtz nombró a su nuevo compuesto "glicol" porque compartía cualidades tanto con el alcohol etílico ( con un grupo hidroxilo) como con la glicerina (con tres grupos hidroxilo). [18] En 1859, Wurtz preparó etilenglicol mediante la hidratación del óxido de etileno . [19] Parece que no hubo fabricación ni aplicación comercial de etilenglicol antes de la Primera Guerra Mundial , cuando se sintetizó a partir del dicloruro de etileno en Alemania y se usó como sustituto del glicerol en la industria de los explosivos .
En los Estados Unidos, la producción semicomercial de etilenglicol a través de clorhidrina de etileno comenzó en 1917. La primera planta comercial de glicol a gran escala fue construida en 1925 en South Charleston, West Virginia , por Carbide and Carbon Chemicals Co. (ahora Union Carbide Corp.). En 1929, casi todos los fabricantes de dinamita utilizaban etilenglicol . En 1937, Carbide puso en marcha la primera planta basada en el proceso de Lefort para la oxidación en fase de vapor de etileno a óxido de etileno. Carbide mantuvo el monopolio del proceso de oxidación directa hasta 1953, cuando se comercializó el proceso de diseño científico y se ofreció para su licencia.
El principal uso del etilenglicol es como agente anticongelante en el refrigerante , por ejemplo, en automóviles y sistemas de aire acondicionado que colocan el enfriador o los manipuladores de aire en el exterior o deben enfriar por debajo de la temperatura de congelación del agua. En los sistemas de calefacción/refrigeración geotérmica , el etilenglicol es el fluido que transporta el calor mediante el uso de una bomba de calor geotérmica . El etilenglicol obtiene energía de la fuente (lago, océano, pozo de agua ) o disipa el calor en el disipador, dependiendo de si el sistema se utiliza para calefacción o refrigeración.
El etilenglicol puro tiene una capacidad calorífica específica que es aproximadamente la mitad de la del agua. Por lo tanto, si bien proporciona protección contra la congelación y un punto de ebullición más alto, el etilenglicol reduce la capacidad calorífica específica de las mezclas de agua en relación con el agua pura. Una mezcla 1:1 en masa tiene una capacidad calorífica específica de aproximadamente 3140 J/(kg·°C) (0,75 BTU/(lb·°F)), tres cuartas partes de la del agua pura, por lo que se requieren mayores caudales en las comparaciones del mismo sistema con el agua.
La mezcla de etilenglicol con agua proporciona beneficios adicionales a las soluciones refrigerantes y anticongelantes, como prevenir la corrosión y la degradación ácida, además de inhibir el crecimiento de la mayoría de los microbios y hongos. [20] Las mezclas de etilenglicol y agua a veces se denominan informalmente en la industria concentrados, compuestos, mezclas o soluciones de glicol.
Tabla de propiedades térmicas y físicas del etilenglicol líquido saturado: [21] [22]
El etilenglicol puro se congela a aproximadamente -12 °C (10,4 °F) pero, cuando se mezcla con agua, la mezcla se congela a una temperatura más baja. Por ejemplo, una mezcla de 60% de etilenglicol y 40% de agua se congela a -45 °C (-49 °F). [23] El dietilenglicol se comporta de manera similar. La depresión del punto de congelación de algunas mezclas se puede explicar como una propiedad coligativa de las soluciones pero, en mezclas altamente concentradas como el ejemplo, se esperan desviaciones del comportamiento ideal de la solución debido a la influencia de las fuerzas intermoleculares . Es importante señalar que, aunque el agua pura y destilada tendrá una mayor capacidad calorífica específica que cualquier mezcla de anticongelante y agua, los anticongelantes comerciales también suelen contener un aditivo anticorrosivo para evitar que el agua pura corroa los conductos de refrigerante en el bloque del motor, la(s) culata(s), la bomba de agua y el radiador.
Existe una diferencia en la proporción de mezcla, dependiendo de si se trata de etilenglicol o propilenglicol. Para el etilenglicol, las proporciones de mezcla son típicamente 30/70 y 35/65, mientras que para el propilenglicol son típicamente 35/65 y 40/60. Es importante que la mezcla sea resistente a las heladas a la temperatura de funcionamiento más baja. [24]
Debido a las bajas temperaturas de congelación, el etilenglicol se utiliza como líquido descongelante para parabrisas y aviones, como anticongelante en motores de automóviles y como componente de mezclas de vitrificación (anticristización) para la conservación a baja temperatura de tejidos y órganos biológicos.
El uso de etilenglicol no sólo reduce el punto de congelación de las mezclas acuosas, sino que también eleva su punto de ebullición. Esto hace que el rango de temperatura de funcionamiento de los fluidos de transferencia de calor se amplíe en ambos extremos de la escala de temperaturas. El aumento de la temperatura de ebullición se debe a que el etilenglicol puro tiene un punto de ebullición mucho más alto y una presión de vapor más baja que el agua pura.

En la industria del plástico , el etilenglicol es un precursor importante de las fibras y resinas de poliéster . El tereftalato de polietileno , que se utiliza para fabricar botellas de plástico para refrescos , se prepara a partir de etilenglicol.
El etilenglicol se utiliza en la industria del gas natural para eliminar el vapor de agua del gas natural antes de su posterior procesamiento, de forma muy similar al trietilenglicol (TEG).
Debido a su alto punto de ebullición y a su afinidad por el agua, el etilenglicol es un desecante útil . El etilenglicol se utiliza ampliamente para inhibir la formación de clatratos (hidratos) de gas natural en tuberías multifásicas largas que transportan gas natural desde yacimientos de gas remotos hasta una instalación de procesamiento de gas. El etilenglicol se puede recuperar del gas natural y reutilizar como inhibidor después de un tratamiento de purificación que elimina el agua y las sales inorgánicas.
El gas natural se deshidrata con etilenglicol. En esta aplicación, el etilenglicol fluye hacia abajo desde la parte superior de una torre y se encuentra con una mezcla ascendente de vapor de agua y gases de hidrocarburos . El gas seco sale por la parte superior de la torre. El glicol y el agua se separan y el glicol se recicla. En lugar de eliminar el agua, el etilenglicol también se puede utilizar para reducir la temperatura a la que se forman los hidratos . La pureza del glicol utilizado para la supresión de hidratos (monoetilenglicol) suele rondar el 80%, mientras que la pureza del glicol utilizado para la deshidratación (trietilenglicol) suele ser del 95 a más del 99%. Además, la tasa de inyección para la supresión de hidratos es mucho menor que la tasa de circulación en una torre de deshidratación de glicol .
Los usos menores del etilenglicol incluyen la fabricación de condensadores, como intermediario químico en la fabricación de 1,4-dioxano , como aditivo para prevenir la corrosión en sistemas de refrigeración líquida para ordenadores personales y en el interior de los dispositivos de lentes de televisores de retroproyección de tipo tubo de rayos catódicos. El etilenglicol también se utiliza en la fabricación de algunas vacunas , pero no está presente en estas inyecciones. Se utiliza como ingrediente menor (1-2%) en el betún para zapatos y también en algunas tintas y tintes. El etilenglicol se ha utilizado como tratamiento contra la putrefacción y los hongos en la madera, tanto como preventivo como tratamiento posterior. Se ha utilizado en algunos casos para tratar objetos de madera parcialmente podridos que se exhibirán en museos. Es uno de los pocos tratamientos que tienen éxito en el tratamiento de la putrefacción en barcos de madera y es relativamente barato. El etilenglicol también puede ser uno de los ingredientes menores en las soluciones de limpieza de pantallas, junto con el ingrediente principal, el alcohol isopropílico . El etilenglicol se utiliza habitualmente como conservante de muestras biológicas, especialmente en las escuelas secundarias durante la disección, como una alternativa más segura al formaldehído . También se utiliza como parte del fluido hidráulico a base de agua que se utiliza para controlar los equipos submarinos de producción de petróleo y gas.
Aunque su uso como precursor de los poliésteres queda eclipsado , el etilenglicol es útil en áreas más especializadas de la química orgánica.
Sirve como grupo protector en la síntesis orgánica para la manipulación de cetonas y aldehídos. [25] [26] En un ejemplo, la isoforona se protegió usando etilenglicol: [27]

El dioxalano derivado del glicol del acetoacetato de etilo es una fructona de fragancia comercial . [28]
El dióxido de silicio se disuelve lentamente en etilenglicol caliente en presencia de una base de metal alcalino para producir silicatos. [29]
El etilenglicol tiene una toxicidad relativamente alta para los mamíferos cuando se ingiere, aproximadamente a la par del metanol , con una LD50 oral Lo = 786 mg/kg para los humanos. [30] El mayor peligro se debe a su sabor dulce , que puede atraer a niños y animales. Tras la ingestión, el etilenglicol se oxida a ácido glicólico , que, a su vez, se oxida a ácido oxálico , que es tóxico . Este y sus subproductos tóxicos afectan primero al sistema nervioso central , luego al corazón y finalmente a los riñones. La ingestión de cantidades suficientes es fatal si no se trata. [31] Solo en los EE. UU. se registran varias muertes anualmente. [32]
Existen productos anticongelantes para uso automotriz que contienen propilenglicol en lugar de etilenglicol. Generalmente se los considera más seguros de usar, ya que el propilenglicol no es tan agradable al paladar [nota 1] y se convierte en ácido láctico en el cuerpo , un producto normal del metabolismo y el ejercicio. [35]
En 2012, Australia, el Reino Unido y diecisiete estados de los EE. UU. exigen la adición de un sabor amargo ( benzoato de denatonio ) al anticongelante. En diciembre de 2012, los fabricantes de anticongelantes estadounidenses acordaron voluntariamente agregar un sabor amargo a todos los anticongelantes que se vendan en el mercado de consumo de los EE. UU. [36]
En 2022, varios cientos de niños murieron de insuficiencia renal aguda en Indonesia y Gambia porque el jarabe de paracetamol elaborado por Maiden Pharmaceuticals, con sede en Nueva Delhi, contenía etilenglicol y dietilenglicol , ingredientes que se han relacionado con muertes infantiles por lesión renal aguda en Gambia. [37] En diciembre de 2022, el Ministerio de Salud de Uzbekistán dijo que los niños murieron como resultado del etilenglicol en el jarabe para la tos elaborado por Marion Biotech, que tiene su sede en Noida , cerca de Nueva Delhi. [38]
El etilenglicol es una sustancia química que se produce en grandes cantidades . Se descompone en el aire en unos 10 días y en el agua o el suelo en unas pocas semanas. Entra al medio ambiente a través de la dispersión de productos que contienen etilenglicol, especialmente en aeropuertos, donde se utiliza en agentes antihielo para pistas y aviones. [39] Si bien las dosis bajas y prolongadas de etilenglicol no muestran toxicidad, en dosis casi letales (≥ 1000 mg/kg por día) el etilenglicol actúa como teratógeno . "Según una base de datos bastante extensa, induce variaciones y malformaciones esqueléticas en ratas y ratones por todas las vías de exposición". [40]
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace )(PDF; 5,4 MB), Prospecto 2011.{{cite book}}: CS1 maint: nombres numéricos: lista de autores ( enlace )