(+)-Discodermolida es un producto natural policétido que se ha descubierto que estabiliza los microtúbulos . Gunasekera y sus colaboradores del Harbor Branch Oceanographic Institute aislaron (+)-discodermolida de la esponja de aguas profundas Discodermia dissoluta en 1990. [1] Se descubrió que (+)-discodermolida es un potente inhibidor del crecimiento de células tumorales en varias líneas celulares de cáncer MDR. (+)-discodermolida también muestra algunas características únicas, incluida una estructura de cadena principal lineal, propiedades inmunosupresoras tanto in vitro como in vivo, [2] [3] potente inducción de un fenotipo de senescencia acelerada, [4] y actividad antiproliferativa sinérgica en combinación con paclitaxel . [5] La discodermolida fue reconocida como uno de los promotores naturales más potentes del ensamblaje de la tubulina . Un gran número de esfuerzos para la síntesis total de (+)-discodermolida fueron dirigidos por sus interesantes actividades biológicas y la extrema escasez de fuentes naturales (0,002% p/p de esponja marina congelada). El suministro de compuestos necesario para ensayos clínicos completos no puede satisfacerse mediante la recolección, el aislamiento y la purificación. A partir de 2005, los intentos de síntesis o semisíntesis por fermentación han resultado infructuosos. Como resultado, toda la discodermolida utilizada en estudios preclínicos y ensayos clínicos ha provenido de síntesis total a gran escala. [6]
El químico Dr. Sarath Gunasekera y el biólogo Dr. Ross Longley, científicos del Instituto Oceanográfico Harbor Branch , aislaron por primera vez la discodermolida en 1990 de la esponja marina caribeña Discodermia dissoluta. [1] La esponja contenía 0,002 % de discodermolida (7 mg/434 g de esponja). Dado que el compuesto es sensible a la luz, la esponja debe recolectarse a una profundidad mínima de 33 metros. Inicialmente se descubrió que la discodermolida tenía actividades inmunosupresoras y antifúngicas . [ cita requerida ]
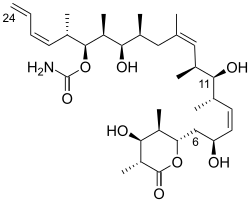
(+)-discodermolida tiene una cadena principal de polipropionato lineal, puntuada por enlaces Z-olefínicos en C(8,9) y C(13,14), un sustituyente Z-dieno terminal en C(21–24), 13 centros estereogénicos (incluyendo cuatro hidroxilos secundarios y siete sustituyentes metilo), un carbamato y una D- lactona completamente sustituida . La estereoquímica relativa se determinó mediante cristalografía de rayos X. [ 1] La estereoquímica absoluta de (+)-discodermolida fue informada por Schreiber y sus colaboradores en 1993. [7] La discodermolida adopta una conformación en forma de U , donde los (Z)-alquenos internos actúan como bloqueos conformacionales al minimizar la tensión alílica y las interacciones sin- pentano a lo largo de la cadena principal. La D- lactona se mantiene en una conformación similar a un barco .
La evaluación biológica inicial de (+)-discodermolida por el grupo Longley mostró que tiene propiedades inmunosupresoras tanto in vitro [2] como in vivo . [3] La respuesta inmunosupresora se observó a una concentración relativamente baja que (+)-discodermolida no fue tóxica in vitro. Tanto en leucocitos de sangre periférica humana como en esplenocitos murinos , se encontró que (+)-discodermolida suprimía la reacción linfocítica mixta bidireccional . Además, la respuesta mitogénica de los leucocitos de sangre periférica también fue suprimida por (+)-discodermolida. Los experimentos de seguimiento demostraron que (+)-discodermolida también tiene efectos antiproliferativos en varias otras líneas celulares no linfoides . [ cita requerida ]
El (+)-discodermolido es un agente antiproliferativo muy potente. [5] Las células de hibridoma Do11.10T murino tratadas con (+)-discodermolido no pudieron continuar con el ciclo celular normal. En los controles no tratados, el 68% de las células se encontraron en la fase G1, el 31% en la fase S y menos del 1% en la fase G2/M. Sin embargo, después de 3 horas de tratamiento con (+)-discodermolido, el 52% se encontró en la fase G1, el 40% en la fase S y el 58% en las fases G2 y M. Este resultado indicó que el (+)-discodermolido bloquea el ciclo celular en las fases G2 y M. También se encontró que este efecto de inhibición era reversible. Las células reanudan el ciclo normal dentro de las 48 horas posteriores a la eliminación del (+)-discodermolido del medio de cultivo celular. El (+)-discodermolido detiene el ciclo celular mediante la unión y estabilización de la red de microtúbulos . La hiperestabilización del huso mitótico provoca la detención del ciclo celular en las fases G2 y M y, finalmente, conduce a la muerte celular por apoptosis . A una concentración de 10 μM, la (+)-discodermolida puede promover el ensamblaje de microtúbulos sin proteínas asociadas a los microtúbulos ni GTP. Con la proteína asociada a los microtúbulos y el GTP presentes, la (+)-discodermolida a una concentración de 10 μM puede iniciar la polimerización de la tubulina a 0 °C. [8] [9]
(+)-Discodermolida es capaz de inducir el fenotipo de senescencia . (+)-Discodermolida tratadas con células Hela , MDA-MB-231 , HCT-116 y A549 [4] mostraron niveles moderados a altos de actividad de β-galactosidasa en las cuatro líneas celulares. La actividad de β-galactosidasa es uno de los sellos distintivos de la senescencia . [10] Otras características comunes incluyen un cese de la proliferación y un área citoplasmática aumentada . (+)-Discodermolida también indujo la regulación positiva y la activación en tres proteínas (p66Shc, Erk1 y Erk2).
También se ha descubierto que el (+)-discodermolido es neuroprotector en investigaciones recientes sobre el Alzheimer. [11] La característica estabilizadora de microtúbulos del (+)-discodermolido se utilizó para restaurar las funciones neuronales que se habían visto alteradas por el secuestro inducido por amiloide . Se sabe que la proteína tau estabiliza la red de microtúbulos en neuronas sanas . [12] Sirvió como la "vía del tren" sobre la que se entregan actina, tubulina , mitocondrias , enzimas relacionadas con neurotransmisores y vesículas que transportan proteínas mensajeras. La presencia de amiloide en la célula podría provocar la agregación de la proteína tau y la reducción del número de microtúbulos . En un modelo de ratón transgénico para la tauopatía humana , el (+)-discodermolido estabiliza los microtúbulos y restaura el transporte axonal rápido en las células, compensando la pérdida de función causada por la agregación de la proteína tau . Los ratones con problemas motores mostraron una restauración completa del movimiento normal con el tratamiento con (+)-discodermolido.
La discodermolida compite con el paclitaxel [13] por la unión a los microtúbulos , pero con mayor afinidad y también es eficaz en células cancerosas resistentes al paclitaxel y a la epotilona . La discodermolida también parece demostrar una conformación molecular tridimensional notablemente consistente en estado sólido, en solución y cuando se une a la tubulina ; las moléculas con la flexibilidad conformacional de la discodermolida suelen presentar conformaciones muy diferentes en diferentes entornos.
Muchas esponjas de origen marino no pueden cultivarse fuera de su entorno natural. Encontrar los genes responsables de la biosíntesis de policétidos derivados de esponjas es una tarea difícil de lograr debido a la naturaleza colonial de las esponjas. Los científicos aún no pueden cultivar las esponjas; por lo tanto, aún no se han descubierto los genes para la biosíntesis de (+)-discodermolida. [14]
Se ha realizado un intenso esfuerzo para lograr la síntesis total de (+)-discodermolida con el fin de satisfacer el creciente interés por estudiar su perfil clínico . Diferentes grupos de investigación han publicado más de una docena de síntesis. Después de una década de trabajo, las síntesis de discodermolida se han vuelto más convergentes y más prácticas. Todos los enfoques de síntesis totales comenzaron con la construcción de tres fragmentos principales de complejidad aproximadamente equivalente, cada uno de los cuales contiene la tríada metil-hidroxi-metil de centros contiguos que coincide con la estereogenicidad del objetivo de discodermolida. A continuación se presentan tres ejemplos de análisis retrosintéticos de (+)-discodermolida:
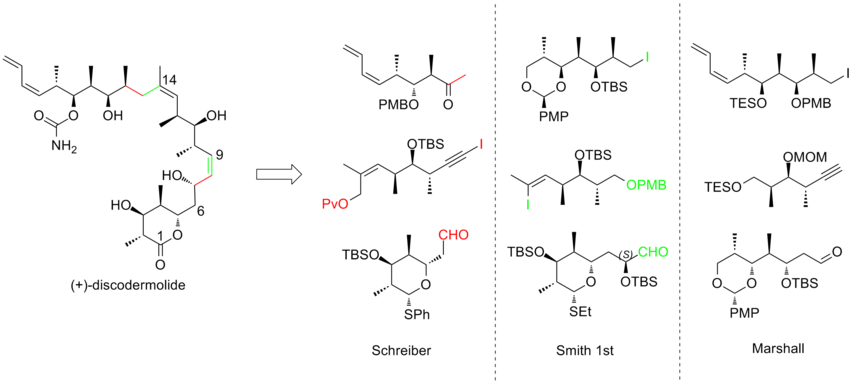
En 1993, Schreiber y sus colaboradores [7] informaron sobre la primera síntesis total del antípoda no natural (-)-discodermolida y determinaron la estereoquímica absoluta del producto natural. El equipo de Schreiber reconoció tres fragmentos de complejidad aproximadamente igual que están separados por unidades olefínicas en la discodermolida. Los dos materiales de partida, alcoholes homoalílicos, se derivan fácilmente del 3-hidroxi-2-metilpropionato.
El (Z)-alqueno trisustituido del primer fragmento se generó utilizando el reactivo de Still-Gennari. Luego se utilizó el reactivo de Gilbert para homologarlo a un acetileno . Luego se utilizó el método de Goekjian y Kishi para obtener el fragmento deseado, yodoacetileno. El mismo alcohol homoalílico se convirtió en diol en cuatro pasos. Después de la oxidación a cetoaldehído , se homololó a dienos mediante un acoplamiento catalizado por paladio con bromuro de vinilcinc para generar el segundo fragmento. La subunidad del anillo de seis miembros se transformó a partir de un acetal, que se obtuvo mediante una adición intramolecular 1,4 de un presunto intermediario hemiacetal .

El equipo de Schreiber descubrió que el NiCl2 y el CrCl2 promovían la adición de yoduro de alquinilo al aldehído de manera efectiva. La reacción proporciona una mezcla 2:1 del producto deseado y su isómero . Sin embargo, el isómero no deseado se puede reciclar al epímero deseado en tres pasos, incluida la oxidación de Swern y la reducción asimétrica de Corey. El Pd catalizó la hidrogenación parcial del alquino para establecer la configuración Z en C(8)–C(9). Luego, el grupo pivaloiloxi se convirtió en un bromuro para el acoplamiento final. Una alquilación estereoselectiva del enolato entre el bromuro alílico con el enolato de litio derivado del segundo fragmento proporcionó una mezcla 3:1 de isómeros y completó el ensamblaje de la cadena principal de (-)-discodermolida. Durante la conversión final, la reducción de la cetona con NaBH4 proporcionó una mezcla separable de isómeros 2,5:1. La síntesis de (-)-discodermolida realizada por Schreiber tiene un rendimiento total del 3,2% con una secuencia lineal más larga de 24 pasos y 36 pasos en total. En 1996, el grupo de Schreiber publicó la síntesis total de discodermolida natural con una estrategia sintética similar (rendimiento total del 4,3%, 36 pasos, secuencia lineal más larga de 24 pasos).

En 1995, Smith y sus colaboradores [15] informaron sobre la segunda síntesis total de (-)-discodermolida. Smith adaptó la estrategia triplemente convergente de la síntesis de Schreiber. En la estrategia de Smith, los tres fragmentos compartían un precursor común, que era el producto de una conversión de cinco pasos a escala de 50 g altamente eficiente a partir de 3-hidroxi-2-metilpropionato con un rendimiento del 59%. Se utilizó una reacción aldólica de Evans-Syn para obtener el resultado estereoquímico deseado.
La síntesis del fragmento A, yoduro de alquilo, se realizó mediante el método de oxazolidinona acílica de Evans . Después de la protección del hidroxilo y la eliminación reductora del auxiliar quiral , se realizó una yodación para obtener el fragmento A. La preparación del fragmento B comenzó con la protección de TBS y la reducción con DIBAL . El aldehído resultante se puede convertir en el haluro de vinilo trisustituido en Z deseado con una selectividad de 6:1. La característica clave de la síntesis del fragmento C fue la adición del anión derivado del ditiano al éter bencílico glicidílico .
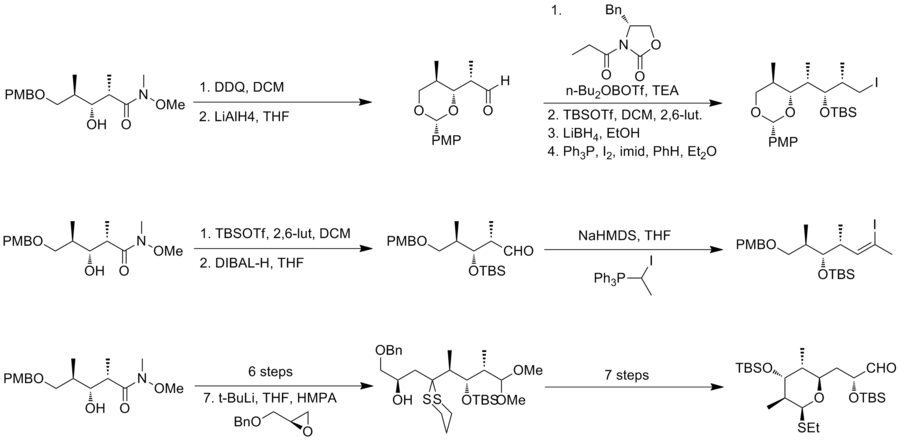
El acoplamiento cruzado mediado por paladio(0) del yoduro de vinilo con el derivado de organocinc del yoduro de alquilo proporciona un producto con un rendimiento del 66 %. Después de una conversión en dos pasos a la sal de fosfonio correspondiente , la unión de Wittig de la sal de fosfonio con el aldehído, fragmento C, se realizó con un rendimiento del 76 % y una buena selectividad. La última característica de esta síntesis fue la instalación mediada por titanio del dieno . La síntesis de Smith de (-)-discodermolida tiene un rendimiento general del 2,0 % con una secuencia lineal más larga de 29 pasos y 42 pasos en total.

En 1997, Myles y sus colaboradores [16] describieron la síntesis total de (-)-discodermolida utilizando alquilación controlada por quelación como acoplamiento clave. La reacción de hetero-Diels-Alder mediada por titanio del aldehído con el dieno de Danishefsky produjo con éxito la desafiante olefina C(13)–C(14) trisustituida en Z en el fragmento de yoduro alílico. La estereogenicidad en la subunidad C(16)–C(21) se indujo empleando la química aldólica de Evans. La estereogenicidad del fragmento final se estableció mediante una alilación asimétrica promovida por estaño . En particular, el estado de oxidación correcto en C(1) de este fragmento reduciría el número de pasos después del acoplamiento de fragmentos. La síntesis de Myles de (-)-discodermolida tiene un rendimiento general del 1,5% con una secuencia lineal más larga de 25 pasos y 44 pasos en total.
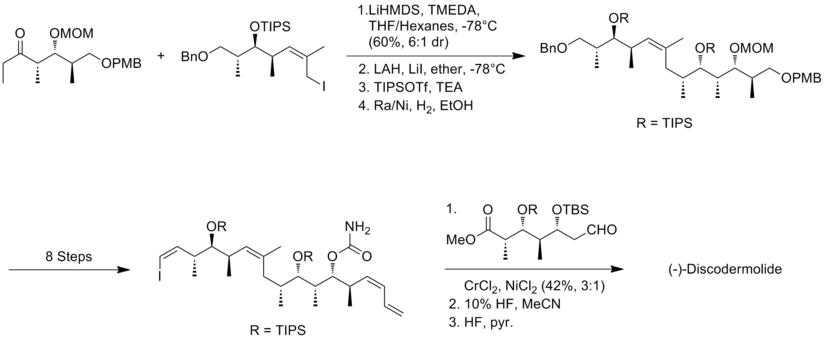
Marshall y sus colaboradores [17] utilizaron su táctica asimétrica de alenilmetal-homoaldol para construir estructuras de polipropionato de (+)-discodermolida. La novedad del enfoque de Marshall es que las tres subunidades de estereotriada se ensamblan mediante la adición de reactivos de alenilmetal no racémicos a (S)-3-sililoxi-2-metilpropanal para generar aductos syn/syn y syn/anti. La característica central para la síntesis del fragmento de yoduro de alquilo fue el tratamiento del aldehído a aleniltributilestannano en presencia de BF3 -eterato para obtener el isómero syn/syn. Las estereotriadas de metil-hidroxi-metilo syn/anti se obtuvieron mediante la reacción entre el aldehído y el reactivo de alenilzinc homoquiral.

En la síntesis Marshall, el acoplamiento entre el fragmento de alquino y el fragmento de aldehído se realizó con un rendimiento del 92%, con una diastereoselectividad de 85:15 . La condensación del aldehído con yodoetilideno trifenilfosforano fue el paso más desafiante, que produjo un rendimiento del 40% y una mezcla inseparable de 85:15 de los isómeros (Z) y (E). El último acoplamiento se realizó mediante una unión Suzuki de yoduro de vinilo con el boronato derivado del yoduro de alquilo. La síntesis Marshall de (+)-discodermolida tiene un rendimiento general del 1,3% con una secuencia lineal más larga de 30 pasos y 48 pasos en total.
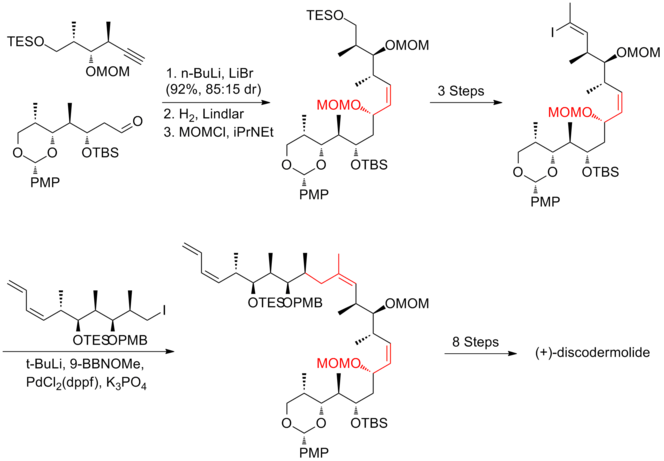
Evans y sus colaboradores [18] han desarrollado una estrategia que se basa en gran medida en la metodología aldólica asimétrica para la producción de la cadena principal de polipropionato. Utilizaron una reacción de condensación de Claisen para construir la Z-olefina trisustituida C(13)–C(14). La síntesis de Evans de (+)-discodermolida tiene un rendimiento general del 6,4% con una secuencia lineal más larga de 31 pasos y 49 pasos en total.
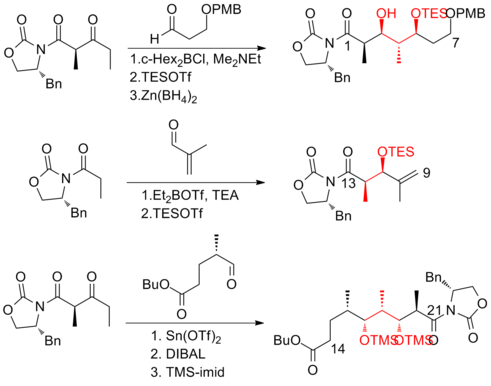

En 1999, Smith y sus colaboradores [19] informaron sobre la primera síntesis a escala de gramos de (+)-discodermolida, lo que hizo posible el desarrollo de (+)-discodermolida como un posible agente quimioterapéutico . Esta ruta sintética fue licenciada a Novartis Pharmaceuticals . Una de las principales mejoras fue que no se requirió purificación en los primeros cuatro pasos de la secuencia de cinco pasos hacia el precursor común, ya que el intermedio, el aducto aldólico, es un sólido cristalino . Se utilizó una reacción aldólica Mukaiyama controlada por quelación para establecer la estereogenicidad en C(5) del fragmento de lactona .
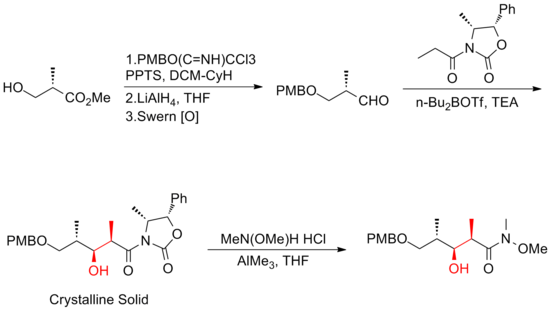
Dos años después, Smith y sus colaboradores publicaron una síntesis de tercera generación en la que el voluminoso grupo protector de éter TBS en C(11) del yoduro precursor fue reemplazado por un grupo menos estéricamente estorboso, MOM. Esta modificación favorece la formación de la sal de fosfonio deseada . La síntesis de tercera generación de Smith de (+)-discodermolida tiene un rendimiento general del 6,0% con una secuencia lineal más larga de 21 pasos y 35 pasos en total.

La característica clave del enfoque de cuarta generación [20] fue la utilización de un fragmento bidireccional, yoduro de vinilo/sal de fosfonio. La sal de fosfonio se podía obtener fácilmente ya que el yoduro de vinilo trisustituido es menos reactivo que el yoduro de alquilo . Una reacción de Wittig seguida de un acoplamiento de Suzuki con yoduro de alquilo proporcionó eficientemente la cadena principal de (+)-discodermolida. La síntesis de cuarta generación de Smith de (+)-discodermolida tiene un rendimiento general del 9,0% con una secuencia lineal más larga de 17 pasos y 36 pasos en total.
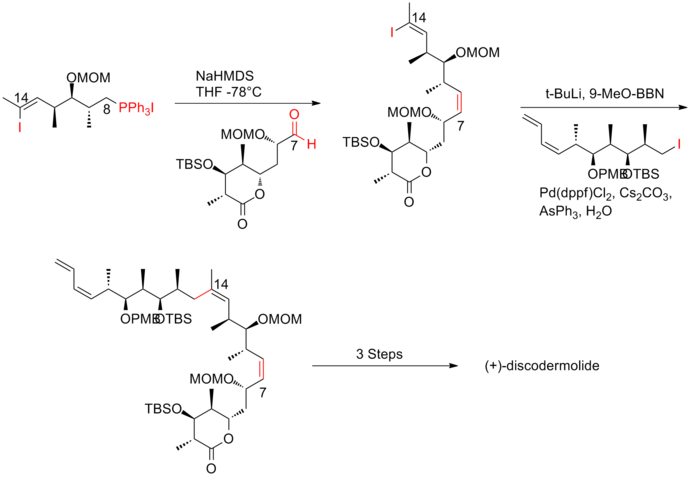
Paterson y sus colaboradores [21] de la Universidad de Cambridge han desarrollado una estrategia que utiliza nuevas reacciones aldólicas controladas por quelación y por reactivo con alta selectividad para las conexiones de subunidades. Otra característica de esta síntesis fue la inducción de olefina C(8)-C(9) con geometría cis mediante la reacción de Still-Gennari Horner-Wadsworth-Emmons . La síntesis de primera generación de Paterson de (+)-discodermolida tiene un rendimiento general del 10,3% con una secuencia lineal más larga de 23 pasos y 42 pasos en total.

En 2003, Paterson y colaboradores [22] informaron sobre una estrategia que depende en gran medida del estereocontrol derivado del sustrato. En lugar de una reacción aldólica controlada por reactivo en la síntesis de primera generación de Paterson, se utilizó un antialdólico mediado por diciclohexilboro para conectar C(5)-C(6), lo que conduce a un aumento significativo de la diastereoselectividad de 4:1 a 92:8. En particular, también se utilizó la reacción de Horner-Wadsworth-Emmons modificada por Still-Gennari para construir la olefina trisustituida C(13)-C(14) en la etapa temprana de esta síntesis. La síntesis de segunda generación de Paterson de (+)-discodermolida tiene un rendimiento general del 7,8% con una secuencia lineal más larga de 24 pasos y 35 pasos en total.
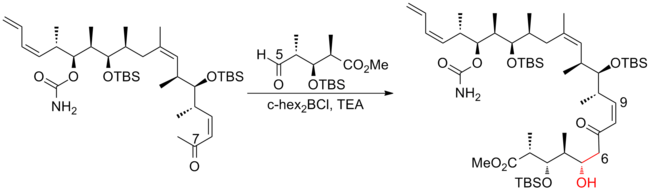
En 2004, Paterson y sus colaboradores [23] dieron a conocer la síntesis total de tercera generación de (+)-discodermolida. El método por pasos utilizado en generaciones anteriores para incorporar la subunidad C(1)–C(8) fue reemplazado por una olefinación de Still-Gennari en etapa tardía, que conduce a una mejora notable en la convergencia. La síntesis de tercera generación de Paterson de (+)-discodermolida tiene un rendimiento general del 11,1 % (el más alto informado hasta la fecha) con una secuencia lineal más larga de 21 pasos y 37 pasos en total.

A principios de 2004, Novartis Pharmaceuticals [24] ha revelado los detalles de una síntesis a escala de 60 g de (+)-discodermolida. Esta síntesis utilizó el enfoque de escala de gramos de Smith y el final de primera generación de Paterson. Esta síntesis permite evaluar la (+)-discodermolida como un agente quimioterapéutico in vivo para pacientes adultos que presentan neoplasias malignas sólidas avanzadas en ensayos clínicos de fase I. La síntesis de Novartis de (+)-discodermolida tiene un rendimiento general del 0,65% con una secuencia lineal más larga de 26 pasos y 33 pasos en total.
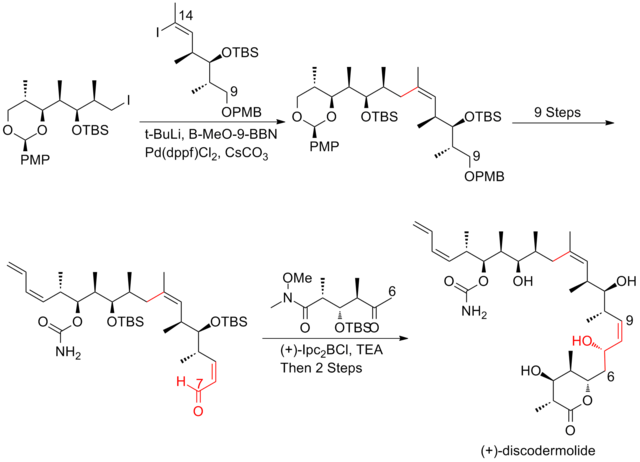
En 2004, Panek y sus colaboradores [25] informaron sobre un enfoque que aprovecha la metodología de construcción de enlaces CC basada en crotilsilano quiral para obtener la estereoquímica absoluta de las tres subunidades de (+)-discodermolida. Una de las características clave del enfoque de Paterson es la utilización de la metodología de acoplamiento cruzado de hidrocirconación para la construcción de (Z)-olefina C13-C14. La reacción aldólica de acetato con altos niveles de inducción 1,5-anti-estéreo y la reacción de acoplamiento cruzado sp2-sp3 mediada por paladio se utilizan para conectar las subunidades. La síntesis de Panek de (+)-discodermolida tiene un rendimiento general del 2,1% con una secuencia lineal más larga de 27 pasos y 42 pasos en total.
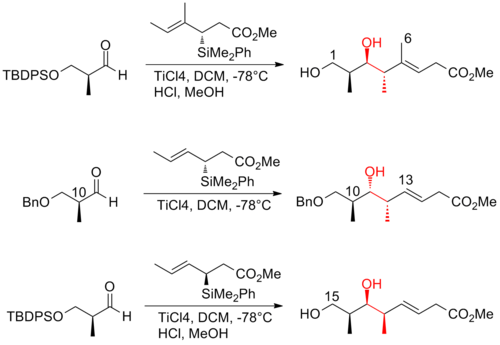
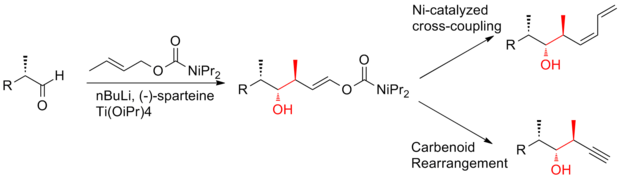
En 2008, Ardisson y sus colaboradores [26] informaron una estrategia que aplica una reacción de crotiltitanación repetidamente para producir alcoholes homoalílicos (Z)-O-eno-carbamato con excelente selectividad. Esta reacción de crotiltitanación no solo produce eficientemente las tríadas syn-anti metil-hidroxi-metil de (+)-discodermolida, sino que también produce productos que se pueden convertir fácilmente en (Z) -dieno terminal . La (Z)-olefina C13-C14 se instala a través de un reordenamiento diotrópico altamente selectivo. La síntesis de Ardisson de (+)-discodermolida tiene un rendimiento general de 1,6% con una secuencia lineal más larga de 21 pasos.
La Harbor Branch Oceanographic Institution otorgó la licencia de (+)-discodermolida a Novartis , que comenzó un ensayo clínico de fase 1 en 2004. El ensayo concluyó que el fármaco tenía una toxicidad mínima y representaba un mecanismo de acción novedoso. [27] El grupo de investigación de Amos B. Smith , en colaboración con Kosan Biosciences , tiene en marcha un programa de desarrollo de fármacos preclínicos. [28]