
La bomba biológica (o bomba biológica de carbono oceánico o bomba biológica de carbono marino ) es el secuestro de carbono impulsado biológicamente por el océano desde la atmósfera y la escorrentía terrestre hacia el interior del océano y los sedimentos del fondo marino . [1] En otras palabras, es un proceso mediado biológicamente que resulta en el secuestro de carbono en las profundidades del océano, lejos de la atmósfera y la tierra. La bomba biológica es el componente biológico de la "bomba de carbono marina" que contiene un componente físico y biológico. Es la parte del ciclo más amplio del carbono oceánico responsable del ciclo de la materia orgánica formada principalmente por el fitoplancton durante la fotosíntesis (bomba de tejidos blandos), así como del ciclo del carbonato de calcio (CaCO 3 ) formado en conchas por ciertos organismos como plancton y moluscos (bomba de carbonato). [2]
Los cálculos presupuestarios de la bomba biológica de carbono se basan en la relación entre sedimentación (exportación de carbono al fondo del océano) y remineralización (liberación de carbono a la atmósfera).
La bomba biológica no es tanto el resultado de un único proceso, sino más bien la suma de varios procesos, cada uno de los cuales puede influir en el bombeo biológico. En total, la bomba transfiere alrededor de 10,2 gigatoneladas de carbono cada año al interior del océano y un total de 1.300 gigatoneladas de carbono durante una media de 127 años. [3] Esto deja al carbono fuera de contacto con la atmósfera durante varios miles de años o más. Un océano sin una bomba biológica daría como resultado niveles de dióxido de carbono atmosférico aproximadamente 400 ppm más altos que los actuales.

El elemento carbono juega un papel central en el clima y la vida en la Tierra. Es capaz de moverse entre la geosfera , la criosfera , la atmósfera , la biosfera y la hidrosfera . Este flujo de carbono se conoce como ciclo del carbono de la Tierra . También está íntimamente ligado al ciclo de otros elementos y compuestos. El océano desempeña un papel fundamental en el ciclo del carbono de la Tierra, ayudando a regular la concentración de CO 2 atmosférico . La bomba biológica es un conjunto de procesos que transfieren carbono orgánico desde la superficie a las profundidades del océano y está en el corazón del ciclo del carbono oceánico . [5]
La bomba biológica depende de la fracción de materia orgánica producida primariamente que sobrevive a la degradación en la zona eufótica y que se exporta desde las aguas superficiales al interior del océano, donde se mineraliza en carbono inorgánico , con el resultado de que el carbono se transporta en contra del gradiente de Carbono inorgánico disuelto (DIC) desde la superficie hasta las profundidades del océano. Esta transferencia se produce mediante la mezcla física y el transporte de carbono orgánico disuelto y particulado (POC), migraciones verticales de organismos ( zooplancton , peces ) y mediante sedimentación gravitacional de carbono orgánico particulado. [6] [7] : 526 [8]
La bomba biológica se puede dividir en tres fases distintas, la primera de las cuales es la producción de carbono fijado por fotótrofos planctónicos en la región de la superficie eufótica (iluminada por el sol) del océano. En estas aguas superficiales, el fitoplancton utiliza dióxido de carbono (CO 2 ), nitrógeno (N), fósforo (P) y otros oligoelementos ( bario , hierro , zinc , etc.) durante la fotosíntesis para producir carbohidratos , lípidos y proteínas . Algunos plancton (por ejemplo, cocolitóforos y foraminíferos ) combinan calcio (Ca) y carbonatos disueltos ( ácido carbónico y bicarbonato ) para formar una capa protectora de carbonato de calcio (CaCO 3 ). [9]
Una vez que este carbono se fija en el tejido blando o duro, los organismos permanecen en la zona eufótica para ser reciclados como parte del ciclo regenerativo de nutrientes o, una vez que mueren, continúan a la segunda fase de la bomba biológica y comienzan a hundirse en el océano. piso. Las partículas que se hunden a menudo formarán agregados a medida que se hunden, lo que aumenta considerablemente la velocidad de hundimiento. Es esta agregación la que da a las partículas una mejor oportunidad de escapar de la depredación y descomposición en la columna de agua y, finalmente, llegar al fondo del mar. [9]
El carbono fijo que es descompuesto por las bacterias ya sea al descender o una vez en el fondo del mar ingresa a la fase final de la bomba y se remineraliza para usarse nuevamente en la producción primaria . Las partículas que escapan por completo a estos procesos quedan secuestradas en el sedimento y pueden permanecer allí durante millones de años. Es este carbono secuestrado el responsable de, en última instancia, reducir el CO 2 atmosférico . [9]

El diagrama inmediatamente superior ilustra los componentes de la bomba biológica. La biología, la física y la gravedad interactúan para bombear carbono orgánico a las profundidades del mar. Los procesos de fijación de carbono inorgánico en la materia orgánica durante la fotosíntesis, su transformación mediante procesos de la red trófica (trofodinámica), la mezcla física, el transporte y la sedimentación gravitacional se denominan colectivamente bomba biológica. [10]
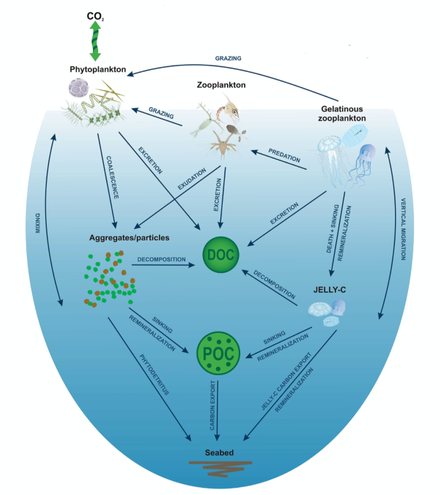
La bomba biológica es responsable de transformar el carbono inorgánico disuelto (DIC) en biomasa orgánica y bombearlo en forma particulada o disuelta a las profundidades del océano. Los nutrientes inorgánicos y el dióxido de carbono son fijados durante la fotosíntesis por el fitoplancton, que libera materia orgánica disuelta (DOM) y es consumido por el zooplancton herbívoro. El zooplancton más grande, como los copépodos , ingiere gránulos fecales que pueden reingerirse y hundirse o recolectarse con otros detritos orgánicos en agregados más grandes y que se hunden más rápidamente. DOM es parcialmente consumido por bacterias (puntos negros) y respirado; el DOM refractario restante se advecta y se mezcla en las profundidades del mar. Los DOM y los agregados exportados a las aguas profundas se consumen y respiran, devolviendo así el carbono orgánico a la enorme reserva oceánica profunda de DIC. Aproximadamente el 1% de las partículas que salen de la superficie del océano llegan al fondo marino y son consumidas, respiradas o enterradas en los sedimentos. Allí el carbono se almacena durante millones de años. El efecto neto de estos procesos es eliminar el carbono en forma orgánica de la superficie y devolverlo al DIC a mayores profundidades, manteniendo el gradiente del DIC desde la superficie hasta las profundidades del océano. La circulación termohalina devuelve el DIC de las profundidades del océano a la atmósfera en escalas de tiempo milenarias. [10]

El primer paso en la bomba biológica es la síntesis de compuestos de carbono orgánicos e inorgánicos por parte del fitoplancton en las capas superiores del océano, iluminadas por el sol. [13] Los compuestos orgánicos en forma de azúcares, carbohidratos, lípidos y proteínas se sintetizan durante el proceso de fotosíntesis :
CO 2 + H 2 O + luz → CH 2 O + O 2
Además de carbono, la materia orgánica que se encuentra en el fitoplancton está compuesta de nitrógeno, fósforo y diversos metales traza . La proporción de carbono a nitrógeno y fósforo varía de un lugar a otro, [14] pero tiene una proporción promedio cercana a 106C:16N:1P, conocida como proporción de Redfield . Los metales traza como magnesio, cadmio, hierro, calcio, bario y cobre son órdenes de magnitud menos frecuentes en el material orgánico del fitoplancton, pero son necesarios para ciertos procesos metabólicos y, por lo tanto, pueden ser nutrientes limitantes en la fotosíntesis debido a su menor abundancia en la columna de agua. [9]
La producción primaria oceánica representa aproximadamente la mitad de la fijación de carbono realizada en la Tierra. Aproximadamente entre 50 y 60 Pg de carbono son fijados por el fitoplancton marino cada año a pesar de que representan menos del 1% de la biomasa fotosintética total de la Tierra. La mayor parte de esta fijación de carbono (~80%) se lleva a cabo en mar abierto, mientras que la cantidad restante se produce en las muy productivas regiones de afloramiento del océano. A pesar de que estas regiones productivas producen de 2 a 3 veces más carbono fijo por área, el océano abierto representa más del 90% del área oceánica y, por lo tanto, es el mayor contribuyente. [9]

El fitoplancton sustenta toda la vida en el océano, ya que convierte compuestos inorgánicos en constituyentes orgánicos. Esta biomasa producida de forma autótrofa constituye la base de la red alimentaria marina. [15] En el diagrama inmediatamente debajo, las flechas indican los diversos procesos de producción (punta de flecha apuntando hacia el grupo de DOM) y eliminación de DOM (punta de flecha apuntando hacia afuera), mientras que las flechas discontinuas representan procesos biológicos dominantes involucrados en la transferencia de DOM. Debido a estos procesos, la fracción de DOM lábil disminuye rápidamente con la profundidad, mientras que el carácter refractario del depósito de DOM aumenta considerablemente durante su exportación a las profundidades del océano. DOM, materia orgánica disuelta. [15] [16]


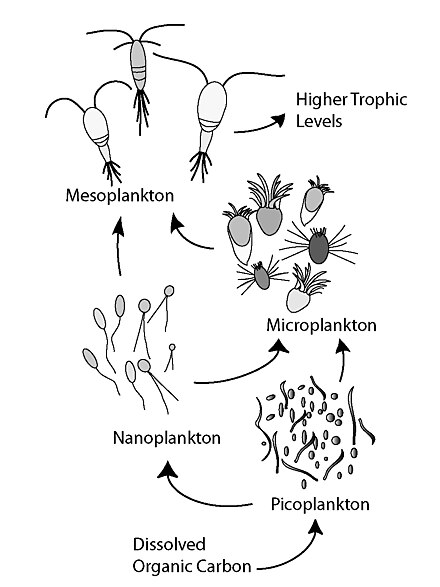
La bomba biológica marina depende de una serie de grupos, componentes y procesos clave que influyen en su funcionamiento. Hay cuatro reservorios principales de carbono en el océano. [5]

Las partículas de carbono inorgánico (PIC) suelen tomar la forma de carbonato de calcio (CaCO 3 ) y desempeñan un papel clave en el ciclo del carbono oceánico. [36] Este carbono fijado biológicamente se utiliza como capa protectora para muchas especies planctónicas (cocolitóforos, foraminíferos), así como para organismos marinos más grandes (conchas de moluscos). El carbonato de calcio también se excreta en altas tasas durante la osmorregulación por los peces y puede formarse en eventos de merlán . [37] Si bien esta forma de carbono no se toma directamente del balance atmosférico, se forma a partir de formas disueltas de carbonato que están en equilibrio con el CO 2 y luego son responsables de eliminar este carbono mediante secuestro. [38]
CO 2 + H 2 O → H 2 CO 3 → H + + HCO 3 −
Ca 2+ + 2HCO 3 − → CaCO 3 + CO 2 + H 2 O
Si bien este proceso logra fijar una gran cantidad de carbono, se secuestran dos unidades de alcalinidad por cada unidad de carbono secuestrada. [2] [39] La formación y hundimiento de CaCO 3 por lo tanto genera un gradiente de alcalinidad superficial a profundo que sirve para elevar el pH de las aguas superficiales, cambiando la especiación del carbono disuelto para elevar la presión parcial del CO 2 disuelto en las aguas superficiales. lo que en realidad eleva los niveles atmosféricos. Además, el entierro de CaCO 3 en los sedimentos sirve para reducir la alcalinidad oceánica general , tendiendo a elevar el pH y, por tanto, los niveles atmosféricos de CO 2 si no se contrarresta con el nuevo aporte de alcalinidad procedente de la erosión. [1] La porción de carbono que está permanentemente enterrada en el fondo del mar pasa a formar parte del registro geológico. El carbonato de calcio a menudo forma depósitos notables que luego pueden elevarse a la tierra mediante movimientos tectónicos, como en el caso de los Acantilados Blancos de Dover en el sur de Inglaterra. Estos acantilados están formados casi en su totalidad por placas de cocolitóforos enterrados . [40]

Tres procesos (o bombas) principales que componen el ciclo del carbono marino llevan el dióxido de carbono (CO 2 ) atmosférico al interior del océano y lo distribuyen a través de los océanos. Estas tres bombas son: (1) la bomba de solubilidad, (2) la bomba de carbonato y (3) la bomba biológica. La reserva total activa de carbono en la superficie de la Tierra durante períodos de menos de 10.000 años es de aproximadamente 40.000 gigatoneladas de C (Gt C, una gigatonelada equivale a mil millones de toneladas, o el peso de aproximadamente 6 millones de ballenas azules ), y alrededor del 95% (~ 38.000 Gt C) se almacenan en el océano, principalmente como carbono inorgánico disuelto . [41] [42] La especiación del carbono inorgánico disuelto en el ciclo del carbono marino es un controlador principal de la química ácido-base en los océanos.

La bomba biológica va acompañada de una contraparte físico-química conocida como bomba de solubilidad . Esta bomba transporta importantes cantidades de carbono en forma de carbono inorgánico disuelto (DIC) desde la superficie del océano hasta su interior. Implica únicamente procesos físicos y químicos, y no implica procesos biológicos. [43]
La bomba de solubilidad es impulsada por la coincidencia de dos procesos en el océano:
Dado que las aguas profundas (es decir, el agua de mar en el interior del océano) se forman bajo las mismas condiciones superficiales que promueven la solubilidad del dióxido de carbono, contienen una mayor concentración de carbono inorgánico disuelto de lo que podría esperarse de las concentraciones superficiales promedio. En consecuencia, estos dos procesos actúan juntos para bombear carbono desde la atmósfera al interior del océano. Una consecuencia de esto es que cuando el agua profunda surge en latitudes ecuatoriales más cálidas, libera fuertemente dióxido de carbono a la atmósfera debido a la solubilidad reducida del gas. [44]
A la bomba de carbonato a veces se la denomina componente de “tejido duro” de la bomba biológica. [45] Algunos organismos marinos de superficie, como los cocolitóforos , producen estructuras duras a partir de carbonato de calcio, una forma de partículas de carbono inorgánico, fijando bicarbonato. [46] Esta fijación de DIC es una parte importante del ciclo del carbono oceánico.
Ca 2+ + 2 HCO 3 − → CaCO 3 + CO 2 + H 2 O
Mientras que la bomba de carbono biológico fija carbono inorgánico (CO 2 ) en partículas de carbono orgánico en forma de azúcar (C 6 H 12 O 6 ), la bomba de carbonato fija bicarbonato inorgánico y provoca una liberación neta de CO 2 . [46] De esta manera, la bomba de carbonato podría denominarse contrabomba de carbonato. Funciona en contra de la bomba biológica, contrarrestando el flujo de CO 2 hacia la bomba biológica. [47]
Se propone que la bomba de plataforma continental opere en las aguas poco profundas de las plataformas continentales como un mecanismo que transporta carbono (disuelto o en partículas) desde las aguas continentales al interior del océano profundo adyacente. [48] Tal como se formuló originalmente, se cree que la bomba ocurre donde la bomba de solubilidad interactúa con agua más fría y, por lo tanto, más densa del fondo de la plataforma que alimenta el talud continental hacia el océano profundo vecino. [48] La poca profundidad de la plataforma continental restringe la convección del agua de enfriamiento, por lo que el enfriamiento puede ser mayor para las aguas de la plataforma continental que para las aguas vecinas del océano abierto. Estas aguas más frías promueven la bomba de solubilidad y conducen a un mayor almacenamiento de carbono inorgánico disuelto . Este almacenamiento adicional de carbono se ve aumentado aún más por la mayor producción biológica característica de los estantes. [49] Las aguas densas y ricas en carbono de la plataforma luego se hunden hasta el suelo de la plataforma y entran en la capa subsuperficial del océano abierto a través de una mezcla isopicnal . [48] A medida que el nivel del mar aumenta en respuesta al calentamiento global, la superficie de los mares de la plataforma crecerá y, en consecuencia, la fuerza de la bomba marina de la plataforma debería aumentar. [50]

En el diagrama de la derecha, el fitoplancton convierte el CO 2 , que se ha disuelto de la atmósfera en la superficie de los océanos (90 Gt año −1 ), en carbono orgánico particulado (POC) durante la producción primaria (~ 50 Gt C año −1 ). Luego, el fitoplancton es consumido por los copépodos , el krill y otros pequeños herbívoros del zooplancton, que a su vez son presa de los niveles tróficos superiores . Cualquier fitoplancton no consumido forma agregados y, junto con los gránulos fecales de zooplancton, se hunde rápidamente y se exporta fuera de la capa mezclada (< 12 Gt C año −1 14). El krill, los copépodos, el zooplancton y los microbios interceptan el fitoplancton en la superficie del océano y hunden las partículas detríticas en las profundidades, consumiendo y respirando este POC para convertirlo en CO 2 ( carbono inorgánico disuelto , DIC), de modo que sólo una pequeña proporción del carbono producido en la superficie se hunde en la superficie. océano profundo (es decir, profundidades > 1000 m). A medida que el krill y el zooplancton más pequeño se alimentan, también fragmentan físicamente las partículas en trozos pequeños, que se hunden más lentamente o que no se hunden (mediante alimentación descuidada, coprorrexia si se fragmentan las heces), [52] retardando la exportación de POC. Esto libera carbono orgánico disuelto (DOC), ya sea directamente de las células o indirectamente mediante solubilización bacteriana (círculo amarillo alrededor del DOC). Luego, las bacterias pueden remineralizar el DOC a DIC (CO 2 , jardinería microbiana). [51]
La bomba biológica de carbono es uno de los principales determinantes de la distribución vertical del carbono en los océanos y, por tanto, de la presión parcial superficial de CO 2 que rige el intercambio de CO 2 aire-mar . [53] Comprende células de fitoplancton, sus consumidores y las bacterias que asimilan sus desechos y desempeña un papel central en el ciclo global del carbono al transportar carbono desde la atmósfera a las profundidades del mar, donde se concentra y secuestra durante siglos. [54] La fotosíntesis realizada por el fitoplancton reduce la presión parcial de CO 2 en la parte superior del océano, facilitando así la absorción de CO 2 de la atmósfera al generar un gradiente de CO 2 más pronunciado . [55] También da como resultado la formación de partículas de carbono orgánico (POC) en la capa eufótica de la zona epipelágica (0 a 200 m de profundidad). El POC es procesado por los microbios, el zooplancton y sus consumidores en gránulos fecales, agregados orgánicos (“nieve marina”) y otras formas, que luego se exportan a las zonas mesopelágicas (200-1000 m de profundidad) y batipelágicas mediante hundimiento y migración vertical por zooplancton y peces. [56] Aunque la producción primaria incluye carbono orgánico disuelto y particulado (DOC y POC respectivamente), solo el POC conduce a una exportación eficiente de carbono al interior del océano, mientras que la fracción de DOC en las aguas superficiales es reciclada en su mayor parte por bacterias. [57] Sin embargo, una fracción de DOC biológicamente más resistente producida en la zona eufótica (que representa entre el 15% y el 20% de la productividad neta de la comunidad) no es mineralizada inmediatamente por los microbios y se acumula en la superficie del océano como DOC biológicamente semilábil . [58] Este DOC semilábil se exporta netamente a las profundidades del océano, constituyendo así una parte dinámica de la bomba biológica de carbono. [59] La eficiencia de la producción y exportación de DOC varía según las regiones oceanográficas, siendo más prominente en los océanos subtropicales oligotróficos . [60] La eficiencia general de la bomba de carbono biológico está controlada principalmente por la exportación de POC. [57] [61]

La mayor parte del carbono incorporado en la materia biológica orgánica e inorgánica se forma en la superficie del mar, donde luego puede comenzar a hundirse hasta el fondo del océano. Las profundidades del océano obtienen la mayoría de sus nutrientes de la columna de agua más alta cuando se hunden en forma de nieve marina. Está formado por animales y microbios muertos o moribundos, materia fecal, arena y otros materiales inorgánicos. [63] Una sola célula de fitoplancton tiene una tasa de hundimiento de alrededor de un metro por día. Dado que la profundidad media del océano es de unos cuatro kilómetros, estas células pueden tardar más de diez años en llegar al fondo del océano. Sin embargo, a través de procesos como la coagulación y la expulsión en las heces de los depredadores, estas células forman agregados. Estos agregados, conocidos como nieve marina , tienen tasas de hundimiento órdenes de magnitud mayores que las células individuales y completan su viaje hacia las profundidades en cuestión de días. [9]
En el diagrama de la derecha, el fitoplancton fija CO 2 en la zona eufótica utilizando energía solar y produce partículas de carbono orgánico (POC). El POC formado en la zona eufótica es procesado por los microbios, el zooplancton y sus consumidores en agregados orgánicos (nieve marina), que luego se exporta a las zonas mesopelágicas (200-1000 m de profundidad) y batipelágicas mediante hundimiento y migración vertical por parte del zooplancton y los peces. El flujo de exportación se define como la sedimentación fuera de la capa superficial (aproximadamente a 100 m de profundidad) y el flujo de secuestro es la sedimentación fuera de la zona mesopelágica (aproximadamente a 1000 m de profundidad). Una parte del POC es respirado de nuevo a CO 2 en la columna de agua oceánica en profundidad, principalmente por microbios heterótrofos y zooplancton, manteniendo así un gradiente vertical en la concentración de carbono inorgánico disuelto (DIC). Este DIC de las profundidades del océano regresa a la atmósfera en escalas de tiempo milenarias a través de la circulación termohalina . Entre el 1% y el 40% de la producción primaria se exporta fuera de la zona eufótica, que se atenúa exponencialmente hacia la base de la zona mesopelágica y sólo alrededor del 1% de la producción superficial llega al fondo marino. [61] [64] [56]
De los 50 a 60 Pg de carbono fijados anualmente, aproximadamente el 10% abandona la capa superficial mixta de los océanos, mientras que menos del 0,5% llega finalmente al fondo del mar. [9] La mayor parte se retiene en la producción regenerada en la zona eufótica y una porción significativa se remineraliza en procesos a media agua durante el hundimiento de las partículas. La porción de carbono que sale de la capa mixta superficial del océano a veces se considera "secuestrada" y esencialmente alejada del contacto con la atmósfera durante muchos siglos. [64] Sin embargo, el trabajo también encuentra que, en regiones como el Océano Austral , gran parte de este carbono puede volver rápidamente (en décadas) a entrar en contacto con la atmósfera. [sesenta y cinco]
Los cálculos presupuestarios de la bomba biológica de carbono se basan en la relación entre sedimentación (exportación de carbono) y remineralización (liberación a la atmósfera). [62] Se ha estimado que las partículas que se hunden exportan hasta el 25% del carbono capturado por el fitoplancton en la superficie del océano a capas de agua más profundas. [66] Alrededor del 20% de esta exportación (5% de los valores superficiales) está enterrada en los sedimentos oceánicos [67] principalmente debido a su lastre mineral. [68] Durante el proceso de hundimiento, estas partículas orgánicas son puntos críticos de actividad microbiana y representan lugares importantes para la mineralización de la materia orgánica y la redistribución de nutrientes en la columna de agua. [69] [70] [62]
Las observaciones han demostrado que los flujos de minerales de lastre (carbonato de calcio, ópalo y material litogénico) y los flujos de carbono orgánico están estrechamente correlacionados en las zonas batipelágicas del océano. [68] Una gran fracción de materia orgánica particulada se presenta en forma de agregados de nieve marina (>0,5 mm) compuestos de fitoplancton, detritos, granos minerales inorgánicos y bolitas fecales en el océano. [71] La formación y el hundimiento de estos agregados impulsan la bomba biológica de carbono a través de la exportación y sedimentación de materia orgánica desde la capa mixta superficial hasta las profundidades del océano y los sedimentos. La fracción de materia orgánica que abandona la capa mixta superior del océano está determinada, entre otros factores, por la velocidad de hundimiento y la tasa de remineralización microbiana de estos agregados. Observaciones recientes han demostrado que los flujos de minerales de lastre (carbonato de calcio, ópalo y material litogénico) y los flujos de carbono orgánico están estrechamente correlacionados en las zonas batipelágicas del océano. Esto ha llevado a la hipótesis de que la exportación de carbono orgánico está determinada por la presencia de minerales de lastre dentro de los agregados sedimentados. [72] [73] [74] [68]
El lastre mineral está asociado con aproximadamente el 60% del flujo de partículas de carbono orgánico (POC) en las altas latitudes del Atlántico Norte, y con aproximadamente el 40% del flujo en el Océano Austral. [75] También existen fuertes correlaciones en las profundidades del océano entre la presencia de minerales de lastre y el flujo de POC. Esto sugiere que los minerales de lastre mejoran el flujo de POC al aumentar la tasa de hundimiento de los agregados lastrados. Los minerales de lastre también podrían proporcionar a la materia orgánica agregada cierta protección contra la degradación. [76]
Se ha propuesto que el carbono orgánico se conserva mejor en las partículas que se hunden debido al aumento de la densidad del agregado y la velocidad de hundimiento cuando hay minerales de lastre presentes y/o mediante la protección de la materia orgánica debido a la asociación cuantitativa con los minerales de lastre. [72] [73] [74] En 2002, Klaas y Archer observaron que alrededor del 83% de los flujos globales de carbono orgánico particulado (POC) estaban asociados con carbonato , y sugirieron que el carbonato era un mineral de lastre más eficiente en comparación con el ópalo y el terrígeno. material. Plantearon la hipótesis de que la mayor densidad del carbonato de calcio en comparación con la del ópalo y la mayor abundancia de carbonato de calcio en relación con el material terrígeno podrían ser la razón del lastre eficiente del carbonato de calcio. Sin embargo, los efectos directos de los minerales de lastre sobre la velocidad de hundimiento y las tasas de degradación de los agregados que se hunden aún no están claros. [74] [68]
Un estudio de 2008 demostró que los gránulos fecales de copépodos producidos con una dieta de diatomeas o cocolitofóridos muestran velocidades de hundimiento más altas en comparación con los gránulos producidos con una dieta de nanoflagelados. [77] Sin embargo, las tasas de respiración específicas del carbono en los pellets eran similares e independientes del contenido mineral. Estos resultados sugieren que las diferencias en la composición mineral no conducen a una protección diferencial del POC contra la degradación microbiana, pero las velocidades de hundimiento mejoradas pueden resultar en una preservación de carbono hasta 10 veces mayor en gránulos que contienen minerales biogénicos en comparación con los gránulos sin minerales biogénicos . 77] [68]
Los minerales parecen mejorar la floculación de los agregados de fitoplancton [78] [79] e incluso pueden actuar como catalizadores en la formación de agregados. [80] Sin embargo, también se ha demostrado que la incorporación de minerales puede hacer que los agregados se fragmenten en agregados más pequeños y densos. [81] Esto puede reducir potencialmente la velocidad de hundimiento del material orgánico agregado debido a la reducción del tamaño de los agregados y, por lo tanto, reducir la exportación total de materia orgánica. Por el contrario, si la incorporación de minerales aumenta la densidad agregada, su velocidad de hundimiento específica del tamaño también puede aumentar, lo que potencialmente podría aumentar la exportación de carbono. Por lo tanto, todavía es necesario realizar mejores investigaciones cuantitativas sobre cómo las interacciones entre minerales y agregados orgánicos afectan la degradación y la velocidad de hundimiento de los agregados y, por lo tanto, el secuestro de carbono en el océano. [81] [68]
La remineralización se refiere a la descomposición o transformación de la materia orgánica (aquellas moléculas derivadas de una fuente biológica) en sus formas inorgánicas más simples . Estas transformaciones forman un vínculo crucial dentro de los ecosistemas , ya que son responsables de liberar la energía almacenada en las moléculas orgánicas y reciclar la materia dentro del sistema para que otros organismos la reutilicen como nutrientes . [7] La fracción que escapa a la remineralización varía según la ubicación. Por ejemplo, en el Mar del Norte, los valores de deposición de carbono son ~1% de la producción primaria [82] , mientras que ese valor es <0,5% en los océanos abiertos en promedio. [83] Por lo tanto, la mayoría de los nutrientes permanecen en la columna de agua, reciclados por la biota . Los organismos heterótrofos utilizarán los materiales producidos por los organismos autótrofos (y quimiotróficos ) y, mediante la respiración, remineralizarán los compuestos de su forma orgánica a inorgánicos, poniéndolos nuevamente a disposición de los productores primarios.
Para la mayoría de las áreas del océano, las tasas más altas de remineralización de carbono se producen a profundidades entre 100 y 1200 m (330 a 3940 pies) en la columna de agua, disminuyendo hasta aproximadamente 1200 m (3900 pies), donde las tasas de remineralización permanecen bastante constantes en 0,1. μmol kg −1 año −1 . [84] Esto proporciona la mayor cantidad de nutrientes disponibles para los productores primarios dentro de la zona fótica, aunque deja las aguas superficiales superiores privadas de nutrientes inorgánicos. [85] La mayor parte de la remineralización se realiza con carbono orgánico disuelto (DOC). Los estudios han demostrado que son las partículas más grandes que se hunden las que transportan la materia hasta el fondo del mar [86] , mientras que las partículas suspendidas y la materia orgánica disuelta se consumen principalmente mediante la remineralización. [87] Esto sucede en parte debido al hecho de que los organismos generalmente deben ingerir nutrientes más pequeños que ellos, a menudo en órdenes de magnitud. [88] Dado que la comunidad microbiana constituye el 90% de la biomasa marina, [89] se trata de partículas más pequeñas que los microbios (del orden de 10−6 ) que se recogerá para la remineralización. [90]
El fitoplancton marino realiza la mitad de toda la fotosíntesis en la Tierra [91] e influye directamente en los ciclos biogeoquímicos globales y el clima, pero se desconoce cómo responderá al cambio global futuro. El dióxido de carbono es uno de los principales impulsores del cambio global y ha sido identificado como uno de los principales desafíos del siglo XXI. [92] El dióxido de carbono (CO 2 ) generado durante actividades antropogénicas como la deforestación y la quema de combustibles fósiles para generar energía se disuelve rápidamente en la superficie del océano y reduce el pH del agua de mar, mientras que el CO 2 que queda en la atmósfera aumenta las temperaturas globales y conduce a un aumento de los océanos. estratificación térmica . Si bien se estima que la concentración de CO 2 en la atmósfera era de unas 270 ppm antes de la revolución industrial, actualmente ha aumentado a unas 400 ppm [93] y se espera que alcance entre 800 y 1.000 ppm a finales de este siglo, según el "business "como siempre" escenario de emisiones de CO 2 . [94] [61]
Los ecosistemas marinos son un importante sumidero de CO 2 atmosférico y absorben una cantidad similar de CO 2 que los ecosistemas terrestres, y actualmente representan la eliminación de casi un tercio de las emisiones antropogénicas de CO 2 de la atmósfera. [93] [94] La transferencia neta de CO 2 de la atmósfera a los océanos y luego a los sedimentos es principalmente una consecuencia directa del efecto combinado de la solubilidad y la bomba biológica. [95] Mientras que la bomba de solubilidad sirve para concentrar carbono inorgánico disuelto (CO 2 más iones de bicarbonato y carbonato) en los océanos profundos, la bomba de carbono biológica (un proceso natural clave y un componente importante del ciclo global del carbono que regula el CO 2 atmosférico niveles) transfiere carbono orgánico e inorgánico fijado por los productores primarios (fitoplancton) en la zona eufótica al interior del océano y posteriormente a los sedimentos subyacentes. [95] [54] Por lo tanto, la bomba biológica saca el carbono del contacto con la atmósfera durante varios miles de años o más y mantiene el CO 2 atmosférico en niveles significativamente más bajos de lo que sería el caso si no existiera. [96] Un océano sin una bomba biológica, que transfiere aproximadamente 11 Gt C año −1 al interior del océano, daría como resultado niveles atmosféricos de CO 2 ~400 ppm más altos que los actuales. [97] [98] [61]
Passow y Carlson definieron la sedimentación fuera de la capa superficial (aproximadamente a 100 m de profundidad) como el "flujo de exportación" y la de la zona mesopelágica (aproximadamente a 1000 m de profundidad) como el "flujo de secuestro". [64] Una vez que el carbono se transporta por debajo de la zona mesopelágica, permanece en las profundidades del mar durante 100 años o más, de ahí el término flujo de “secuestro”. Según los resultados de modelización de Buesseler y Boyd entre el 1% y el 40% de la producción primaria se exporta fuera de la zona eufótica, [99] la cual se atenúa exponencialmente hacia la base de la zona mesopelágica y sólo alrededor del 1% de la producción superficial alcanza el fondo del mar. [100] La eficiencia de las exportaciones de carbono orgánico particulado (POC) muestra una variabilidad regional. Por ejemplo, en el Atlántico Norte, más del 40% de la producción primaria neta se exporta fuera de la zona eufótica, en comparación con sólo el 10% en el Pacífico Sur, [99] y esto se debe en parte a la composición de la comunidad de fitoplancton, que incluye tamaño y composición de las células (ver más abajo). El carbono orgánico exportado se remineraliza, es decir, se convierte en CO 2 en la columna de agua oceánica en profundidad, principalmente por microbios heterótrofos y zooplancton. Así, la bomba biológica de carbono mantiene un gradiente vertical en la concentración de carbono inorgánico disuelto (DIC), con valores más altos a mayor profundidad del océano. [101] Este DIC de las profundidades del océano regresa a la atmósfera en escalas de tiempo milenarias a través de la circulación termohalina . [10] [61]
En 2001, Hugh et al. expresó la eficiencia de la bomba biológica como la cantidad de carbono exportado desde la capa superficial (producción de exportación) dividida por la cantidad total producida por la fotosíntesis (producción general). [10] Los estudios de modelado realizados por Buesseler y Boyd revelaron que la eficiencia general de transferencia de la bomba biológica está determinada por una combinación de factores: estacionalidad; [99] la composición de las especies de fitoplancton; la fragmentación de partículas por el zooplancton; y la solubilización de partículas por microbios. Además, la eficiencia de la bomba biológica también depende de la agregación y desagregación de agregados ricos en materia orgánica y de la interacción entre los agregados de POC y los minerales de "lastre" suspendidos. [102] Los minerales de lastre (biominerales de silicato y carbonato y polvo) son los principales constituyentes de las partículas que abandonan la superficie del océano por hundimiento. Por lo general, son más densos que el agua de mar y la mayoría de la materia orgánica, por lo que proporcionan una gran parte del diferencial de densidad necesario para el hundimiento de las partículas. [72] La agregación de partículas aumenta el flujo vertical al transformar pequeñas partículas suspendidas en otras más grandes que se hunden rápidamente. Desempeña un papel importante en la sedimentación de fitodetritos de las floraciones de fitoplancton de la capa superficial. [56] Como ilustró Turner en 2015, el flujo vertical de partículas que se hunden se debe principalmente a una combinación de gránulos fecales, nieve marina y sedimentación directa de floraciones de fitoplancton, que generalmente se componen de diatomeas, cocolitofóridos, dinoflagelados y otros plancton. [56] La nieve marina comprende agregados orgánicos macroscópicos de >500 µm de tamaño y se origina a partir de grupos de fitoplancton agregado (fitodetritos), casas apendiculares desechadas, materia fecal y otras partículas detríticas diversas. [56] Los apendiculares secretan estructuras mucosas de alimentación o “casas” para Recoge las partículas de comida y deséchalas y renuevalas hasta 40 veces al día. [103] Las casas apendiculares desechadas son muy abundantes (miles por m3 en aguas superficiales) y son puntos críticos microbianos con altas concentraciones de bacterias, ciliados, flagelados y fitoplancton. Por lo tanto, estas casas abandonadas se encuentran entre las fuentes más importantes de agregados producidos directamente por el zooplancton en términos de potencial de ciclo del carbono. [104] [61]

La composición de la comunidad de fitoplancton en la zona eufótica determina en gran medida la cantidad y calidad de la materia orgánica que se hunde en las profundidades. [100] Los principales grupos funcionales del fitoplancton marino que contribuyen a la producción de exportación incluyen fijadores de nitrógeno ( cianobacterias diazotróficas ), silicificantes (diatomeas) y calcificadores (cocolitóforos). Cada uno de estos grupos de fitoplancton difiere en el tamaño y la composición de sus paredes y cubiertas celulares, lo que influye en sus velocidades de hundimiento. [105] Por ejemplo, se cree que el picoplancton autótrofo (0,2–2 µm de diámetro), que incluye taxones como cianobacterias (p. ej., Proclorococcus spp. y Synechococcus spp.) y prasinófitos (varios géneros de eucariotas <2 µm), contribuye mucho menos a la exportación de carbono desde las capas superficiales debido a su pequeño tamaño, velocidades de hundimiento lentas (<0,5 m/día) y rápida renovación en el circuito microbiano. [105] [106] Por el contrario, las células de fitoplancton más grandes, como las diatomeas (de 2 a 500 µm de diámetro), son muy eficientes en el transporte de carbono a las profundidades mediante la formación de agregados que se hunden rápidamente. [64] Son únicos entre el fitoplancton, porque requieren Si en forma de ácido silícico (Si(OH)4) para el crecimiento y la producción de sus frústulas, que están hechas de sílice biogénica (bSiO2) y actúan como lastre. [105] [107] Según los informes de Miklasz y Denny, [108] las velocidades de hundimiento de las diatomeas pueden oscilar entre 0,4 y 35 m/día. [105] [107] [108] De manera análoga, los cocolitóforos están cubiertos con placas de carbonato de calcio llamadas 'cocolitos', que son fundamentales para la agregación y el lastre, produciendo velocidades de hundimiento de casi 5 m/día. [64] [105] Aunque se ha asumido que el picofitoplancton , que caracteriza vastas áreas oligotróficas del océano, [100] no contribuye sustancialmente al flujo de partículas de carbono orgánico (POC), en 2007 Richardson y Jackson sugirieron que todo el fitoplancton, incluido Las células de picoplancton contribuyen igualmente a la exportación de POC. [106] Propusieron vías alternativas para el ciclo del carbono del picoplancton, que se basan en la agregación como mecanismo tanto para el hundimiento directo (la exportación de picoplancton como POC) como para el hundimiento de la producción basada en picoplancton mediado por mesozooplancton o grandes filtradores. [61]

Además de vincular a los productores primarios con niveles tróficos más altos en las redes alimentarias marinas, el zooplancton también desempeña un papel importante como “reciclador” de carbono y otros nutrientes que impactan significativamente los ciclos biogeoquímicos marinos, incluida la bomba biológica. Este es particularmente el caso de los copépodos y el krill , y es especialmente importante en aguas oligotróficas de mar abierto. A través de una alimentación descuidada, excreción, egestión y lixiviación de gránulos fecales, el zooplancton libera materia orgánica disuelta (DOM) que controla el ciclo de DOM y apoya el circuito microbiano. La eficiencia de la absorción, la respiración y el tamaño de las presas complican aún más la forma en que el zooplancton puede transformar y transportar carbono a las profundidades del océano. [111]
La excreción y la alimentación descuidada (la descomposición física de la fuente de alimento) representan el 80% y el 20% de la liberación de DOM mediada por el zooplancton de los crustáceos, respectivamente. [113] En el mismo estudio, se descubrió que la lixiviación de pellets fecales contribuía de manera insignificante. Para los protozoos herbívoros, la DOM se libera principalmente mediante excreción y egestión, y el zooplancton gelatinoso también puede liberar DOM mediante la producción de moco. La lixiviación de los gránulos fecales puede extenderse desde horas hasta días después de la egestión inicial y sus efectos pueden variar dependiendo de la concentración y calidad del alimento. [114] [115] Varios factores pueden afectar la cantidad de DOM que se libera de los individuos o poblaciones de zooplancton.
Los gránulos fecales de zooplancton pueden ser vehículos importantes para la transferencia de partículas de carbono orgánico (POC) a las profundidades del océano, contribuyendo a menudo en gran medida al secuestro de carbono. La distribución de tamaño de la comunidad de copépodos indica que en el epipelágico se produce una gran cantidad de pequeños gránulos fecales . Sin embargo, los pequeños gránulos fecales son raros en las capas más profundas, lo que sugiere que no se transfieren eficientemente a las profundidades. Esto significa que los pequeños gránulos fecales solo hacen contribuciones menores a los flujos de gránulos fecales en el meso y batipelágico, particularmente en términos de carbono. En un estudio centrado en el Mar de Escocia , que contiene algunas de las regiones más productivas del Océano Austral, las bolitas fecales dominantes en el mesopelágico superior eran cilíndricas y elípticas, mientras que las bolitas fecales ovoides eran dominantes en el batipelágico . El cambio en la morfología de los gránulos fecales, así como la distribución del tamaño, apunta al reempaquetado de los gránulos fecales superficiales en el mesopelágico y a la producción in situ en el meso y batipelágico inferior, que puede aumentarse con entradas de gránulos fecales a través de migraciones verticales de zooplancton . Esto sugiere que el flujo de carbono a las capas más profundas dentro del Océano Austral está fuertemente modulado por el zooplancton meso y batipelágico, lo que significa que la estructura comunitaria en estas zonas tiene un impacto importante en la eficiencia de la transferencia de pellets fecales a las profundidades del océano. [112]
La eficiencia de absorción (AE) es la proporción de alimentos absorbidos por el plancton que determina qué tan disponibles están los materiales orgánicos consumidos para satisfacer las demandas fisiológicas requeridas. [111] Dependiendo de la tasa de alimentación y la composición de las presas, las variaciones en los EA pueden provocar variaciones en la producción de gránulos fecales y, por lo tanto, regulan la cantidad de material orgánico que se recicla de nuevo al medio marino. Las tasas de alimentación bajas generalmente conducen a AE altos y gránulos pequeños y densos, mientras que las tasas de alimentación altas generalmente conducen a AE bajos y gránulos más grandes con más contenido orgánico. Otro factor que contribuye a la liberación de DOM es la frecuencia respiratoria. Los factores físicos como la disponibilidad de oxígeno, el pH y las condiciones de luz pueden afectar el consumo general de oxígeno y la cantidad de carbono que se pierde del zooplancton en forma de CO 2 respirado . Los tamaños relativos del zooplancton y las presas también influyen en la cantidad de carbono que se libera mediante una alimentación descuidada. Las presas más pequeñas se ingieren enteras, mientras que las presas más grandes pueden alimentarse de manera más “descuidada”, es decir, se libera más biomateria a través de un consumo ineficiente. [116] [117] También hay evidencia de que la composición de la dieta puede afectar la liberación de nutrientes, ya que las dietas carnívoras liberan más carbono orgánico disuelto (DOC) y amonio que las dietas omnívoras. [114]
El circuito microbiano describe una vía trófica en la red alimentaria microbiana marina donde el carbono orgánico disuelto (DOC) regresa a niveles tróficos más altos mediante su incorporación a la biomasa bacteriana y luego se acopla con la cadena alimentaria clásica formada por fitoplancton - zooplancton - necton . El término bucle microbiano fue acuñado por Farooq Azam , Tom Fenchel et al. [118] en 1983 para incluir el papel desempeñado por las bacterias en los ciclos del carbono y los nutrientes del medio marino. En general, el carbono orgánico disuelto se introduce en el medio oceánico a través de la lisis bacteriana, la fuga o exudación de carbono fijo del fitoplancton (p. ej., exopolímero mucilaginoso de las diatomeas ), la senescencia celular repentina, la alimentación descuidada del zooplancton, la excreción de productos de desecho por organismos acuáticos. animales, o la descomposición o disolución de partículas orgánicas de plantas y suelos terrestres. [119] Las bacterias en el circuito microbiano descomponen estas partículas de detritus para utilizar esta materia rica en energía para el crecimiento. Dado que más del 95% de la materia orgánica en los ecosistemas marinos consiste en compuestos poliméricos de alto peso molecular (APM) (p. ej., proteínas, polisacáridos, lípidos), sólo una pequeña porción de la materia orgánica disuelta total (DOM) es fácilmente utilizable para la mayoría de los ecosistemas marinos. organismos en niveles tróficos superiores. Esto significa que el carbono orgánico disuelto no está disponible directamente para la mayoría de los organismos marinos; Las bacterias marinas introducen este carbono orgánico en la red alimentaria, lo que hace que haya energía adicional disponible para niveles tróficos más altos. [120]
Hasta el 25% de la producción primaria de fitoplancton en los océanos globales puede reciclarse dentro del circuito microbiano mediante derivación viral . [121] La derivación viral es un mecanismo mediante el cual los virus marinos evitan que la materia orgánica particulada microbiana (POM) migre a niveles tróficos reciclándolas en materia orgánica disuelta (DOM), que puede ser absorbida fácilmente por los microorganismos. La DOM reciclada por la vía de derivación viral es comparable a la cantidad generada por las otras fuentes principales de DOM marina. [122] Los virus pueden infectar fácilmente microorganismos en el circuito microbiano debido a su relativa abundancia en comparación con los microbios. [123] [124] La mortalidad de procarióticos y eucariotas contribuye al reciclaje de nutrientes de carbono a través de la lisis celular . También hay evidencia de regeneración de nitrógeno (específicamente amonio). Este reciclaje de nutrientes ayuda a estimular el crecimiento microbiano. [125]
Las caídas de gelatina son eventos del ciclo del carbono marino mediante los cuales el zooplancton gelatinoso , principalmente cnidarios , se hunde hasta el fondo marino y mejora los flujos de carbono y nitrógeno a través de materia orgánica particulada que se hunde rápidamente . [127] Estos eventos proporcionan nutrición a la megafauna y bacterias bentónicas . [128] [129] Las caídas de gelatina han sido implicadas como una importante “vía gelatinosa” para el secuestro de carbono biogénico lábil a través de la bomba biológica. [130] Estos eventos son comunes en áreas protegidas con altos niveles de producción primaria y calidad del agua adecuada para sustentar especies de cnidarios. Estas áreas incluyen estuarios y se han realizado varios estudios en fiordos de Noruega . [129]


Las ballenas y otros mamíferos marinos también mejoran la productividad primaria en sus áreas de alimentación al concentrar nitrógeno cerca de la superficie mediante la liberación de penachos fecales floculantes . [132] [133] Por ejemplo, las ballenas y las focas pueden ser responsables de reponer más nitrógeno en la zona eufótica del Golfo de Maine que el aporte de todos los ríos combinados. Esta bomba ascendente de ballenas jugó un papel mucho más importante antes de que la pesca industrial devastara las poblaciones de mamíferos marinos, cuando el reciclaje de nitrógeno probablemente era más de tres veces el aporte de nitrógeno atmosférico. [132]
La bomba biológica media en la eliminación de carbono y nitrógeno de la zona eufótica a través del flujo descendente de agregados, heces y la migración vertical de invertebrados y peces. [134] Los copépodos y otros zooplancton producen gránulos fecales que se hunden y contribuyen al transporte descendente de materia orgánica disuelta y particulada al respirar y excretar en profundidad durante los ciclos de migración, desempeñando así un papel importante en la exportación de nutrientes (N, P y Fe). de aguas superficiales. [135] [136] [132]
El zooplancton se alimenta en la zona eufótica y exporta nutrientes a través de gránulos fecales que se hunden y migración vertical. Los peces suelen liberar nutrientes a la misma profundidad a la que se alimentan. Se espera que la excreción de los mamíferos marinos, atados a la superficie para respirar, sea menos profunda en la columna de agua que donde se alimentan. [132]
Los mamíferos marinos proporcionan importantes servicios ecosistémicos. A escala global, pueden influir en el clima, a través de eventos de fertilización y la exportación de carbono desde las aguas superficiales a las profundidades del mar a través de cadáveres de ballenas que se hunden. [137] En las zonas costeras, las ballenas retienen nutrientes localmente, aumentando la productividad del ecosistema y quizás aumentando la capacidad de carga para otros consumidores marinos, incluidas las especies de peces comerciales. [132] Se ha estimado que, en términos de secuestro de carbono, una ballena equivale a miles de árboles. [138]
El krill, las salpas, el zooplancton más pequeño y los peces que migran verticalmente pueden transportar activamente carbono a las profundidades consumiendo POC en la capa superficial durante la noche y metabolizándolo en sus profundidades de residencia mesopelágicas durante el día. Dependiendo de la historia de vida de la especie, el transporte activo también puede ocurrir estacionalmente. [51]
Sin migración vertical, la bomba biológica no sería tan eficiente. Los organismos migran hacia arriba para alimentarse durante la noche, por lo que cuando regresan a las profundidades durante el día defecan grandes bolitas fecales que se hunden. Si bien algunos gránulos fecales más grandes pueden hundirse bastante rápido, la velocidad a la que los organismos regresan a las profundidades es aún más rápida. Por la noche, los organismos se encuentran en los 100 metros superiores de la columna de agua, pero durante el día descienden hasta entre 800 y 1000 metros. Si los organismos defecaran en la superficie, las bolitas fecales tardarían días en alcanzar la profundidad que alcanzan en cuestión de horas. Por lo tanto, al liberar bolitas fecales en profundidad tienen casi 1000 metros menos que recorrer para llegar a las profundidades del océano. Esto es algo que se conoce como transporte activo . Los organismos están desempeñando un papel más activo en el movimiento de la materia orgánica hacia las profundidades. Debido a que una gran mayoría de los microbios marinos, especialmente los microbios marinos, dependen de la caída de nutrientes, cuanto más rápido puedan llegar al fondo del océano, mejor. [63]
El zooplancton y las salpas desempeñan un papel importante en el transporte activo de los gránulos fecales. Se estima que entre el 15% y el 50% de la biomasa del zooplancton migra, lo que representa el transporte del 5% al 45% de las partículas de nitrógeno orgánico a las profundidades. [63] Las salpas son grandes plancton gelatinosos que pueden migrar verticalmente 800 metros y comer grandes cantidades de alimentos en la superficie. Tienen un tiempo de retención intestinal muy largo, por lo que los gránulos fecales generalmente se liberan a máxima profundidad. Las salpas también son conocidas por tener algunos de los gránulos fecales más grandes. Debido a esto, tienen una velocidad de hundimiento muy rápida y se sabe que pequeñas partículas de detritos se agregan sobre ellos. Esto hace que se hundan mucho más rápido. Entonces, si bien todavía se están realizando muchas investigaciones sobre por qué los organismos migran verticalmente, está claro que la migración vertical juega un papel importante en el transporte activo de materia orgánica disuelta a las profundidades. [139]
La bomba de lípidos secuestra carbono de la superficie del océano a aguas más profundas a través de lípidos asociados con el zooplancton migratorio vertical que pasa el invierno . Los lípidos son una clase de compuestos ricos en hidrocarburos , deficientes en nitrógeno y fósforo , esenciales para las estructuras celulares. El carbono asociado a los lípidos ingresa a las profundidades del océano como dióxido de carbono producido por la respiración de las reservas de lípidos y como materia orgánica procedente de la mortalidad del zooplancton. En comparación con la bomba biológica más general, la bomba de lípidos también produce una derivación de lípidos, donde otros nutrientes como el nitrógeno y el fósforo que se consumen en exceso deben excretarse de regreso al ambiente superficial y, por lo tanto, no se eliminan de la capa mixta superficial de el océano. [140] Esto significa que el carbono transportado por la bomba de lípidos no limita la disponibilidad de nutrientes esenciales en la superficie del océano. Por lo tanto, el secuestro de carbono a través de la bomba de lípidos se desacopla de la eliminación de nutrientes, lo que permite que continúe la absorción de carbono por parte de la producción primaria oceánica. En la Bomba Biológica, la eliminación de nutrientes siempre va acompañada del secuestro de carbono; la producción primaria es limitada ya que el carbono y los nutrientes se transportan juntos a las profundidades en forma de materia orgánica. [140] La contribución de la bomba de lípidos al secuestro de carbono en las aguas más profundas del océano puede ser sustancial: el carbono transportado por debajo de los 1.000 metros (3.300 pies) por copépodos del género Calanus en el Océano Ártico casi iguala al transportado por debajo la misma profundidad anualmente por partículas de carbono orgánico (POC) en esta región. [141] Una fracción significativa de este carbono transportado no regresaría a la superficie debido a la respiración y la mortalidad. Se están realizando investigaciones para estimar con mayor precisión la cantidad que queda en profundidad. [140] [141] [142] La tasa de exportación de la bomba de lípidos puede variar de 1 a 9,3 g C m −2 y −1 en regiones templadas y subpolares que contienen zooplancton que migra estacionalmente. [142] El papel del zooplancton, y particularmente de los copépodos, en la red alimentaria es crucial para la supervivencia de organismos de nivel trófico superior cuya principal fuente de nutrición son los copépodos. Con el calentamiento de los océanos y el creciente derretimiento de los casquetes polares debido al cambio climático, los organismos asociados con la bomba de lípidos pueden verse afectados, influyendo así en la supervivencia de muchos peces de importancia comercial y mamíferos marinos en peligro de extinción . [143] [144] [145] Como componente nuevo y previamente no cuantificado del secuestro de carbono oceánico, una mayor investigación sobre la bomba de lípidos puede mejorar la precisión y la comprensión general de los flujos de carbono en los sistemas oceánicos globales . [140] [141] [142]

Las bacterias luminosas en simbiosis de órganos luminosos son adquiridas sucesivamente por el huésped (calamares, peces) del agua de mar mientras son juveniles y luego liberadas regularmente en el océano. [146]
En el diagrama de la derecha, dependiendo de la posición del órgano luminoso, las bacterias luminosas se liberan desde sus intestinos en bolitas fecales o directamente en el agua de mar (paso 1). Las bacterias luminosas móviles colonizan la materia orgánica que se hunde a lo largo de la columna de agua . Las bacterias bioluminiscentes que colonizan los gránulos y partículas fecales influyen en las tasas de consumo de zooplancton. Estos marcadores visuales aumentan la detección (“hipótesis del cebo”), la atracción y, finalmente, la depredación por parte de los niveles tróficos superiores (paso 2). En el mesopelágico , el zooplancton y sus depredadores se alimentan de partículas luminosas y gránulos fecales que se hunden, que forman agregados (reempaquetado) de tasas de hundimiento más rápidas o fragmentan la materia orgánica (debido a una alimentación descuidada) con tasas de hundimiento más lentas (paso 3). [146]
Los filtradores también agregan materia orgánica que se hunde sin una detección visual particular ni selección de materia luminosa. Los migradores verticales diarios (y estacionales) que se alimentan de alimentos luminosos metabolizan y liberan bolitas fecales brillantes desde la superficie a la zona mesopelágica (paso 4). Esto implica la dispersión de bacterias bioluminiscentes a grandes escalas espaciales, para el zooplancton o incluso para algunos peces que nadan activamente largas distancias. Las bacterias luminosas adheridas a las partículas se hunden hasta el fondo marino, y las condiciones físicas oceanográficas pueden resuspender los sedimentos (paso 5) y consumirlos los organismos epibentónicos. Los instrumentos son (a) red de plancton, (b) red de pesca, (c) muestreador de agua Niskin , (d) batifotómetro, (e) trampas de sedimentos , (f) vehículos submarinos autónomos , (g) módulo fotomultiplicador , (h) astrofísica óptica. módulos ANTARES y (i–j) vehículos operados remotamente . [146]

El componente geológico del ciclo del carbono opera lentamente en comparación con las otras partes del ciclo global del carbono. Es uno de los determinantes más importantes de la cantidad de carbono en la atmósfera y, por tanto, de las temperaturas globales. [148]
Dado que la bomba biológica desempeña un papel importante en el ciclo del carbono de la Tierra, se dedica un esfuerzo significativo a cuantificar su fuerza. Sin embargo, debido a que ocurren como resultado de interacciones ecológicas mal restringidas, generalmente en profundidad, los procesos que forman la bomba biológica son difíciles de medir. Un método común es estimar la producción primaria alimentada por nitrato y amonio , ya que estos nutrientes tienen diferentes fuentes que están relacionadas con la remineralización del material que se hunde. De estos es posible derivar el llamado índice f , un indicador de la fuerza local de la bomba biológica. La aplicación de los resultados de los estudios locales a escala global resulta complicada por el papel que desempeña la circulación del océano en las diferentes regiones oceánicas. [149]

Los cambios en el uso del suelo, la combustión de combustibles fósiles y la producción de cemento han provocado un aumento de la concentración de CO 2 en la atmósfera. En la actualidad, alrededor de un tercio (aproximadamente 2 Pg C y −1 = 2 × 10 15 gramos de carbono por año) [150] [151] [ ¿ fuente poco confiable? ] de las emisiones antropogénicas de CO 2 pueden estar entrando al océano, pero esto es bastante incierto. [152] Algunas investigaciones sugieren que existe un vínculo entre el CO 2 elevado y la producción primaria marina. [153]


El cambio climático puede afectar la bomba biológica en el futuro al calentar y estratificar la superficie del océano. Se cree que esto podría disminuir el suministro de nutrientes a la zona eufótica, reduciendo allí la producción primaria. Además, los cambios en el éxito ecológico de los organismos calcificantes causados por la acidificación de los océanos pueden afectar la bomba biológica al alterar la fuerza de la bomba de los tejidos duros. [156] Esto puede tener un efecto "en cadena" en la bomba de tejidos blandos porque el carbonato de calcio actúa como lastre del material orgánico que se hunde. [157]
El segundo diagrama de la derecha muestra algunos posibles efectos de la disminución del hielo marino y el deshielo del permafrost en los flujos de carbono del Ártico. En la tierra, las plantas absorben carbono mientras que los microorganismos del suelo producen metano y respiran CO 2 . Los lagos son emisores netos de metano, y el carbono orgánico e inorgánico (disuelto y en partículas) fluye hacia el océano a través de sistemas de agua dulce. En el océano, el metano se puede liberar al derretirse el permafrost submarino y el CO 2 se absorbe debido a una subsaturación del CO 2 en el agua en comparación con la atmósfera. Además, múltiples flujos están estrechamente asociados al hielo marino. Las mejores estimaciones actuales de los flujos atmosféricos se dan en Tg C año −1 , cuando estén disponibles. Tenga en cuenta que la estimación de emisiones para los lagos es para el área al norte de ~50º N en lugar de la definición más estrecha de tundra ártica para los otros flujos terrestres. Cuando están disponibles, los rangos de incertidumbre se muestran entre paréntesis. Las flechas no representan el tamaño de cada flujo. [155] [154]
Se cree que la bomba biológica desempeñó un papel importante en las fluctuaciones atmosféricas de CO 2 durante los pasados períodos glaciales e interglaciales. Sin embargo, aún no está claro cómo responderá la bomba biológica al futuro cambio climático. [56] Para que tales predicciones sean razonables, es importante descifrar primero la respuesta del fitoplancton, uno de los componentes clave de la bomba biológica a cambios futuros en el CO 2 atmosférico . Debido a su diversidad filogenética, es probable que diferentes taxones de fitoplancton respondan al cambio climático de diferentes maneras. [105] Por ejemplo, se espera una disminución en la abundancia de diatomeas debido al aumento de la estratificación en el futuro océano. [158] Las diatomeas son muy eficientes en el transporte de carbono a las profundidades al formar agregados grandes que se hunden rápidamente y su número reducido podría a su vez conducir a una disminución de la exportación de carbono. [64]
Además, la disminución del pH del océano debido a la acidificación del océano puede frustrar la capacidad de los cocolitóforos de generar placas calcáreas, lo que podría afectar la bomba biológica; [105] sin embargo, parece que algunas especies son más sensibles que otras. [159] Por lo tanto, los cambios futuros en la abundancia relativa de estos u otros taxones de fitoplancton podrían tener un impacto marcado en la productividad total de los océanos, afectando posteriormente la biogeoquímica de los océanos y el almacenamiento de carbono.
Un estudio de 2015 determinó que las concentraciones de cocolitóforos en el Atlántico norte han aumentado en un orden de magnitud desde la década de 1960 y se modeló que un aumento en el CO2 absorbido , así como la temperatura, eran la causa más probable de este aumento. [160]
En un estudio de 2017, los científicos utilizaron modelos de distribución de especies (SDM) para predecir la futura distribución global de dos especies de fitoplancton importantes para la bomba biológica: la diatomea Chaetoceros diadema y el cocolitóforo Emiliania huxleyi . [161] Emplearon datos ambientales descritos en el escenario 8.5 de Rutas de Concentración Representativas del IPCC , que predice el forzamiento radiativo en el año 2100 en relación con los valores preindustriales. Los resultados de sus modelos predijeron que el área total del océano cubierta por C. diadema y E. huxleyi disminuiría en un 8% y un 16%, respectivamente, en el escenario climático examinado. Predijeron que los cambios en el rango y distribución de estas dos especies de fitoplancton en estas condiciones oceánicas futuras, si se realizan, podrían resultar en una contribución reducida al secuestro de carbono a través de la bomba biológica. [61] En 2019, un estudio indicó que, con las tasas actuales de acidificación del agua de mar, podríamos ver fitoplancton antártico más pequeños y menos eficaces para almacenar carbono antes de finales de siglo. [162]

Monitorear la bomba biológica es fundamental para comprender cómo está cambiando el ciclo del carbono de la Tierra. Se utilizan diversas técnicas para monitorear la bomba biológica, que puede desplegarse desde diversas plataformas, como barcos, vehículos autónomos y satélites. En la actualidad, la teledetección por satélite es la única herramienta disponible para observar toda la superficie del océano a altas escalas temporales y espaciales. [5]
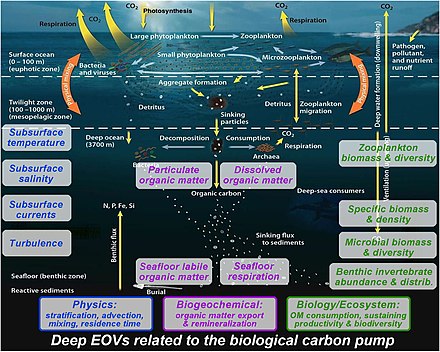
Todavía se necesitan observaciones multidisciplinarias en la columna de agua profunda para comprender adecuadamente la bomba biológica: [165]
El valor de NEP [Producción Neta del Ecosistema] depende de los límites definidos para el ecosistema.
Si uno considera la superficie del océano iluminada por el sol hasta el nivel de luz del 1% (la "zona eufótica") en el transcurso de un año entero, entonces NEP es equivalente a las
partículas de carbono orgánico
que se hunden en el interior oscuro del océano más el
carbono orgánico disuelto
que se circuló fuera de la zona eufótica.
En este caso, a la NEP también se la suele denominar "producción de exportación" (o "nueva producción" (Dugdale y Goering, 1967), como se analiza más adelante).
{{cite book}}: CS1 maint: location missing publisher (link){{cite book}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: numeric names: authors list (link){{cite journal}}: Citar diario requiere |journal=( ayuda ) {{cite web}}: CS1 maint: multiple names: authors list (link){{cite book}}: |journal=ignorado ( ayuda )CS1 maint: multiple names: authors list (link)