La lisoclina es la profundidad del océano que depende de la profundidad de compensación de carbonatos (CCD), normalmente de unos 5 km, por debajo de la cual la velocidad de disolución de la calcita aumenta drásticamente debido al efecto de la presión. Mientras que la lisoclina es el límite superior de esta zona de transición de saturación de calcita, el CCD es el límite inferior de esta zona. [1]
El contenido de CaCO 3 en los sedimentos varía según las diferentes profundidades del océano, abarcando niveles de separación conocidos como zona de transición. En la zona media del océano, los sedimentos son ricos en CaCO 3 , cuyo contenido alcanza entre el 85 y el 95 %. [1] Esta área luego se extiende cientos de metros por la zona de transición, que termina en las profundidades abisales con una concentración del 0%. La lisoclina es el límite superior de la zona de transición, donde las cantidades de contenido de CaCO 3 comienzan a disminuir notablemente desde el sedimento de 85-95% de profundidad media. El contenido de CaCO 3 cae a una concentración del 0% en el límite inferior, conocido como profundidad de compensación de calcita. [1]
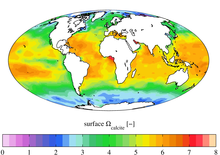
Las aguas marinas poco profundas generalmente están sobresaturadas de calcita, CaCO 3 , porque a medida que los organismos marinos (que a menudo tienen conchas hechas de calcita o su polimorfo, aragonito ) mueren, tienden a caer hacia abajo sin disolverse. [2] A medida que aumentan la profundidad y la presión dentro de la columna de agua , aumenta la solubilidad de la calcita, lo que provoca agua sobresaturada por encima de la profundidad de saturación, lo que permite la preservación y el entierro de CaCO 3 en el fondo marino. [3] Sin embargo, esto crea agua de mar subsaturada por debajo de la profundidad de saturación, evitando que el CaCO 3 se entierre en el fondo del mar a medida que las conchas comienzan a disolverse.
La ecuación Ω = [Ca 2+ ] X [CO 3 2- ]/K' sp expresa el estado de saturación de CaCO 3 del agua de mar. [4] El horizonte de saturación de calcita es donde Ω =1; la disolución avanza lentamente por debajo de esta profundidad. Nuevamente es destacable la lisoclina es la profundidad a la que impacta esta disolución, también conocida como punto de inflexión con el CaCO 3 sedimentario frente a varias profundidades del agua. [4]
La profundidad de compensación de calcita (CCD) ocurre a la profundidad en la que la tasa de calcita a los sedimentos se equilibra con el flujo de disolución, la profundidad a la que el contenido de CaCO 3 tiene valores del 2 al 10%. [4] Por lo tanto, la lisoclina y la CCD no son equivalentes. La lisoclina y la profundidad de compensación ocurren a mayores profundidades en el Atlántico (5000 a 6000 m) que en el Pacífico (4000 a 5000 m), y a mayores profundidades en las regiones ecuatoriales que en las regiones polares . [5]
La profundidad del CCD varía en función de la composición química del agua de mar y su temperatura. [6] Específicamente, son las aguas profundas las que están subsaturadas con carbonato de calcio principalmente porque su solubilidad aumenta fuertemente al aumentar la presión y la salinidad y al disminuir la temperatura. A medida que la concentración atmosférica de dióxido de carbono continúa aumentando, se puede esperar que el CCD disminuya en profundidad, a medida que aumenta la acidez del océano. [3]