Los inhibidores del receptor de difosfato de adenosina ( ADP ) son una clase de fármacos antiplaquetarios que se utilizan en el tratamiento del síndrome coronario agudo (SCA) o en el tratamiento preventivo de pacientes con riesgo de tromboembolia , infarto de miocardio o accidente cerebrovascular . Estos fármacos antagonizan los receptores plaquetarios P2Y 12 y, por lo tanto, impiden la unión del ADP al receptor P2Y 12. Esto conduce a una disminución de la agregación de plaquetas, lo que impide la formación de trombos. El receptor P2Y 12 es una proteína unida a la superficieque se encuentra en las plaquetas sanguíneas . Pertenecen a los receptores purinérgicos acoplados a proteína G (GPCR) y son quimiorreceptores del ADP. [1]
El primer fármaco de esta clase que se introdujo fue la ticlopidina , pero debido a sus efectos adversos, hoy en día no se utiliza mucho. La ticlopidina, el clopidogrel y el prasugrel (Efient) son tienopiridinas que provocan una inhibición irreversible del receptor P2Y 12. Todos ellos son profármacos que deben convertirse en un metabolito activo in vivo para inhibir el receptor P2Y 12. Por otro lado, fármacos nuevos como el ticagrelor (Brilinta®) y el cangrelor (Kengrexal®) no son tienopiridinas e inhiben de forma reversible el receptor P2Y 12, lo que significa que actúan directamente sobre el receptor sin necesidad de activación metabólica y muestran un inicio y un final de acción más rápidos. [1] [2] [3] [4]
Estos medicamentos se administran con frecuencia en combinación con aspirina (ácido acetilsalicílico) para mejorar la inhibición plaquetaria, especialmente en pacientes con SCA o sometidos a intervención coronaria percutánea (ICP). [5]
Antes de la aparición de los inhibidores de ADP, el único agente antiplaquetario disponible en el mercado para tratar eventos antitrombóticos era la aspirina. Sin embargo, debido a los eventos isquémicos recurrentes en pacientes de alto riesgo, existía una base para el desarrollo de fármacos antiplaquetarios dirigidos a otras vías de señalización importantes. [5] [6]
La historia de los inhibidores de ADP comenzó en el año 1972, cuando los investigadores buscaban fármacos similares al agente antiinflamatorio tinoridina, una tienopiridina con efectos antiinflamatorios y analgésicos que se había publicado dos años antes. [7] Basándose en el conocimiento de la química de la tienopiridina, se sintetizó un número significativo de derivados de tienopiridinas. Los derivados se probaron in vivo y ex vivo en ratones y ratas, pero los resultados de las pruebas no demostraron ningún efecto antiinflamatorio o analgésico en absoluto, sino que mostraron efectos antiplaquetarios y antitrombóticos inesperados. En ese momento era muy poco común buscar nuevos agentes antiplaquetarios, ya que la conexión entre la agregación plaquetaria, la trombosis y los incidentes cardiovasculares era discutida. Sin embargo, el derivado más activo, la ticlopidina, fue seleccionado para un mayor desarrollo. [7] La ticlopidina fue la tienopiridina de primera generación que mejoró la inhibición plaquetaria y, por lo tanto, se utilizó para tratar el síndrome coronario real y otras enfermedades cardiovasculares. Debido a los efectos adversos graves notificados de la ticlopidina, se desarrollaron las tienopiridinas de segunda y tercera categoría, clopidogrel y prasugrel. [5]
Cuando se comercializaron por primera vez la ticlopidina y el clopidogrel, la ticlodipina en 1978 y el clopidogrel en 1998, no se conocía por completo el mecanismo de acción de estos dos importantes fármacos antitrombóticos. Lo que se había demostrado era que eran potentes inhibidores de la agregación plaquetaria inducida por ADP, pero no se había identificado el receptor P2Y 12. Además, estaba claro que la ticlopidina y el clopidogrel eran profármacos, lo que significa que son inactivos in vitro y, por lo tanto, necesitan metabolismo para activarse in vivo. No fue hasta el año 2000 cuando se aislaron y caracterizaron los metabolitos activos de estos fármacos. Aproximadamente un año después se identificó el receptor plaquetario P2Y 12 para el ADP. Tras estos descubrimientos, se fueron identificando progresivamente los metabolitos activos y las enzimas responsables de su formación. Así, más de 30 años después del descubrimiento de la ticlopidina y más de 10 años después del descubrimiento del clopidogrel, se explicó el mecanismo de acción de estos dos fármacos. [7]
Los primeros inhibidores del P2Y 12 pertenecían a la familia de las tienopiridinas . Son antagonistas indirectos que bloquean la agregación y activación plaquetaria inducida por el ADP. El primer fármaco de esta clase fue la ticlopidina , que se descubrió en 1972 en Porcor (actualmente Sanofi ). Se descubrió durante la búsqueda de un nuevo fármaco antiinflamatorio basado en la tinoridina. Se evaluó con un enfoque de detección fenotípica , y se probó en modelos de roedores tanto in vivo como ex vivo . Mostró una alta actividad antiplaquetaria. [1]
La ticlopidina tenía buenas perspectivas y fue seleccionada para ensayos clínicos. [1] Se comercializó en Francia en 1978 y se globalizó en 1991 cuando llegó al mercado estadounidense [7] para la prevención primaria y secundaria del accidente cerebrovascular. [1]
La búsqueda de otro análogo de tienopiridina con una mejor relación actividad/ toxicidad en animales comenzó tan pronto como la ticlopidina entró en ensayos preclínicos . Se hizo más urgente encontrar un nuevo análogo después de los informes de pacientes que sufrieron trastornos hematológicos graves debido a la ticlopidina. [7]
El clopidogrel , una tienopiridina de segunda generación, comenzó a utilizarse en ensayos preclínicos en 1987 y llegó al mercado mundial en 1998. Su mecanismo de acción y el de su precursor, la ticlopidina, aún eran desconocidos. Lo único que se sabía era que eran profármacos ya que no mostraban actividad in vitro, que afectaban a las plaquetas de forma irreversible por su larga duración de acción y que el metabolito activo era química y biológicamente inestable. No fue hasta el año 2000 que se descubrió el metabolito activo y un año después se descubrió su diana plaquetaria, el receptor P2Y 12 del ADP. [7]
Aunque el clopidogrel tiene una mejor relación actividad/toxicidad que la ticlopidina, todavía hay problemas con su actividad, ya que el 30% de los pacientes tienen resistencia al clopidogrel. El principal factor de la resistencia al clopidogrel es el polimorfismo CYP2C19 , que se produce en el 30-55% de los pacientes. Esto provocó la pérdida de funciones de la enzima, lo que provocó una mala conversión del clopidogrel en su metabolito activo. [1] El metabolito en sí es muy inestable y, por lo tanto, no se puede almacenar como parte de una biblioteca química . [7] Esto llevó al desarrollo de un compuesto que depende menos del metabolismo mediado por CYP, el prasugrel. [1]
Prasugrel, tienopiridina de tercera generación, fue comercializado en 2009 por las compañías farmacéuticas Daiichi Sankyo/Eli Lilly. [1] Prasugrel, al igual que sus precursores, es un profármaco, pero su metabolismo comienza en los intestinos, donde es metabolizado por la esterasa en una tiolactona, este intermediario inactivo luego sufre una apertura del anillo mediada por CYP, principalmente por CYP3A4 y CYP2B6, para convertirse en el metabolito activo. Por lo tanto, prasugrel no está sujeto a resistencia al clopidogrel. [8] [1]
El objetivo era encontrar un inhibidor del receptor P2Y 12 que no fuera un metabolito y que tuviera un inicio de acción más rápido. Se sabía que el ATP antagoniza competitivamente la agregación plaquetaria inducida por ADP, pero el ATP es muy inestable. La atención se centró en crear análogos del ATP con mayor potencia y estabilidad. Estos análogos tenían una vida media muy corta debido a la retención de los grupos trifosfato y, por lo tanto, debían administrarse por vía intravenosa. La modificación de estos análogos condujo al descubrimiento del ticagrelor, un antagonista selectivo y estable del receptor P2Y 12 sin fosfato. [9] El ticagrelor pertenece a la clase de ciclopentil-triazolopirimidina (CPTP). [10] El ticagrelor llegó al mercado en 2010 en Europa, [11] y en 2011 en EE. UU. [12]
El cangrelor, otro análogo del ATP como el ticagrelor, es estable a la degradación enzimática. Tiene un inicio de acción rápido, ya que no se descompone en un metabolito activo como las tienopiridinas. [13] AstraZeneca obtuvo la licencia exclusiva para el cangrelor en diciembre de 2003. En 2009, el patrocinador del ensayo de fase 3 se retiró, en el que se estaba probando el cangrelor frente a un placebo. El desarrollo del cangrelor se detuvo durante un tiempo cuando el patrocinador se retiró después de que el comité de revisión de análisis provisional (IARC) decidiera que el ensayo no mostraría la eficacia clínica "persuasiva" necesaria para la aprobación regulatoria. [14] Sin embargo, el ensayo Champion Phoenix (patrocinado por la compañía biofarmacéutica The Medicines Company), un ensayo doble ciego controlado con placebo en el que 11.145 pacientes que se sometieron a una intervención coronaria percutánea urgente o electiva fueron asignados aleatoriamente para recibir cangrelor o clopidogrel antes de la intervención coronaria percutánea, mostró que el cangrelor redujo significativamente la tasa de eventos isquémicos durante la intervención coronaria percutánea. El cangrelor redujo el desarrollo de trombosis del stent más que el clopidogrel. Estos hallazgos se publicaron en 2013. [15] El cangrelor recibió la aprobación de la FDA en junio de 2015 como fármaco antiplaquetario para aplicación intravenosa. [16]
El objetivo molecular del metabolito activo de los inhibidores del receptor de ADP es el receptor P2Y 12. [17] El receptor P2Y 12 es un receptor acoplado a G y es activado por el difosfato de adenosina . El ADP se une al receptor P2Y 12 que conduce a la inhibición de la adenil ciclasa y, por lo tanto, disminuye los niveles intracelulares de AMPc. Esta reducción de AMPc reduce la fosforilación de la fosfoproteína estimulada por vasodilatadores que conduce a la activación de los receptores de glucoproteína IIb/IIIa . [18] La activación de los receptores de glucoproteína IIb/IIIa aumenta la producción de tromboxano y prolonga la agregación plaquetaria. [19] La ticlopidina, el clopidogrel y el prasugrel son profármacos de tienopiridina que son inhibidores plaquetarios irreversibles del receptor P2Y 12 . El cangrelor y el ticagrelor son inhibidores directos del receptor P2Y 12 que modifican la conformación del receptor P2Y 12 y, por lo tanto, dan lugar a una inhibición plaquetaria reversible del receptor. Las tienopiridinas se metabolizan en el hígado y el intestino a metabolitos activos. [20]

La ticlopidina es un profármaco y se metaboliza por al menos cinco vías principales. Se ha identificado un metabolito activo que tiene actividad antiplaquetaria. Este metabolito activo se forma por una vía dependiente del CYP. Se ha sugerido que CYP2C19 y CYP2B6 son enzimas que contribuyen a la transformación metabólica de la ticlopidina en el intermediario tiolactona , 2-oxo-ticlopidina en el hígado. El intermediario tiolactona se convierte luego en el metabolito activo de la ticlopidina a través de la oxidación del CYP, donde se produce la activación de la oxidación . Sin embargo, se desconocen las enzimas del CYP que participan en esta vía. [20] En la formación del metabolito activo se han identificado metabolitos adicionales, que son los metabolitos dihidrotienopiridinio (M5) y tienodihidropiridinio (M6). Estos metabolitos pueden ser responsables de los efectos secundarios tóxicos de la ticlopidina. [18]
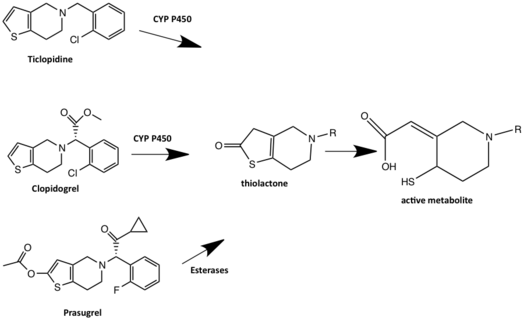
El clopidogrel es un profármaco que se metaboliza por dos vías. En una de las vías, la mayor parte de la dosis de clopidogrel (85%) es hidrolizada por esterasas a un derivado de ácido carboxílico inactivo y rápidamente depurado mediante glucoridinación seguida de excreción renal . La otra vía del clopidogrel requiere una activación metabólica hepática de dos pasos del CYP450 para producir el metabolito activo que inhibe el receptor P2Y 12. Se considera que CYP1A2, CYP3A4, CYP3A5 y CYP2C19 son las principales enzimas implicadas en el metabolismo del clopidogrel. [19] Primero, el clopidogrel se metaboliza en 2-oxo-clopidogrel, que a su vez se hidroliza al metabolismo activo que es un tiol . El tiol forma un puente disulfuro con una cisteína en el receptor P2Y 12 y, por tanto, se une irreversiblemente al receptor P2Y 12 . Se ha sugerido que el clopidogrel se une covalentemente a CYS17 o CYS270 del receptor P2Y 12 y, por lo tanto, bloquea la unión del agonista. [18] Algunos usuarios de clopidogrel tienen una actividad defectuosa del CYP2C19 y, por lo tanto, un metabolismo deficiente del CYP2C19 que conduce al riesgo de una actividad reducida del clopidogrel. Esto se debe a que el profármaco no se metaboliza al fármaco activo. Los fármacos que son inhibidores del CYP2C19 pueden interactuar con el clopidogrel y reducir su actividad. Todos los inhibidores de la bomba de protones, excepto el rabeprazol y el pantoprazol, son metabolizados por la enzima hepática CYP450 y, por lo tanto, pueden interactuar con el metabolismo del clopidogrel. Se considera que el omeprazol tiene un mayor potencial de interacción fármaco-fármaco que otros inhibidores de la bomba de proteínas porque es un inhibidor del CYP2C19. [17]
El prasugrel es una tienopiridina de tercera generación y un profármaco. A diferencia de la ticlopidina y el clopidogrel, la activación del prasugrel implica la hidrólisis a una tiolactona intermedia , que luego se convierte en el metabolito activo en un solo paso dependiente del CYP. El metabolito activo, que es R-138727 (intermedio tiol), se une irreversiblemente al receptor P2Y 12 o se metila metabólicamente a un metabolito inactivo. El R-138727 se inactiva metabólicamente a través de la S-metilación. El prasugrel no se metaboliza por el CYP2C19 como el clopidogrel y las variantes genéticas del CYP no tienen una influencia significativa en los metabolitos activos del prasugrel. El prasugrel tiene un inicio de acción más rápido y un mayor bloqueo del receptor con el metabolito activo que el clopidogrel. [18]
El ticagrelor fue el primer inhibidor reversible del receptor P2Y 12 , activo tras la administración oral. El ticagrelor es activo por vía oral sin necesidad de ninguna activación metabólica. Se absorbe rápidamente y sufre degradación enzimática hasta al menos un metabolito activo que es casi tan potente como su compuesto original. El ticagrelor ha mejorado los perfiles farmacocinéticos y farmacodinámicos en comparación con los fármacos actualmente disponibles para el tratamiento del SCA. Además, los genotipos del CYP2C19 que se sabe que influyen en el efecto del clopidogrel no influyeron en el efecto del ticagrelor. [19]
Cangrelor es el primer inhibidor reversible del receptor P2Y 12 que se puede administrar por vía intravenosa y tiene un inicio y una desaparición de sus efectos muy rápidos, lo que puede ofrecer ventajas sobre los fármacos actuales y permitir que cangrelor supere estas limitaciones del inhibidor oral del receptor P2Y 12. Esto lo convierte en una opción atractiva para la terapia antiplaquetaria, especialmente para pacientes que no pueden tomar fármacos orales (por ejemplo, pacientes que están inconscientes, vomitando o sedados). Al igual que el ticagrelor, no requiere conversión metabólica para ser activo y, por lo tanto, puede inhibir directamente el receptor P2Y 12. [21]
El prasugrel se desarrolló teniendo en cuenta el metabolismo. Esto se hizo reemplazando el grupo éster con una cetona metabólicamente estable (grupo R1). Además, la adición del grupo éster en la posición 2 del tiofeno (grupo R2) desplazó el primer paso de activación del CYP2C19 a las esterasas y, por lo tanto, el prasugrel no se metaboliza por el CYP2C19 como el clopidogrel. [22]

Cangrelor y ticagrelor son nuevas clases de receptores P2Y 12 reversibles que se han desarrollado para abordar los problemas de seguridad (hemorragia) y falta de respuesta que tienen las tienopiridinas. Se ha demostrado que los ligandos naturales como el trifosfato de adenosina ( ATP ) inhiben la agregación plaquetaria y se ha identificado como un antagonista débil . Cangrelor y ticagrelor son análogos de nucleótidos que tienen una estructura química que se asemeja al trifosfato de adenosina (ATP). [21] El ATP se puede metabolizar en los tejidos cardiovasculares a ADP, AMP o adenosina proagregantes. La sustitución del oxígeno anhídrido entre el fósforo β (Pβ) y el fósforo γ (Pγ) con dicloro o difluorometileno conduce a un compuesto que es equipotente al ATP y tiene un pKa similar . Debido a esta sustitución, se puede evitar el metabolismo del ATP a proagregantes. La adición de S-propilo en la longitud de la cadena tuvo un impacto importante en la actividad. La adición de amina alquilada monosustituida en la posición C4 de la adenosina condujo a un aumento de diez veces en la actividad y también la longitud del sustituyente de alquilamina se correlacionó con la compensación del efecto. La adición de un grupo metilsulfaniletilamino en la posición C4 y trifluoropropilsulfanilo en la longitud de la cadena conduce a la formación del fármaco cangrelor que ha mejorado la actividad. Cangrelor tiene una recuperación media del 78% de la agregación plaquetaria inducida por ADP en ratas después de 20 minutos en comparación con el compuesto 1C que tiene una recuperación de menos del 10%. [22]
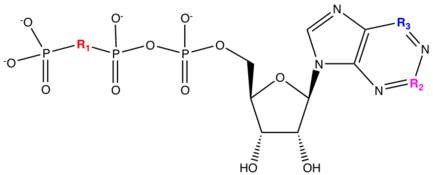
Para satisfacer la necesidad del fármaco oral reversible ticagrelor, se sustituyó la cadena de fosfato de cangrelor por un ácido aspártico , lo que dio como resultado una reducción de 300 veces en la potencia. La potencia de ticagrelor volvió al mismo nivel que cangrelor cambiando la purina por triazolopirimidina. La unidad de ribosa de azúcar también se sustituyó por un grupo ciclopentilo para evitar la posible inestabilidad del enlace glucosídico . El grupo del lado izquierdo de la estructura se sustituyó por la sidecaína R1. La cadena lateral neutra R1=CONH2 y R1= CH2OH se aceptaron con una ligera pérdida de afinidad y el metabolismo había cambiado del metabolismo biliar al hepático . Debido a esto, se pudieron utilizar ensayos microsomales hepáticos in vitro que simplificaron la optimización de las propiedades farmacocinéticas. La adición del sustituyente fenil ciclopropilamina en la posición 5 proporcionó altas afinidades. A partir de esto, se descubrió que el primer compuesto tenía una biodisponibilidad oral medible en ratas (R1 = CH 2 OH). La variación de R2 tuvo un impacto menor en la afinidad que permitió la introducción de grupos para mejorar las propiedades farmacocinéticas, por ejemplo, R1 = OCH 2 CH 2 OH. La introducción de flúor en el anillo de fenilo y al final de la cadena de alquilo de tioéter conduce a una estabilidad metabólica aún mejor. Al reemplazar los flúor en la cadena de alquilo de tioéter nuevamente a S-propilo, conduce a la formulación de ticagrelor. [22]

La activación de las plaquetas y la posterior agregación plaquetaria desempeñan un papel crucial en el mantenimiento de la hemostasia normal . La alteración de este sistema puede provocar enfermedades cerebrovasculares , cardiovasculares y vasculares periféricas , que pueden provocar un accidente cerebrovascular, angina inestable e infarto de miocardio. Cuando un vaso sanguíneo sufre daños, las células dañadas y las plaquetas activadas liberan ADP, lo que induce una mayor agregación plaquetaria. [23] [24]
El bloqueador del receptor P2Y 12 de tienopiridina de primera generación , ticlopidina, fue retirado del uso clínico debido a una alta incidencia de efectos secundarios como púrpura trombocitopénica trombótica , anemia aplásica y neutropenia . [25] El uso clínico del fármaco fue rápidamente eclipsado por el clopidogrel, ya que este último tenía menos efectos secundarios gastrointestinales y mejor seguridad hematológica . [26]
El clopidogrel, un bloqueador del receptor P2Y 12 de tienopiridina de segunda generación , es un agente antiplaquetario eficaz útil para el tratamiento de la liberación isquémica cerebrovascular, cardíaca y arterial periférica. [27] Al igual que otros fármacos tienopiridínicos, el fármaco se combinaba a menudo con aspirina en el uso clínico. [23] La dosis clínicamente aprobada de clopidogrel es una dosis de carga de 300 mg por vía oral y una dosis de mantenimiento de 75 mg por día por vía oral. [28]
Durante muchos años, el tratamiento dual con el inhibidor de la ciclooxigenasa-1 (COX-1), aspirina y clopidogrel, fue una práctica rutinaria y sirvió como los principales agentes antiplaquetarios para la prevención de eventos trombóticos, ya que tienen la capacidad de manipular poderosamente la biología plaquetaria, que desempeña un papel central en la trombosis. Sin embargo, el uso de estos agentes aún está sujeto a una serie de limitaciones importantes, como la exposición a un mayor riesgo de sangrado , lo que hace que la duración y la dosis de clopidogrel sean de suma importancia. Además, la respuesta al clopidogrel no es uniforme y una respuesta baja puede conducir a eventos cardiovasculares adversos importantes . [29] [30]
La nueva generación de bloqueadores del receptor P2Y 12 se propuso abordar estos problemas y promete mejorar los resultados de los pacientes. Estos bloqueadores del receptor P2Y 12 desarrollados recientemente (ticagrelor, cangrelor, prasugrel y elinogrel) proporcionan una inhibición más consistente y más fuerte de las plaquetas al antagonizar de manera más eficiente el receptor P2Y 12. Sin embargo, esta inhibición plaquetaria más potente se produce a costa de un mayor riesgo de sangrado. [31] [29]
El prasugrel, una tienopiridina de tercera generación, se metaboliza de manera más eficiente que el clopidogrel y la ticlopidina en el cuerpo y, por lo tanto, previene la activación plaquetaria en mayor medida. Los estudios han demostrado que el prasugrel reduce el riesgo de trombosis del stent y de infarto de miocardio en un nivel mucho mayor que el clopidogrel. [26] La dosis clínicamente aprobada de prasugrel es una dosis de carga de 60 mg por vía oral y una dosis de mantenimiento de 10 mg por día por vía oral. [28]
El ticagrelor es un inhibidor de la agregación plaquetaria mucho más potente que el clopidogrel, sin embargo, se asocia con un aumento de los episodios de disnea en los pacientes. Estos episodios pueden variar de gravedad leve a moderada. La dosis clínica aprobada de ticagrelor es una dosis de carga de 180 mg por vía oral y una dosis de mantenimiento de 90 mg al día. [32]
El único fármaco parental dirigido al receptor P2Y 12 en uso clínico es el cangrelor. [33]
La enzima CYP2C19 metaboliza los inhibidores de la bomba de protones (IBP) así como el clopidogrel. Varios informes han indicado que existe una interacción farmacológica negativa entre clopidogrel y omeprazol . Algunos estudios han encontrado que la actividad del clopidogrel sobre las plaquetas se vio obstaculizada significativamente por los pacientes que recibieron tratamiento con omeprazol , un inhibidor de la bomba de protones (IBP). [34] [35] Otro estudio también mostró que el lansoprazol tiene efectos obstaculizadores sobre la actividad del clopidogrel. [36] Sin embargo, otros estudios han demostrado que la ingesta de los IBP pantoprazol o esomeprazol no está asociada con una respuesta alterada al clopidogrel. [35] [37]
En 2009, la Administración de Alimentos y Medicamentos de los Estados Unidos ( FDA ) y la Agencia Europea de Medicamentos (EMA) desaconsejaron la combinación de clopidogrel e IBP, especialmente omeprazol, debido a las observaciones realizadas en ese momento en los estudios de cohorte iniciales. Sin embargo, los estudios de cohorte retrospectivos más recientes no han demostrado eventos cardiovasculares adversos causados por interacciones clopidogrel-IBP. Por lo tanto, no hay evidencia definitiva sobre el efecto de la interacción farmacológica sobre la mortalidad. [38]
En pacientes con alto riesgo de sangrado gastrointestinal, el riesgo supera los posibles efectos cardiovasculares adversos. Por lo tanto, se recomienda a estos pacientes combinar clopidogrel con IBP menos inhibidores de CYP2C19, como pantoprazol. [38]
La resistencia al clopidogrel ha surgido a lo largo de los años y se ha convertido en una gran preocupación para el tratamiento de pacientes con SCA o sometidos a ICP. Se informa que la resistencia al clopidogrel varía entre el 4 y el 44 % entre diferentes poblaciones y grupos étnicos . Los pacientes expuestos a la resistencia al clopidogrel muestran una menor actividad de inhibición plaquetaria debido a la disminución de los niveles del metabolito activo del clopidogrel. Esto da lugar a una serie de incidentes clínicos, por ejemplo, complicaciones isquémicas y tromboembólicas. Estos pacientes se reconocen como pacientes con baja respuesta o que no responden al tratamiento. [39] [40]
El clopidogrel es un profármaco que necesita una metabolización en dos pasos con la ayuda de enzimas para convertirse en un metabolito activo. Una de las enzimas cruciales en el metabolismo del clopidogrel es la CYP2C19, que participa en ambos pasos de la biotransformación. Un polimorfismo de la enzima CYP2C19 afecta la respuesta al clopidogrel, disminuyendo así la actividad enzimática y, por lo tanto, reduciendo el metabolito activo del clopidogrel. [40]
El principal problema de la resistencia al clopidogrel es la interacción con otros fármacos, especialmente el inhibidor de la bomba de protones omeprazol. El omeprazol y el clopidogrel se metabolizan por la misma vía metabólica del CYP. En consecuencia, se ha sugerido que la baja respuesta del clopidogrel, con el uso concomitante de omeprazol, se debe a la competencia de la enzima CYP2C19 entre estos dos fármacos. [40]
Los enfoques clínicos para superar la resistencia al clopidogrel incluyen dosis más altas de clopidogrel, uso concomitante con el inhibidor de la fosfodiesterasa cilostazol o cambio a un nuevo agente antiplaquetario como prasugrel y ticagrelor. Aun así, la principal preocupación con estos métodos es el aumento del riesgo de sangrado. Por lo tanto, la necesidad de un nuevo agente antiplaquetario con un inicio de acción rápido, menos variabilidad en la respuesta entre individuos y un perfil de seguridad mejorado es fundamental. [39]
El desarrollo de inhibidores de ADP avanza constantemente y la búsqueda de antagonistas del P2Y 12 aún mejores aún continúa. [1] La piedra angular de la prevención secundaria de eventos aterotrombóticos en pacientes con SCA o sometidos a ICP es la terapia antiplaquetaria dual con aspirina y clopidogrel. Sin embargo, aún ocurren eventos de aterotrombosis. [41] Las limitaciones de los fármacos antiplaquetarios actuales incluyen el riesgo de sangrado y la variabilidad interindividual de la respuesta inhibidora de plaquetas. [6]
El objetivo es determinar la ventana terapéutica óptima para maximizar los beneficios terapéuticos y reducir los problemas de seguridad, como las hemorragias. En consecuencia, el principal objetivo pendiente de los inhibidores de ADP es desarrollar un potente agente antiplaquetario reversible con un inicio de acción rápido, altos niveles de actividad antiplaquetaria y, al mismo tiempo, un menor riesgo de hemorragias. Este ambicioso objetivo, junto con un perfil oral de una vez al día y una selectividad optimizada de los objetivos, posiblemente suponga un avance importante en este campo. [1] [39]
El vicagrel es el último desarrollo, a partir de septiembre de 2017, en este sector. Un nuevo análogo de acetato de clopidogrel que se espera que logre una mayor eficacia antiplaquetaria, así como una disminución del riesgo de sangrado. [42] Los estudios farmacocinéticos preliminares de vicagrel han demostrado una mayor biodisponibilidad que en clopidogrel, lo que indica una dosis terapéutica efectiva mucho menor para vicagrel. Se considera que las ventajas de vicagrel sobre clopidogrel son la ausencia de resistencia al fármaco para los metabolizadores lentos de CYP2C19, la disminución de la toxicidad relacionada con la dosis debido a una dosis efectiva más baja y un inicio de acción más rápido . [39]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )[ página necesaria ]{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace )[ página necesaria ]