Un teratoma inmaduro es un teratoma que contiene elementos inmaduros anaplásicos y, a menudo, es sinónimo de teratoma maligno . [1] Un teratoma es un tumor de origen de células germinales, que contiene tejidos de más de una línea de células germinales, [2] [3] [4] Puede ser de origen ovárico o testicular. [4] y casi siempre son benignos. [5] Un teratoma inmaduro es, por tanto, un tumor muy raro, que representa el 1% de todos los teratomas , el 1% de todos los cánceres de ovario y el 35,6% de los tumores malignos de células germinales de ovario . [6] Muestra una edad específica de incidencia, ya que ocurre con mayor frecuencia en las dos primeras décadas de vida y casi nunca después de la menopausia . [4] A diferencia de un teratoma quístico maduro, un teratoma inmaduro contiene estructuras inmaduras o embrionarias. Puede coexistir con teratomas quísticos maduros y puede constituir una combinación de tejido adulto y embrionario. [7] [8] Los síntomas más comunes observados son distensión y masas abdominales . [9] El pronóstico y las opciones de tratamiento varían y dependen en gran medida del grado , el estadio y el cariotipo del tumor en sí.
En la TC y la RMN , un teratoma inmaduro posee una apariencia característica. Por lo general, es grande (12–25 cm) y tiene componentes sólidos prominentes con elementos quísticos. [10] Por lo general, está lleno de constituyentes lipídicos y, por lo tanto, muestra densidad grasa en la TC y la RMN . [10] La apariencia ecográfica de un teratoma inmaduro es inespecífica. Es altamente heterogéneo con lesiones parcialmente sólidas y calcificaciones dispersas. [11] [12]
Tradicionalmente, la estadificación quirúrgica integral se realiza mediante una laparotomía exploratoria con lavados citológicos, biopsias peritoneales , una evaluación del epiplón (ya sea una biopsia o, en raras ocasiones, una omentectomía completa ) y disección de los ganglios linfáticos pélvicos y aórticos . La laparoscopia se sugiere a menudo como una alternativa para estadificar quirúrgicamente a los pacientes con teratoma inmaduro. [13] [14]
El cáncer de ovario se estadifica utilizando el sistema de estadificación FIGO y utiliza información obtenida después de la cirugía, que puede incluir una histerectomía abdominal total mediante laparotomía media , salpingooforectomía unilateral (o bilateral), lavados pélvicos (peritoneales), evaluación de los ganglios linfáticos retroperitoneales y/o apendicectomía . [15] [16] El sistema de estadificación AJCC , idéntico al sistema de estadificación FIGO, describe la extensión del tumor (T), la presencia o ausencia de metástasis en los ganglios linfáticos (N), la presencia o ausencia de metástasis a distancia (M). [17]
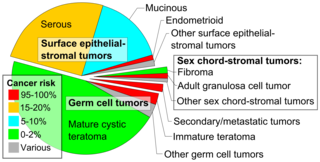
Un teratoma inmaduro contiene composiciones variables de tejido adulto y embrionario. El componente embrionario más común identificado en teratomas inmaduros es el neuroectodermo . [19] Ocasionalmente, los tumores pueden presentar neuroepitelio que se asemeja a los neuroblastos . [19] Los tumores también pueden presentar componentes embrionarios como cartílago inmaduro y músculo esquelético de origen mesodérmico . [19] Los teratomas inmaduros compuestos por derivados endodérmicos embrionarios son raros. [19]
A menudo, un teratoma quístico maduro se diagnostica erróneamente como su contraparte inmadura debido a la interpretación errónea del tejido neural maduro como inmaduro. [20] Mientras que las células neurales maduras tienen núcleos con cromatina uniformemente densa y no exhiben actividad apoptótica o mitótica , las células neurales inmaduras tienen núcleos con cromatina vesicular y exhiben actividad tanto apoptótica como mitótica . [20] Un estudio reciente ha identificado el uso de Oct-4 como un biomarcador confiable para el diagnóstico de casos altamente malignos de teratomas inmaduros. [21]
Thurlbeck y Scully idearon un sistema de clasificación para los teratomas inmaduros “puros” basándose en la diferenciación de los elementos celulares del tumor. [22] La proporción de elementos tisulares inmaduros define el grado de inmadurez. [22] Esto fue modificado posteriormente por Norris et al . (1976), quienes añadieron un aspecto cuantitativo al grado de inmadurez. [23]
Un teratoma inmaduro de ovario es cariotípicamente normal 46,XX o casi normal. Los tumores de grado 1 o 2 muestran un cariotipo normal 46,XX, mientras que los tumores de grado 3 muestran una variedad de cariotipos anormales . [24] Aunque las células de teratoma inmaduro muestran un cariotipo normal , aún puede haber alteraciones detectables en el nivel genético y estas aberraciones pueden influir en la estabilidad del estado cromosómico . [24]
Los teratomas inmaduros de ovario se han clasificado entre los cánceres sólidos menos mutados. [25] Los teratomas inmaduros se originan a partir de células germinales que experimentan una de varias fallas meióticas, lo que conduce a un genoma tumoral con altos niveles de pérdida de heterocigosidad de copia neutral. [25]
Aunque varios estudios han demostrado que el tamaño y el estadio del tumor primario están relacionados con la supervivencia, el grado del tumor es el mejor determinante del pronóstico antes de la diseminación peritoneal . [23] [24] Una vez que se ha producido la diseminación peritoneal , el grado de las lesiones metastásicas o los implantes es el mejor determinante del pronóstico . [23] [24] Se necesitan múltiples secciones del tumor primario y un amplio muestreo de los implantes para calificar adecuadamente el tumor. En la mayoría de los casos, los implantes se diferencian mejor que los tumores primarios. [8] La gliomatosis peritoneal, una enfermedad rara a menudo asociada con el teratoma ovárico inmaduro, se caracteriza por la presencia de implantes gliales maduros en el peritoneo . [26] Yoon et al. (2012) informaron que los pacientes con teratoma ovárico inmaduro con gliomatosis peritoneal tienen tumores más grandes, recurrencia más frecuente y niveles más altos de CA-125 que los pacientes con teratoma ovárico inmaduro sin gliomatosis peritoneal. [27]
Un alto grado de inmadurez en el tumor primario, que corresponde con un diagnóstico de grado 3, es un signo de mal pronóstico. [23] [8] [28] [29] Los tumores de grado 3 a menudo muestran anomalías cromosómicas , también una indicación de mal pronóstico. [24] El grado del tumor es el factor más importante para la recaída en teratomas inmaduros. [28] Vicus et al. (2011) , informaron que los tumores de grado 2 o 3 se asocian con una mayor probabilidad de recaída que puede ser fatal, predominantemente dentro de los 2 años del diagnóstico. [30] Entre los pacientes de grado 3, el estadio se asoció significativamente con la recaída . [30]
En el pasado, las tasas de supervivencia eran bajas para los teratomas inmaduros de alto grado. Norris et al. (1976) informaron una tasa de supervivencia del 82% para pacientes con tumores de grado 1, del 62% para los de grado 2 y del 30% para los de grado 3. [23] Sin embargo, estos resultados son anteriores al uso de quimioterapia con múltiples agentes . [8] Con el advenimiento de la quimioterapia con múltiples agentes después de la resección quirúrgica, se han logrado remisiones a largo plazo y mayores tasas de supervivencia. Pashankar et al. (2016) informaron que la tasa de supervivencia general estimada a 5 años para la enfermedad de grado 3, estadio I y II fue del 91% en comparación con el 88% para la enfermedad de grado 3, estadio III y IV. [28]
El grado histológico y los deseos de fertilidad de la paciente son consideraciones clave para determinar las opciones de tratamiento. En las mujeres adultas, la quimioterapia adyuvante posoperatoria es la opción estándar, excepto en el caso de la enfermedad en estadio I/grado 1. En pacientes pediátricos, la cirugía sola es la opción estándar. [28]
Dado que la aparición de teratoma inmaduro es muy raramente bilateral, el estándar actual de atención es la salpingooforectomía unilateral con una amplia muestra de implantes peritoneales. [8] La histerectomía abdominal total con salpingooforectomía bilateral no está indicada ya que no influyen en los resultados. [8] La cirugía para preservar la fertilidad en forma de salpingooforectomía unilateral es la modalidad de tratamiento principal en pacientes jóvenes. [31] [32] [33] Algunos médicos recomiendan la cistectomía ovárica sola, en lugar de una salpingooforectomía unilateral para pacientes con una enfermedad de bajo grado en etapa temprana. Zhao et al. (2017) , no informaron diferencias significativas en las tasas de supervivencia o los resultados de fertilidad posoperatorios entre las dos opciones de tratamiento. [34] Sin embargo, otros advierten contra tal enfoque. [8]
Norris et al. (1976) observaron una tasa de recurrencia del 18% en tumores de grado 2 y del 70% en tumores de grado 3. [23] Gershenson et al. (1986), informaron los resultados de 41 pacientes con enfermedad en estadio I-IV y observaron recurrencias en el 94% de los pacientes tratados solo con cirugía en comparación con el 14% en los pacientes tratados con cirugía y quimioterapia. [35] Estudios como estos dieron como resultado la recomendación de utilizar quimioterapia para tumores de grado 2 y 3. Actualmente, el uso de quimioterapia con múltiples agentes para pacientes adultos con teratoma inmaduro de ovario es el estándar de atención, excepto para tumores de grado 1, estadio I. [28] Existe una experiencia considerable con una combinación de vincristina , dactinomicina y ciclofosfamida (VAC) administrada en un entorno adyuvante; Sin embargo, ahora se prefieren las combinaciones que contienen cisplatino , etopósido y bleomicina (BEP) debido a una menor tasa de recaída y un tiempo de tratamiento más corto. [36] Si bien no se ha realizado una comparación prospectiva de VAC versus BEP, en pacientes bien estadificados con tumores completamente resecados, la recaída es esencialmente desconocida después de la quimioterapia basada en platino . [36] Sin embargo, la enfermedad recurrirá en aproximadamente el 25% de los pacientes bien estadificados tratados con 6 meses de VAC. [37]
![]() Este artículo incorpora material de dominio público del Diccionario de términos sobre el cáncer. Instituto Nacional del Cáncer de EE. UU .
Este artículo incorpora material de dominio público del Diccionario de términos sobre el cáncer. Instituto Nacional del Cáncer de EE. UU .