Las fases del hielo son todos los estados posibles de la materia para el agua como sólido. Actualmente, se han observado 19 fases, que incluyen hielo cristalino y amorfo , en diversas densidades.
La mayoría de los líquidos bajo mayor presión se congelan a temperaturas más altas porque la presión ayuda a mantener unidas las moléculas. Sin embargo, los fuertes enlaces de hidrógeno del agua lo hacen diferente: para algunas presiones superiores a 1 atm (0,10 MPa), el agua se congela a una temperatura inferior a 0 °C. Sometido a presiones más altas y temperaturas variables, el hielo puede formarse en diecinueve fases cristalinas conocidas separadas. Con cuidado, al menos quince de estas fases (una de las excepciones conocidas es el hielo X) se pueden recuperar a presión ambiente y baja temperatura en forma metaestable . [1] [2] Los tipos se diferencian por su estructura cristalina, orden de protones, [3] y densidad. También hay dos fases metaestables de hielo bajo presión, ambas completamente desordenadas por hidrógeno; estos son Ice IV y Ice XII.


La estructura cristalina aceptada del hielo ordinario fue propuesta por primera vez por Linus Pauling en 1935. La estructura del hielo I h es la red de wurtzita , aproximadamente una de planos arrugados compuestos de anillos hexagonales teselado , con un átomo de oxígeno en cada vértice, y los bordes de los anillos formados por enlaces de hidrógeno . Los planos se alternan en un patrón ABAB, siendo los planos B reflejos de los planos A a lo largo de los mismos ejes que los planos mismos. [4] La distancia entre los átomos de oxígeno a lo largo de cada enlace es de aproximadamente 275 pm y es la misma entre dos átomos de oxígeno unidos en la red. El ángulo entre los enlaces en la red cristalina es muy cercano al ángulo tetraédrico de 109,5°, que también está bastante cerca del ángulo entre los átomos de hidrógeno en la molécula de agua (en fase gaseosa), que es de 105°.
Este ángulo de enlace tetraédrico de la molécula de agua explica esencialmente la densidad inusualmente baja de la red cristalina; es beneficioso que la red esté dispuesta con ángulos tetraédricos aunque exista una penalización de energía en el mayor volumen de la red cristalina. Como resultado, los grandes anillos hexagonales dejan casi suficiente espacio para que exista otra molécula de agua en su interior. Esto le da al hielo natural su rara propiedad de ser menos denso que su forma líquida. Los anillos hexagonales unidos por enlaces de hidrógeno en ángulos tetraédricos también son el mecanismo que hace que el agua líquida sea más densa a 4 °C. Cerca de 0 °C, se forman pequeñas redes hexagonales tipo hielo I h en agua líquida, con mayor frecuencia cerca de 0 °C. Este efecto disminuye la densidad del agua, lo que hace que sea más densa a 4 °C cuando las estructuras se forman con poca frecuencia.
En la forma más conocida de hielo, el hielo I h , la estructura cristalina se caracteriza por que los átomos de oxígeno forman simetría hexagonal con ángulos de enlace casi tetraédricos . Esta estructura es estable hasta -268 °C (5 K; -450 °F), como lo demuestran la difracción de rayos X [5] y las mediciones de expansión térmica de resolución extremadamente alta. [6] El hielo I h también es estable bajo presiones aplicadas de hasta aproximadamente 210 megapascales (2100 atm), donde pasa a hielo III o hielo II. [7]
Si bien la mayoría de las formas de hielo son cristalinas, también existen varias formas de hielo amorfas (o "vítreas"). Este tipo de hielo es una forma sólida amorfa de agua, que carece de orden de largo alcance en su disposición molecular. El hielo amorfo se produce enfriando rápidamente agua líquida hasta su temperatura de transición vítrea (aproximadamente 136 K o −137 °C) en milisegundos (por lo que las moléculas no tienen tiempo suficiente para formar una red cristalina ), o comprimiendo hielo ordinario a temperaturas bajas. La forma más común en la Tierra, el hielo de baja densidad, generalmente se forma en el laboratorio mediante una lenta acumulación de moléculas de vapor de agua ( deposición física de vapor ) sobre una superficie de cristal metálico muy lisa a una temperatura de 120 K. En el espacio exterior se espera que sea formado de manera similar en una variedad de sustratos fríos, como partículas de polvo. [8] Por el contrario, el agua vítrea hiperapagada (HGW) se forma rociando una fina niebla de gotas de agua en un líquido como el propano a alrededor de 80 K, o hiperapagando gotas finas del tamaño de un micrómetro en un portamuestras mantenido a la temperatura del nitrógeno líquido. , 77 K, en el vacío. Se requieren velocidades de enfriamiento superiores a 10 4 K/s para evitar la cristalización de las gotas. A una temperatura del nitrógeno líquido de 77 K, el HGW es cinéticamente estable y puede almacenarse durante muchos años.
Los hielos amorfos tienen la propiedad de suprimir las fluctuaciones de densidad de largo alcance y, por lo tanto, son casi hiperuniformes . [9] A pesar del epíteto "hielo", el análisis de clasificación que utiliza redes neuronales ha demostrado que los hielos amorfos son vasos . [10]

El hielo de un agua superiónica teorizada puede poseer dos estructuras cristalinas. A presiones superiores a 50 GPa (7.300.000 psi), dicho hielo superiónico adoptaría una estructura cúbica centrada en el cuerpo . Sin embargo, a presiones superiores a 100 GPa (15.000.000 psi), la estructura puede cambiar a una red cúbica centrada en las caras más estable . Algunas estimaciones sugieren que a una presión extremadamente alta de alrededor de 1,55 TPa (225.000.000 psi), el hielo desarrollaría propiedades metálicas . [12]

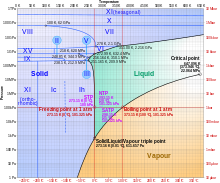
En el punto triple , que está exactamente a 273,16 K (0,01 °C) a una presión de 611,657 Pa , pueden coexistir hielo, agua y vapor de agua . [14] [15] El kelvin se definió como1/273.16de la diferencia entre este punto triple y el cero absoluto , [16] aunque esta definición cambió en mayo de 2019. [17] A diferencia de la mayoría de los otros sólidos, el hielo es difícil de sobrecalentar . En un experimento, se sobrecalentó hielo a -3 °C a unos 17 °C durante unos 250 picosegundos . [18]

El calor latente de fusión es5987 J/mol , y su calor latente de sublimación es50 911 J/mol . El alto calor latente de sublimación es principalmente indicativo de la fuerza de los enlaces de hidrógeno en la red cristalina. El calor latente de fusión es mucho menor, en parte porque el agua líquida cerca de 0 °C también contiene un número significativo de enlaces de hidrógeno. Por el contrario, la estructura del hielo II está ordenada por hidrógeno, lo que ayuda a explicar el cambio de entropía de 3,22 J/mol cuando la estructura cristalina cambia a la del hielo I. Además, el hielo XI, una forma de hielo ortorrómbica ordenada por hidrógeno I h , se considera la forma más estable a bajas temperaturas.
Se estima que la entropía de transición del hielo XIV al hielo XII es el 60% de la entropía de Pauling según las mediciones de DSC. [19] La formación de hielo XIV a partir de hielo XII se favorece más a alta presión. [20]
Cuando el hielo amorfo de densidad media se comprime, se libera y luego se calienta, libera una gran cantidad de energía térmica, a diferencia de otros hielos de agua que vuelven a su forma normal después de recibir un tratamiento similar. [21]

Los átomos de hidrógeno en la red cristalina se encuentran muy cerca de los enlaces de hidrógeno y de tal manera que se conserva cada molécula de agua. Esto significa que cada átomo de oxígeno en la red tiene dos hidrógenos adyacentes: aproximadamente a 101 pm a lo largo de las 275 pm de longitud del enlace del hielo Ih. La red cristalina permite una cantidad sustancial de desorden en las posiciones de los átomos de hidrógeno congelados en la estructura a medida que se enfría hasta el cero absoluto. Como resultado, la estructura cristalina contiene cierta entropía residual inherente a la red y determinada por el número de posibles configuraciones de posiciones de hidrógeno que se pueden formar manteniendo al mismo tiempo el requisito de que cada átomo de oxígeno tenga sólo dos hidrógenos en la proximidad más cercana, y cada uno Enlace de H que une dos átomos de oxígeno que tienen un solo átomo de hidrógeno. [22] Esta entropía residual S 0 es igual a 3,4±0,1 J mol −1 K −1 . [23]
Hay varias formas de aproximar este número a partir de los primeros principios. El siguiente es el utilizado por Linus Pauling . [24] [25]
Supongamos que hay un número dado N de moléculas de agua en una red de hielo. Para calcular su entropía residual, necesitamos contar el número de configuraciones que puede asumir la red. Los átomos de oxígeno están fijados en los puntos de la red, pero los átomos de hidrógeno se encuentran en los bordes de la red. El problema es elegir un extremo de cada borde de la red para que se enlace el hidrógeno, de una manera que aún garantice que cada átomo de oxígeno esté unido a dos átomos de hidrógeno.
Los átomos de oxígeno se pueden dividir en dos conjuntos en un patrón de tablero de ajedrez, que se muestra en la imagen como bolas blancas y negras. Centra la atención en los átomos de oxígeno de un conjunto: hay N /2 de ellos. Cada uno tiene cuatro enlaces de hidrógeno, dos de ellos cercanos y dos lejanos. Esto significa que hay configuraciones permitidas de hidrógenos para este átomo de oxígeno (ver Coeficiente binomial ). Por lo tanto, hay 6 configuraciones N /2 que satisfacen estos átomos N /2 . Pero ahora, consideremos los átomos restantes de oxígeno N /2 : en general no estarán satisfechos (es decir, no tendrán exactamente dos átomos de hidrógeno cerca de ellos). Para cada uno de ellos, hay 2 4 = 16 ubicaciones posibles de los átomos de hidrógeno a lo largo de sus enlaces de hidrógeno, de las cuales 6 están permitidas. Entonces, ingenuamente, esperaríamos que el número total de configuraciones fuera
Usando la fórmula de entropía de Boltzmann , concluimos que
La misma respuesta se puede encontrar de otra manera. Primero oriente cada molécula de agua al azar en cada una de las 6 configuraciones posibles, luego verifique que cada borde de la red contenga exactamente un átomo de hidrógeno. Suponiendo que las aristas de la red son independientes, entonces la probabilidad de que una sola arista contenga exactamente un átomo de hidrógeno es 1/2, y dado que hay 2N aristas en total, obtenemos un recuento de configuración total , como antes.

Esta estimación es "ingenua", ya que supone que seis de las 16 configuraciones de hidrógeno para los átomos de oxígeno en el segundo conjunto se pueden elegir de forma independiente, lo cual es falso. Se pueden emplear métodos más complejos para aproximar mejor el número exacto de configuraciones posibles y lograr resultados más cercanos a los valores medidos. Nagle (1966) utilizó una suma de series para obtener . [26]
Como ejemplo ilustrativo de refinamiento, considere la siguiente forma de refinar el segundo método de estimación proporcionado anteriormente. Según él, seis moléculas de agua en un anillo hexagonal permitirían configuraciones. Sin embargo, por enumeración explícita, en realidad hay 730 configuraciones. Ahora, en la red, cada átomo de oxígeno participa en 12 anillos hexagonales, por lo que hay 2N anillos en total para N átomos de oxígeno, o 2 anillos para cada átomo de oxígeno, lo que da un resultado refinado de . [27]
Estas fases se denominan según la nomenclatura de Bridgman . La mayoría sólo han sido creados en laboratorio a diferentes temperaturas y presiones. [28]

Las propiedades del hielo II fueron descritas y registradas por primera vez por Gustav Heinrich Johann Apollon Tammann en 1900 durante sus experimentos con hielo a alta presión y bajas temperaturas. Habiendo producido hielo III, Tammann intentó condensar el hielo a una temperatura entre -70 y -80 °C (203 y 193 K; -94 y -112 °F) bajo 200 MPa (2000 atm) de presión. Tammann notó que en este estado el hielo II era más denso de lo que había observado que era el hielo III. También descubrió que ambos tipos de hielo pueden mantenerse a presión atmosférica normal en condiciones estables siempre que la temperatura se mantenga a la del aire líquido , lo que ralentiza el cambio de conformación de nuevo a hielo I h . [45]
En experimentos posteriores realizados por Bridgman en 1912, se demostró que la diferencia de volumen entre el hielo II y el hielo III estaba en el rango de 0,0001 m 3 /kg (2,8 pulgadas cúbicas/libra). Tammann no había descubierto esta diferencia debido al pequeño cambio y era la razón por la que no había podido determinar una curva de equilibrio entre los dos. La curva mostró que el cambio estructural de hielo III a hielo II era más probable que ocurriera si el medio había estado previamente en la conformación estructural de hielo II. Sin embargo, si se obtuviera una muestra de hielo III que nunca hubiera estado en el estado de hielo II, podría sobreenfriarse incluso por debajo de -70 °C sin que se convirtiera en hielo II. Sin embargo, por el contrario, no fue posible sobrecalentar el hielo II para que mantuviera la misma forma. Bridgman descubrió que la curva de equilibrio entre el hielo II y el hielo IV era muy parecida a la del hielo III, teniendo las mismas propiedades de estabilidad y un pequeño cambio de volumen. Sin embargo, la curva entre el hielo II y el hielo V era extremadamente diferente: la burbuja de la curva era esencialmente una línea recta y la diferencia de volumen era casi siempre de 0,000 0545 m 3 /kg (1,51 pulgadas cúbicas/libra). [45]
Como el hielo II está completamente ordenado por hidrógeno, la presencia de su contraparte desordenada es un tema de gran interés. Shepard et al. [83] investigaron los límites de fase de hielos dopados con NH 4 F porque se ha informado que el NH 4 F es un reactivo que altera el hidrógeno. Sin embargo, la adición de 2,5% en moles de NH 4 F dio como resultado la desaparición del hielo II en lugar de la formación de un hielo II desordenado. Según el cálculo de DFC de Nakamura et al., [84] se estima que el límite de fase entre el hielo II y su contraparte desordenada está en la región de estabilidad del agua líquida.
La investigación de 1981 de Engelhardt y Kamb dilucidó la estructura cristalina del hielo IV mediante difracción de rayos X monocristalino a baja temperatura, describiéndola como una celda unitaria romboédrica con un grupo espacial de R-3c. [85] Esta investigación mencionó que la estructura del hielo IV podría derivarse de la estructura del hielo Ic cortando y formando algunos enlaces de hidrógeno y agregando sutiles distorsiones estructurales. Shepard et al. [86] comprimieron la fase ambiental de NH 4 F, un material isoestructural del hielo, para obtener NH 4 F II, cuya red de enlaces de hidrógeno es similar a la del hielo IV. Como la compresión del hielo Ih da como resultado la formación de hielo amorfo de alta densidad (HDA), no hielo IV, afirmaron que la conversión inducida por la compresión del hielo I en hielo IV es importante, y lo denominaron "colapso Engelhardt-Kamb" ( EKC). Sugirieron que la razón por la que no podemos obtener hielo IV directamente del hielo Ih es que el hielo Ih tiene trastornos del hidrógeno; Si los átomos de oxígeno están dispuestos en la estructura del hielo IV, es posible que no se formen enlaces de hidrógeno debido a la falta de coincidencia donante-aceptor. [87] y Raman [88]
La naturaleza desordenada del Hielo IV fue confirmada por estudios de difracción de neutrones en polvo realizados por Lobban (1998) [89] y Klotz et al. (2003). [90] Además, la diferencia de entropía entre el hielo VI (fase desordenada) y el hielo IV es muy pequeña, según la medición de Bridgman. [91]
Se habían propuesto varios reactivos de nucleación orgánicos para cristalizar selectivamente el hielo IV en agua líquida, [92] pero incluso con tales reactivos, la cristalización del hielo IV en agua líquida era muy difícil y parecía ser un evento aleatorio. En 2001, Salzmann y sus compañeros de trabajo informaron sobre un método completamente nuevo para preparar hielo intravenoso de manera reproducible ; [93] cuando se calienta hielo amorfo de alta densidad (HDA) a una velocidad de 0,4 K/min y una presión de 0,81 GPa, el hielo IV se cristaliza a aproximadamente 165 K. Lo que gobierna los productos de cristalización es la velocidad de calentamiento; El calentamiento rápido (más de 10 K/min) da como resultado la formación de hielo monofásico XII.
Aún no se ha informado sobre la contraparte encargada del Ice IV. La investigación de 2011 realizada por el grupo de Salzmann informó datos de DSC más detallados en los que la característica endotérmica se hace más grande a medida que la muestra se recupera a mayor presión. Propusieron tres escenarios para explicar los resultados experimentales: ordenamiento débil del hidrógeno, transición vítrea orientacional y distorsiones mecánicas. [94] informaron que los termogramas de DSC de hielo IV dopado con HCl encontraron una característica endotérmica a aproximadamente 120 K. Diez años después, Rosu-Finsen y Salzmann (2021) informaron datos de DSC más detallados en los que la característica endotérmica se vuelve más grande a medida que la muestra se apaga. -recuperado a mayor presión. Propusieron tres escenarios para explicar los resultados experimentales: ordenamiento débil del hidrógeno, transición vítrea orientacional y distorsiones mecánicas. [95]
El Hielo VII es la única fase desordenada del hielo que se puede ordenar mediante un simple enfriamiento. (Mientras que el hielo I h teóricamente se transforma en hielo XI ordenado por protones en escalas de tiempo geológicas, en la práctica es necesario agregar pequeñas cantidades de catalizador KOH). Forma hielo VIII (ordenado) por debajo de 273 K hasta ~8 GPa. Por encima de esta presión, la temperatura de transición VII-VIII cae rápidamente, alcanzando 0 K a ~60 GPa. [96] Por lo tanto, el hielo VII tiene el campo de estabilidad más grande de todas las fases moleculares del hielo. Las subredes cúbicas de oxígeno que forman la columna vertebral de la estructura del hielo VII persisten a presiones de al menos 128 GPa; [97] esta presión es sustancialmente más alta que aquella a la que el agua pierde completamente su carácter molecular, formando hielo X. En los hielos de alta presión, la difusión protónica (movimiento de protones alrededor de la red de oxígeno) domina la difusión molecular, un efecto que se ha medido directamente . [98]


El hielo XI es la forma ordenada por hidrógeno de la forma ordinaria del hielo. La energía interna total del hielo XI es aproximadamente una sexta parte menor que la del hielo I h , por lo que, en principio, debería formarse naturalmente cuando el hielo I h se enfría por debajo de 72 K. La baja temperatura requerida para lograr esta transición se correlaciona con la diferencia de energía relativamente baja entre las dos estructuras. [99] Ya en 1964 se habían observado indicios de ordenamiento del hidrógeno en el hielo, cuando Dengel et al. atribuyeron un pico en la corriente de despolarización termoestimulada (TSD) a la existencia de una fase ferroeléctrica ordenada por protones. [100] Sin embargo, no pudieron probar de manera concluyente que se hubiera producido una transición de fase, y Onsager señaló que el pico también podría surgir del movimiento de defectos e imperfecciones de la red. Onsager sugirió que los experimentadores buscaran un cambio dramático en la capacidad calorífica realizando un experimento calorimétrico cuidadoso. Una transición de fase al hielo XI fue identificada experimentalmente por primera vez en 1972 por Shuji Kawada y otros. [101] [102] [103]
Las moléculas de agua en el hielo I h están rodeadas por cuatro enlaces de hidrógeno dirigidos semialeatoriamente . Tales disposiciones deberían cambiar a la disposición más ordenada de los enlaces de hidrógeno que se encuentran en el hielo XI a bajas temperaturas, siempre que se permita suficientemente el salto de protones localizado; un proceso que se vuelve más fácil a medida que aumenta la presión. [104] En consecuencia, se cree que el hielo XI tiene un punto triple con hielo hexagonal y agua gaseosa a (~72 K, ~0 Pa). El hielo I h que se ha transformado en hielo XI y luego nuevamente en hielo I h , al aumentar la temperatura, retiene algunos dominios ordenados por hidrógeno y se transforma más fácilmente nuevamente en hielo XI. [105] Un estudio de difracción de polvo de neutrones encontró que pueden existir pequeños dominios ordenados por hidrógeno hasta 111 K. [106]
Existen claras diferencias en los espectros Raman entre los hielos I h y XI, con el hielo XI mostrando picos mucho más fuertes en el estiramiento traslacional (~230 cm −1 ), libracional (~630 cm −1 ) y asimétrico en fase (~3200 cm −1 ) regiones. [107] [108]
Ice I c también tiene una forma ordenada por protones. Se predijo que la energía interna total del hielo XI c era similar a la del hielo XI h . [109]
Ice XI es ferroeléctrico , lo que significa que tiene una polarización intrínseca. Para calificar como ferroeléctrico, también debe exhibir una conmutación de polarización bajo un campo eléctrico, lo cual no se ha demostrado de manera concluyente pero se supone implícitamente que es posible. [110] El hielo cúbico también tiene una fase ferroeléctrica y en este caso las propiedades ferroeléctricas del hielo se han demostrado experimentalmente en películas delgadas monocapa. [111] En un experimento similar, se cultivaron capas ferroeléctricas de hielo hexagonal sobre una superficie de platino (111). El material tenía una polarización que tenía una longitud de desintegración de 30 monocapas, lo que sugiere que se pueden cultivar capas delgadas de hielo XI sobre sustratos a baja temperatura sin el uso de dopantes. [112] El hielo ferroeléctrico XI nanoconfinado unidimensional se creó en 2010. [113]
Aunque el hielo VI de la fase principal se descubrió en 1935, las correspondientes formas ordenadas por protones (hielo XV) no se observaron hasta 2009. En teoría, el orden de los protones en el hielo VI se predijo varias veces; por ejemplo, los cálculos de la teoría funcional de la densidad predijeron que la temperatura de transición de fase es de 108 K y que la estructura ordenada más estable es antiferroeléctrica en el grupo espacial Cc , mientras que se encontró que una estructura antiferroeléctrica P 2 1 2 1 2 1 tiene 4 K por molécula de agua mayor en energía. . [114]
El 14 de junio de 2009, Christoph Salzmann y sus colegas de la Universidad de Oxford informaron haber descubierto experimentalmente una fase ordenada del hielo VI, denominada hielo XV, y afirman que sus propiedades difieren significativamente de las predichas. En particular, el hielo XV es antiferroeléctrico en lugar de ferroeléctrico como se había predicho. [115] [116]
En detalle, el hielo XV tiene una densidad menor (mayor volumen de celda unitaria) que el hielo VI. Esto hace que la transición de desorden a orden del VI al XV sea mucho más favorecida a bajas presiones. De hecho, la calorimetría diferencial de barrido realizada por Shephard y Salzmann reveló que el recalentamiento del hielo XV dopado con HCl recuperado mediante enfriamiento rápido a presión ambiente incluso produce exotermias originadas por ordenamiento transitorio, es decir, se obtiene hielo XV más ordenado a presión ambiental. Siendo consistente con esto, la transición del hielo VI-XV es reversible a presión ambiental. [117] También se demostró que el dopaje con HCl es selectivamente eficaz en la producción de hielo XV, mientras que otros ácidos y bases (HF, LiOH, HClO 4 , HBr) no mejoran significativamente las formaciones de hielo XV. [118]
Basándose en la difracción de neutrones en polvo, se ha investigado en detalle la estructura cristalina del hielo XV. Algunos investigadores sugirieron que, en combinación con los cálculos de la teoría del funcional de la densidad, ninguna de las posibles configuraciones de orientación perfectamente ordenadas se ve energéticamente favorecida. Esto implica que existen varias configuraciones energéticamente cercanas que coexisten en el hielo XV. Propusieron 'el grupo espacial ortorrómbico Pmmn como un grupo espacial plausible para describir la estructura promediada tiempo-espacio del hielo XV. [119] Otros investigadores argumentaron que el modelo P -1 sigue siendo el mejor (con el segundo mejor candidato de P 2 1 ), mientras que el refinamiento de Rietveld utilizando el grupo espacial Pmmn solo funciona bien para muestras mal ordenadas. Los parámetros de la red, en particular byc , son buenos indicadores de la formación del hielo XV. Combinando cálculos de la teoría funcional de la densidad, construyeron con éxito un modelo completamente ordenado en P -1 y demostraron que los datos de difracción experimentales deben analizarse utilizando grupos espaciales que permitan el orden completo del hidrógeno, mientras que el modelo Pmmn solo acepta estructuras parcialmente ordenadas. [120] -->

En 2016 se anunció el descubrimiento de una nueva forma de hielo. [77] Caracterizada como un "hielo de agua poroso metaestable a temperaturas atmosféricas", esta nueva forma se descubrió tomando un hielo lleno y eliminando los componentes no acuosos, dejando atrás la estructura cristalina, similar a como ocurre con el hielo XVI, otra forma porosa de hielo, se sintetizó a partir de un hidrato de clatrato . [121] [122]
Para crear el hielo XVII, los investigadores primero produjeron hielo relleno en una fase estable llamada C 0 a partir de una mezcla de hidrógeno (H 2 ) y agua (H 2 O), utilizando temperaturas de 100 a 270 K (-173 a -3 °C). ; -280 a 26 °F) y presiones de 360 a 700 MPa (52 000 a 102 000 psi; 3600 a 6900 atm), y C 2 son todas fases sólidas estables de una mezcla de moléculas de H 2 y H 2 O, formadas a altas temperaturas. presiones. [121] [78] Aunque a veces se les conoce como hidratos de clatrato (o clatratos), carecen de la estructura en forma de jaula que generalmente se encuentra en los hidratos de clatrato y se los conoce más propiamente como hielos rellenos. [121] Luego, el hielo lleno se coloca al vacío y la temperatura se aumenta gradualmente hasta que el hidrógeno se libera de la estructura cristalina. [78] Si se mantiene en un rango de temperatura entre 110 y 120 K (-163 y -153 °C; -262 y -244 °F), después de aproximadamente dos horas, la estructura se habrá vaciado de cualquier molécula de hidrógeno detectable. [77] La forma resultante es metaestable a presión ambiente mientras está por debajo de 120 K (-153 °C; -244 °F), pero colapsa en hielo I h (hielo ordinario) cuando se eleva por encima de 130 K (-143 °C; -226 °F). [78] La estructura cristalina es de naturaleza hexagonal y los poros son canales helicoidales con un diámetro de aproximadamente 6,10 Å (6,10 × 10 −10 m; 2,40 × 10 −8 pulgadas). [77] [78]
En 2020 se informó que a partir del hielo XVII se puede formar hielo cúbico a base de agua pesada (D 2 O). [29] Esto se hizo calentando polvo de hielo XVII D 2 O específicamente preparado. [29] El resultado estuvo libre de deformidades estructurales en comparación con el hielo cúbico estándar, o hielo I sd . [29] Este descubrimiento se informó aproximadamente al mismo tiempo que otro grupo de investigación anunció que podían obtener hielo cúbico de D 2 O puro sintetizando primero hielo relleno en la fase C 2 y luego descomprimiéndolo. [123]
En 1988 se hicieron predicciones del llamado estado superiónico del agua. [124] En el agua superiónica, las moléculas de agua se rompen y los iones de oxígeno cristalizan en una red espaciada uniformemente mientras que los iones de hidrógeno flotan libremente dentro de la red de oxígeno. [125] Los iones de hidrógeno que se mueven libremente hacen que el agua superiónica sea casi tan conductora como los metales típicos, lo que la convierte en un conductor superiónico . [79] El hielo aparece de color negro. [126] [127] Se diferencia del agua iónica , que es un estado líquido hipotético caracterizado por una sopa desordenada de iones de hidrógeno y oxígeno.
La evidencia inicial provino de mediciones ópticas de agua calentada con láser en una celda de yunque de diamante , [128] y de mediciones ópticas de agua impactada por láseres extremadamente potentes. [126] La primera evidencia definitiva de la estructura cristalina de la red de oxígeno en agua superiónica provino de mediciones de rayos X en agua impactada con láser que se informaron en 2019. [79] En 2005, Laurence Fried dirigió un equipo en el Laboratorio Nacional Lawrence Livermore. para recrear las condiciones formativas del agua superiónica. Utilizando una técnica que implicaba romper moléculas de agua entre diamantes y sobrecalentarlas con láseres , observaron cambios de frecuencia que indicaban que se había producido una transición de fase . El equipo también creó modelos informáticos que indicaban que efectivamente habían creado agua superiónica. [129] En 2013, Hugh F. Wilson, Michael L. Wong y Burkhard Militzer de la Universidad de California en Berkeley publicaron un artículo que predice la estructura reticular cúbica centrada en las caras que emergería a presiones más altas. [130] Marius Millot y sus colegas encontraron evidencia experimental adicional en 2018 al inducir una alta presión sobre el agua entre los diamantes y luego golpear el agua con un pulso láser. [126] [127]
A partir de 2013 [actualizar], se teoriza que el hielo superiónico puede poseer dos estructuras cristalinas. A presiones superiores a 50 GPa (7.300.000 psi), se predice que el hielo superiónico adoptaría una estructura cúbica centrada en el cuerpo . Sin embargo, a presiones superiores a 100 GPa y temperaturas superiores a 2000 K, se predice que la estructura cambiaría a una red cúbica centrada en las caras más estable . [130]
En 2018, investigadores de LLNL exprimieron agua entre dos piezas de diamante con una presión de 2500 MPa (360 000 psi). El agua se comprimió hasta formar Ice VII, que es un 60 por ciento más denso que el agua normal. [131] El hielo comprimido fue luego transportado a la Universidad de Rochester , donde fue destruido por un pulso de luz láser. La reacción creó condiciones similares a las del interior de gigantes de hielo como Urano y Neptuno, calentando el hielo miles de grados bajo una presión un millón de veces mayor que la atmósfera terrestre en sólo 10 a 20 milmillonésimas de segundo. El experimento concluyó que la corriente en el agua conductora era transportada por iones en lugar de electrones y, por lo tanto, apuntaba a que el agua era superiónica. [131] Experimentos más recientes del mismo equipo del Laboratorio Nacional Lawrence Livermore utilizaron cristalografía de rayos X en gotas de agua impactadas con láser para determinar que los iones de oxígeno entran en una fase cúbica centrada en la cara, que se denominó hielo XVIII y se informó en la revista. Naturaleza en mayo de 2019. [79]
El primer informe sobre el hielo XIX fue publicado en 2018 por el grupo austriaco de Thomas Loerting. [80] Enfriaron hielo VI dopado con HCl a 77 K a diferentes presiones entre 1,0 y 1,8 GPa para recopilar termogramas de calorimetría diferencial de barrido (DSC), espectro dieléctrico , espectro Raman y patrones de difracción de rayos X. En las señales DSC, hubo una característica endotérmica a aproximadamente 110 K además de la endotermia correspondiente a la transición del hielo XV-VI. Además, los espectros Raman, las propiedades dieléctricas y la relación de los parámetros de la red diferían de los del hielo XV. Basándose en estas observaciones, propusieron la existencia de una segunda fase del hielo VI ordenada por hidrógeno, y la denominaron hielo beta-XV.
En 2019, Alexander Rosu-Finsen y Christoph Salzman argumentaron que no era necesario considerar que se trataba de una nueva fase del hielo y propusieron un escenario de estado "vidrio profundo". [132] Según sus datos de DSC, el tamaño de la característica endotérmica depende no solo de la presión de recuperación de enfriamiento sino también de la velocidad de calentamiento y la duración del recocido a 93 K. También recolectaron perfiles de difracción de neutrones de cloruro de deuterio dopado con cloruro de deuterio recuperado por enfriamiento. , D 2 O hielo VI/XV preparado a diferentes presiones de 1,0, 1,4 y 1,8 GPa, para demostrar que no hubo diferencias significativas entre ellas. Concluyeron que la endotermia de baja temperatura se originaba a partir de características cinéticas relacionadas con las transiciones vítreas de estados vítreos profundos del hielo desordenado VI.
Distinguir entre los dos escenarios (nueva fase ordenada por hidrógeno versus hielo desordenado VI) se convirtió en una cuestión abierta y el debate entre los dos grupos ha continuado. Thöny et al. (Grupo de Loerting) [133] recopiló otra serie de espectros Raman de hielo beta-XV e informó que (i) el hielo XV preparado según el protocolo informado anteriormente contiene dominios tanto de hielo XV como de hielo beta-XV; (ii) al calentar, los espectros Raman del hielo beta-XV mostraron una pérdida del orden H. Por el contrario, el grupo de Salzmann volvió a defender la plausibilidad de un escenario de "estado vítreo profundo" basado en experimentos de difracción de neutrones y dispersión inelástica de neutrones. [134] Según sus resultados experimentales, el hielo VI y el hielo vítreo profundo VI comparten características muy similares basadas en experimentos de dispersión elástica (difracción) y dispersión inelástica, y son diferentes de las propiedades del hielo XV.
En 2021, tres grupos informaron individualmente más evidencia cristalográfica de una nueva fase (hielo XIX): Yamane et al. (Grupo de Hiroyuki Kagi y Kazuki Komatsu de Japón), Gasser et al. (grupo de Loerting) y el grupo de Salzmann. Yamane et al. [82] recopilaron perfiles de difracción de neutrones in situ ( es decir, bajo alta presión) y encontraron nuevas características de Bragg completamente diferentes tanto del hielo VI como del hielo XV. Realizaron el refinamiento de Rietveld de los perfiles basados en la supercélula de hielo XV y propusieron algunos candidatos destacados para el grupo espacial de hielo XIX: P-4, Pca21, Pcc2, P21/a y P21/c. También midieron los espectros dieléctricos in situ y determinaron los límites de fase de los hielos VI/XV/XIX. Descubrieron que el signo de la pendiente del límite pasa de positivo a negativo a 1,6 GPa, lo que indica la existencia de dos fases diferentes según la relación Clausius-Clapeyron .
Gasser y cols. [135] también recopilaron difractogramas de neutrones en polvo de los hielos VI, XV y XIX recuperados mediante enfriamiento rápido y encontraron características cristalográficas similares a las reportadas por Yamane et al., concluyendo que P-4 y Pcc2 son los posibles candidatos a grupos espaciales. Tanto los resultados de Yamane et al. como los de Gasser et al. sugirieron una estructura parcialmente ordenada por hidrógeno. Gasser y cols. también encontró un efecto isotópico usando DSC; la endotermia a baja temperatura para el hielo XIX D 2 O dopado con DCl fue significativamente menor que la del hielo XIX dopado con H 2 O dopado con HCl, y ese dopado de 0,5% de H 2 O en D 2 O es suficiente para la transición de orden.
Varios meses después, Salzmann et al. publicó un artículo basado en experimentos de difracción de neutrones en polvo in situ del hielo XIX. [136] A diferencia de sus informes anteriores, aceptaron la idea de la nueva fase (hielo XIX) ya que observaron características similares a los dos informes anteriores. Sin embargo, refinaron sus perfiles de difracción basándose en un modelo estructural desordenado (Pbcn) y argumentaron que las nuevas reflexiones de Bragg pueden explicarse por distorsiones del hielo VI, por lo que el hielo XIX todavía puede considerarse como un estado vítreo profundo del hielo VI. La estructura cristalina del hielo XIX, incluido el orden/desorden del hidrógeno, todavía está en debate en 2022.


Prácticamente todo el hielo de la biosfera es hielo I h (pronunciado: hielo uno h , también conocido como fase de hielo uno ). El hielo I h exhibe muchas propiedades peculiares que son relevantes para la existencia de vida y la regulación del clima global . [137] Por ejemplo, su densidad es menor que la del agua líquida . Esto se atribuye a la presencia de enlaces de hidrógeno que hacen que los átomos se acerquen en la fase líquida. [138] Debido a esto, el hielo I h flota en el agua, lo cual es muy inusual en comparación con otros materiales. La fase sólida de los materiales suele estar más compacta y ordenada y tiene una mayor densidad que la fase líquida. Cuando los lagos se congelan, lo hacen sólo en la superficie, mientras que el fondo del lago permanece cerca de los 4 °C (277 K; 39 °F) porque el agua es más densa a esta temperatura. Este comportamiento anómalo del agua y el hielo es lo que permite a los peces sobrevivir a los duros inviernos. La densidad del hielo I h aumenta cuando se enfría, hasta aproximadamente -211 °C (62 K; -348 °F); por debajo de esa temperatura, el hielo se expande nuevamente ( expansión térmica negativa ). [5] [6]
Además del hielo I h , ocasionalmente puede presentarse una pequeña cantidad de hielo I c en las nubes de la atmósfera superior. [139] Se cree que es responsable de la observación del halo de Scheiner , un raro anillo que se produce cerca de los 28 grados del Sol o la Luna. [140] Sin embargo, más tarde se demostró que muchas muestras atmosféricas que se describieron anteriormente como hielo cúbico apilaban hielo desordenado con simetría trigonal, [141] [142] [143] y se ha denominado la ″ fase de hielo más facetada en un sentido literal. y un sentido más general”. [144] Las primeras muestras verdaderas de hielo cúbico no se informaron hasta 2020. [30] [123]
ASW de baja densidad (LDA), también conocida como agua vidriosa hiperapagada, puede ser responsable de las nubes noctilucentes en la Tierra y generalmente se forma por deposición de vapor de agua en condiciones de frío o vacío. Las nubes de hielo se forman en y debajo de la mesopausia de alta latitud de la Tierra (~90 km), donde se ha observado que las temperaturas caen por debajo de los 100 K. [145] Se ha sugerido que la nucleación homogénea de partículas de hielo da como resultado hielo amorfo de baja densidad. [146] Es probable que el hielo amorfo esté confinado a las partes más frías de las nubes y se cree que la acumulación de hielo desordenado I domina otras partes de estas nubes mesosféricas polares . [147]
En 2018 se identificó hielo VII entre las inclusiones encontradas en diamantes naturales . [148] Debido a esta demostración de que el hielo VII existe en la naturaleza, la Asociación Mineralógica Internacional clasificó debidamente el hielo VII como un mineral distinto . [149] El hielo VII se formó presumiblemente cuando el agua atrapada dentro de los diamantes retuvo la alta presión del manto profundo debido a la resistencia y rigidez de la red de diamantes, pero se enfrió a temperaturas superficiales, produciendo el ambiente requerido de alta presión sin alta temperatura. [150]
Se cree que el hielo XI tiene una conformación más estable que el hielo I h , por lo que puede formarse en la Tierra. Sin embargo, la transformación es muy lenta. Según un informe, en condiciones antárticas se estima que tardará al menos 100.000 años en formarse sin la ayuda de catalizadores. [ cita necesaria ] Se buscó y encontró hielo XI en el hielo antártico que tenía unos 100 años de antigüedad en 1998. [151] Sin embargo, un estudio adicional realizado en 2004 no pudo reproducir este hallazgo, después de estudiar el hielo antártico que tenía alrededor de 3000 años. . [152] El estudio antártico de 1998 también afirmó que la temperatura de transformación (hielo XI => hielo I h ) es −36 °C (237 K), que es mucho más alta que la temperatura del punto triple esperado mencionado anteriormente (72 K, ~0 Pa). Ice XI también se encontró en experimentos que utilizaron agua pura a muy baja temperatura (~10 K) y baja presión, condiciones que se cree que están presentes en la atmósfera superior. [153] Recientemente, se descubrió que se forman pequeños dominios de hielo XI en agua pura; su transición de fase de nuevo a hielo I h se produjo a 72 K en condiciones de presión hidrostática de hasta 70 MPa. [154]
El hielo amorfo se utiliza en algunos experimentos científicos, especialmente en microscopía crioelectrónica de biomoléculas. [155] Las moléculas individuales se pueden conservar para obtener imágenes en un estado cercano al que se encuentran en agua líquida.
El hielo XVII puede adsorber y liberar repetidamente moléculas de hidrógeno sin degradar su estructura. [77] La cantidad total de hidrógeno que el hielo XVII puede adsorber depende de la cantidad de presión aplicada, pero las moléculas de hidrógeno pueden ser adsorbidas por el hielo XVII incluso a presiones tan bajas como unos pocos milibares [a] si la temperatura es inferior a 40 K ( −233,2 °C; −387,7 °F). [77] Las moléculas de hidrógeno adsorbidas pueden luego liberarse o desorberse mediante la aplicación de calor. [156] Esta era una propiedad inesperada del hielo XVII y podría permitir su uso para el almacenamiento de hidrógeno , un tema que se menciona a menudo en la tecnología ambiental . [156]
Además de almacenar hidrógeno mediante compresión o licuación , también se puede almacenar dentro de una sustancia sólida, ya sea mediante un proceso químico reversible ( quimisorción ) o haciendo que las moléculas de hidrógeno se unan a la sustancia mediante la fuerza de van der Waals ( fisisorción ). Este último proceso puede ocurrir dentro del hielo XVII. [156] En la fisisorción, no hay reacción química y el enlace químico entre los dos átomos dentro de una molécula de hidrógeno permanece intacto. Debido a esto, el número de ciclos de adsorción-desorción que puede soportar el hielo XVII es "teóricamente infinito". [156]
Una ventaja significativa de utilizar hielo XVII como medio de almacenamiento de hidrógeno es el bajo costo de los dos únicos productos químicos involucrados: hidrógeno y agua. [156] Además, el hielo XVII ha demostrado la capacidad de almacenar hidrógeno en una proporción molar de H 2 a H 2 O superior al 40%, superior a la proporción máxima teórica para los hidratos de clatrato sII , otro posible medio de almacenamiento. [77] Sin embargo, si se utiliza hielo XVII como medio de almacenamiento, debe mantenerse a una temperatura de 130 K (-143 °C; -226 °F) o corre el riesgo de desestabilizarse. [156]
En el espacio exterior, el hielo cristalino hexagonal (la forma predominante que se encuentra en la Tierra) es extremadamente raro. Los ejemplos conocidos suelen estar asociados con la acción volcánica. [157] En cambio , el agua en el medio interestelar está dominada por hielo amorfo, lo que la convierte probablemente en la forma más común de agua en el universo. [158] [34]
El hielo amorfo se puede separar del hielo cristalino basándose en su espectro infrarrojo cercano e infrarrojo. En longitudes de onda del infrarrojo cercano, las características de las líneas de absorción de agua de 1,65, 3,1 y 4,53 μm dependen de la temperatura del hielo y el orden de los cristales. [159] La fuerza máxima de la banda de 1,65 μm, así como la estructura de la banda de 3,1 μm, son particularmente útiles para identificar la cristalinidad del hielo de agua. [160] [161]
En longitudes de onda IR más largas, el hielo amorfo y cristalino tienen bandas de absorción características diferentes a 44 y 62 μm, ya que el hielo cristalino tiene una absorción significativa a 62 μm, mientras que el hielo amorfo no. [162] Además, estas bandas se pueden utilizar como indicador de temperatura a temperaturas muy bajas donde otros indicadores (como las bandas de 3,1 y 12 μm) fallan. [163] Esto es útil para estudiar el hielo en el medio interestelar y los discos circunestelares. Sin embargo, observar estas características es difícil porque la atmósfera es opaca en estas longitudes de onda, lo que requiere el uso de observatorios infrarrojos espaciales.
En general, el hielo amorfo se puede formar por debajo de ~130 K. [164] A esta temperatura, las moléculas de agua son incapaces de formar la estructura cristalina que se encuentra comúnmente en la Tierra. También se puede formar hielo amorfo en la región más fría de la atmósfera terrestre, la mesosfera polar de verano, donde existen nubes noctilucentes . [165] Estas bajas temperaturas se logran fácilmente en entornos astrofísicos como nubes moleculares, discos circunestelares y las superficies de objetos en el Sistema Solar exterior. En el laboratorio, el hielo amorfo se transforma en hielo cristalino si se calienta por encima de 130 K, aunque la temperatura exacta de esta conversión depende del medio ambiente y de las condiciones de crecimiento del hielo. [166] La reacción es irreversible y exotérmica, liberando 1,26–1,6 kJ/mol. [166]
Un factor adicional para determinar la estructura del hielo de agua es la tasa de deposición. Incluso si hace suficiente frío como para formar hielo amorfo, se formará hielo cristalino si el flujo de vapor de agua sobre el sustrato es menor que un flujo crítico dependiente de la temperatura. [167] Es importante considerar este efecto en entornos astrofísicos donde el flujo de agua puede ser bajo. Por el contrario, el hielo amorfo se puede formar a temperaturas superiores a las esperadas si el flujo de agua es alto, como en los eventos de congelación repentina asociados con el criovulcanismo .
A temperaturas inferiores a 77 K, la irradiación de fotones ultravioleta, así como de electrones e iones de alta energía, pueden dañar la estructura del hielo cristalino, transformándolo en hielo amorfo. [168] [162] El hielo amorfo no parece verse afectado significativamente por la radiación a temperaturas inferiores a 110 K, aunque algunos experimentos sugieren que la radiación podría reducir la temperatura a la que el hielo amorfo comienza a cristalizar. [162]
Peter Jenniskens y David F. Blake demostraron en 1994 que también se crea una forma de hielo amorfo de alta densidad durante la deposición de vapor de agua en superficies de baja temperatura (< 30 K), como los granos interestelares. Las moléculas de agua no se alinean completamente para crear la estructura de jaula abierta del hielo amorfo de baja densidad. Muchas moléculas de agua terminan en posiciones intersticiales. Cuando se calienta por encima de 30 K, la estructura se realinea y se transforma en una forma de baja densidad. [35] [41]
Las nubes moleculares tienen temperaturas extremadamente bajas (~10 K), lo que las sitúa dentro del régimen del hielo amorfo. Se ha confirmado mediante observaciones la presencia de hielo amorfo en las nubes moleculares. [169] Cuando las nubes moleculares colapsan para formar estrellas, no se espera que la temperatura del disco circunestelar resultante supere los 120 K, lo que indica que la mayor parte del hielo debería permanecer en un estado amorfo. [167] Sin embargo, si la temperatura aumenta lo suficiente como para sublimar el hielo, entonces puede volver a condensarse en una forma cristalina ya que la tasa de flujo de agua es muy baja. Se espera que este sea el caso en el disco circunestelar de IRAS 09371+1212, donde se observaron firmas de hielo cristalizado a pesar de una baja temperatura de 30 a 70 K. [170]
Para la nebulosa solar primordial, existe mucha incertidumbre en cuanto a la cristalinidad del hielo de agua durante las fases del disco circunestelar y de formación de planetas. Si el hielo amorfo original sobrevivió al colapso de la nube molecular, entonces debería haberse conservado a distancias heliocéntricas más allá de la órbita de Saturno (~12 AU). [167]
La posibilidad de la presencia de hielo de agua amorfa en los cometas y la liberación de energía durante la transición de fase a un estado cristalino se propuso por primera vez como mecanismo para las explosiones de los cometas. [171] La evidencia de hielo amorfo en los cometas se encuentra en los altos niveles de actividad observados en los cometas de período largo, Centauro y de la familia Júpiter a distancias heliocéntricas más allá de ~6 AU. [172] Estos objetos son demasiado fríos para que la sublimación del hielo de agua, que acerca la actividad de los cometas al Sol, tenga mucho efecto. Los modelos termodinámicos muestran que las temperaturas de la superficie de esos cometas están cerca de la temperatura de transición del hielo amorfo/cristalino de ~130 K, lo que respalda esto como una fuente probable de actividad. [173] La cristalización descontrolada del hielo amorfo puede producir la energía necesaria para impulsar estallidos como los observados en el cometa centauro 29P/Schwassmann-Wachmann 1. [174] [175]
Con temperaturas de equilibrio de radiación de 40 a 50 K, [176] se espera que los objetos en el Cinturón de Kuiper tengan hielo de agua amorfa. Si bien se ha observado hielo de agua en varios objetos, [177] [178] la extrema debilidad de estos objetos dificulta determinar la estructura de los hielos. Se observaron firmas de hielo de agua cristalina en 50000 Quaoar , quizás debido a eventos de resurgimiento como impactos o criovulcanismo. [179]
El espectrómetro de mapeo de infrarrojo cercano (NIMS) de la nave espacial Galileo de la NASA cartografió espectroscópicamente la superficie del hielo de los satélites jovianos Europa , Ganímedes y Calisto . Las temperaturas de estas lunas oscilan entre 90 y 160 K, [180] lo suficientemente cálidas como para que se espere que el hielo amorfo cristalice en escalas de tiempo relativamente cortas. Sin embargo, se descubrió que Europa tiene hielo principalmente amorfo, Ganímedes tiene hielo tanto amorfo como cristalino, y Calisto es principalmente cristalino. [181] Se cree que esto es el resultado de fuerzas en competencia: la cristalización térmica del hielo amorfo versus la conversión de hielo cristalino en amorfo por el flujo de partículas cargadas de Júpiter. Más cerca de Júpiter que las otras tres lunas, Europa recibe el mayor nivel de radiación y, por tanto, debido a la irradiación tiene el hielo más amorfo. Calisto es la más alejada de Júpiter, recibe el menor flujo de radiación y por tanto mantiene su hielo cristalino. Ganímedes, que se encuentra entre los dos, exhibe hielo amorfo en latitudes altas y hielo cristalino en latitudes más bajas. Se cree que esto es el resultado del campo magnético intrínseco de la luna, que canalizaría las partículas cargadas a latitudes más altas y protegería las latitudes más bajas de la irradiación. [181] El interior de Ganímedes probablemente incluye un océano de agua líquida con decenas a cientos de kilómetros de hielo V en su base. [182]
La superficie del hielo de Encelado , la luna de Saturno, fue cartografiada por el espectrómetro de mapeo visual e infrarrojo (VIMS) de la sonda espacial Cassini de NASA/ESA/ASI. La sonda encontró hielo tanto cristalino como amorfo, con un mayor grado de cristalinidad en las grietas de la " raya de tigre " en la superficie y más hielo amorfo entre estas regiones. [159] El hielo cristalino cerca de las rayas del tigre podría explicarse por temperaturas más altas causadas por la actividad geológica que es la causa sospechosa de las grietas. El hielo amorfo podría explicarse por la congelación repentina debida al criovulcanismo, la rápida condensación de moléculas de los géiseres de agua o la irradiación de partículas de alta energía de Saturno. [159] De manera similar, se cree que una de las capas internas de Titán contiene hielo VI. [183]
En Europa puede haber hielo amorfo de densidad media, ya que se espera que allí también se den las condiciones experimentales de su formación. Es posible que la propiedad única del hielo MDA de liberar una gran cantidad de energía térmica después de liberarse de la compresión pueda ser responsable de los "temblores de hielo" dentro de las gruesas capas de hielo. [21]
Porque, en teoría, el hielo XI puede formarse a bajas presiones y temperaturas entre 50 y 70 K, temperaturas presentes en entornos astrofísicos del sistema solar exterior y dentro de los cráteres polares permanentemente sombreados de la Luna y Mercurio. El hielo XI se forma más fácilmente alrededor de los 70 K; paradójicamente, tarda más en formarse a temperaturas más bajas. Extrapolando a partir de mediciones experimentales, se estima que tarda ~50 años en formarse a 70 K y ~300 millones de años a 50 K. [184] Se teoriza que está presente en lugares como las atmósferas superiores de Urano y Neptuno [106] y sobre Plutón y Caronte . [184]
El hielo VII puede comprender el fondo del océano de Europa , así como planetas extrasolares (como Awohali y Enaiposha ) que están compuestos en gran parte de agua. [185] [186]
También podrían existir pequeños dominios de hielo XI en las atmósferas de Júpiter y Saturno. [106] El hecho de que pequeños dominios de hielo XI puedan existir a temperaturas de hasta 111 K hace que algunos científicos especulen que puede ser bastante común en el espacio interestelar, con pequeñas "semillas de nucleación" que se extienden por el espacio y convierten el hielo regular, de manera muy similar a la el legendario hielo nueve mencionado en Cat's Cradle de Vonnegut . [106] [187] Las posibles funciones del hielo XI en el espacio interestelar [184] [188] y la formación de planetas [189] han sido objeto de varios artículos de investigación. Hasta que se realice una confirmación observacional del hielo XI en el espacio ultraterrestre, la presencia de hielo XI en el espacio sigue siendo controvertida debido a las críticas antes mencionadas planteadas por Iitaka. [190] Los espectros de absorción infrarroja del hielo XI se estudiaron en 2009 como preparación para las búsquedas de hielo XI en el espacio. [191]
Se teoriza que los planetas gigantes de hielo Urano y Neptuno contienen una capa de agua superiónica. [192] [129] [193] [130] Los métodos de aprendizaje automático y energía libre predicen que las fases superiónicas compactas serán estables en un amplio rango de temperatura y presión, y que una fase superiónica cúbica centrada en el cuerpo será cinéticamente favorecida, pero estable en una pequeña ventana de parámetros. [194] Por otro lado, también hay estudios que sugieren que otros elementos presentes en el interior de estos planetas, particularmente el carbono , pueden impedir la formación de agua superiónica. [195] [196]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite web}}: Mantenimiento CS1: bot: estado de la URL original desconocido ( enlace )[ fuente autoeditada? ]{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite web}}: Mantenimiento CS1: bot: estado de la URL original desconocido ( enlace )[ fuente autoeditada? ]{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ) {{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )