

La neuraminidasa viral es un tipo de neuraminidasa que se encuentra en la superficie de los virus de la influenza y que permite que el virus se libere de la célula huésped. Las neuraminidasas son enzimas que escinden grupos de ácido siálico (también llamado ácido neuramínico ) de las glicoproteínas . La neuraminidasa viral fue descubierta por Alfred Gottschalk en el Instituto Walter y Eliza Hall en 1957. [3] Los inhibidores de la neuraminidasa son agentes antivirales que inhiben la actividad de la neuraminidasa viral de la influenza y son de gran importancia en el control de la influenza. [4]
Las neuraminidasas virales son miembros de la familia de las glucósidos hidrolasas 34 CAZY GH_34 que comprende enzimas con una sola actividad conocida; sialidasa o neuraminidasa EC 3.2.1.18. Las neuraminidasas escinden los residuos terminales de ácido siálico de las cadenas de carbohidratos en las glicoproteínas. El ácido siálico es un azúcar cargado negativamente asociado con las porciones proteicas y lipídicas de las lipoproteínas . [ cita necesaria ]
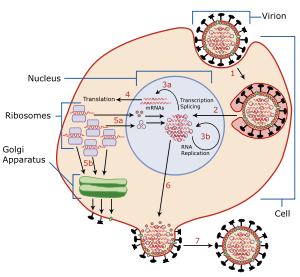
Para infectar una célula huésped, el virus de la influenza se adhiere a la superficie celular exterior mediante hemaglutinina , una molécula que se encuentra en la superficie del virus y que se une a grupos de ácido siálico. Los ácidos siálicos se encuentran en varias glicoproteínas de la superficie de la célula huésped. Luego, el virus pasa de un grupo de ácido siálico a otro hasta que encuentra el receptor de superficie celular adecuado (cuya identidad sigue siendo desconocida). [5] La neuraminadasa permite este movimiento escindiendo los grupos de ácido siálico a los que estaba unida la hemaglutinina. Una vez que el virus ha entrado en la célula y se ha replicado, nuevas partículas virales brotan de la membrana de la célula huésped. La hemaglutinina de las nuevas partículas virales permanece unida a grupos de glicoproteínas de ácido siálico en la superficie celular externa y en la superficie de otras partículas virales; la neuraminadasa escinde estos grupos y, por lo tanto, permite la liberación de partículas virales [6] y previene la autoagregación. [5] La neuraminadasa también facilita el movimiento de partículas de virus en presencia de moco rico en ácido silícico. [5]
Una sola proteína hemaglutinina-neuraminidasa puede combinar las funciones de neuraminidasa y hemaglutinina , como en el virus de las paperas y el virus de la parainfluenza humana . [ cita necesaria ]
La enzima ayuda a que los virus se liberen después de brotar de la membrana plasmática de una célula huésped. Las membranas del virus de la influenza contienen dos glicoproteínas : hemaglutinina y neuraminidasa. Si bien la hemaglutinina en la superficie del virión es necesaria para la infección, su presencia inhibe la liberación de la partícula después de la gemación. La neuraminidasa viral escinde los residuos terminales de ácido siálico de las estructuras de glicano en la superficie de la célula infectada. Esto promueve la liberación de virus descendientes y la propagación del virus desde la célula huésped a las células circundantes no infectadas. La neuraminidasa también escinde los residuos de ácido siálico de las proteínas virales, evitando la agregación de virus. [ cita médica necesaria ]
La neuraminidasa ha sido objeto de programas de diseño de inhibidores enzimáticos basados en estructuras que han dado lugar a la producción de dos fármacos, zanamivir (Relenza) y oseltamivir (Tamiflu). La administración de inhibidores de la neuraminidasa es un tratamiento que limita la gravedad y la propagación de las infecciones virales. Los inhibidores de la neuraminidasa son útiles para combatir la infección por gripe : zanamivir , administrado por inhalación; oseltamivir , administrado por vía oral; y en investigación se encuentra el peramivir administrado por vía parenteral, es decir mediante inyección intravenosa o intramuscular. [ cita necesaria ]
El 27 de febrero de 2005, se documentó que una niña vietnamita de 14 años portaba una cepa del virus de la influenza H5N1 resistente al medicamento oseltamivir . El medicamento se utiliza para tratar a pacientes que han contraído gripe. Sin embargo, se descubrió que la niña vietnamita que había recibido una dosis profiláctica (75 mg una vez al día) no respondía al medicamento. Ante los crecientes temores de una pandemia mundial de gripe aviar, los científicos comenzaron a buscar una causa de resistencia al medicamento Tamiflu . Se determinó que la causa era una sustitución de histidina por tirosina ( aminoácido ) en la posición 274 de su proteína neuraminidasa. [ cita necesaria ]
Como las cepas de influenza mutan continuamente, es esencial que los científicos determinen rápida y eficientemente el subtipo correcto de neuraminidasa responsable de la resistencia a los medicamentos para desarrollar medicamentos que combatan cepas específicas de influenza. [ cita necesaria ]
Una nueva clase de inhibidores de la neuraminidasa que se unen covalentemente a la enzima ha mostrado actividad contra virus resistentes a los medicamentos in vitro . [7] [8]
En circunstancias ideales, la neuraminidasa (NA) del virus de la influenza debería actuar sobre el mismo tipo de receptor al que se une la hemaglutinina (HA) del virus, un fenómeno que no siempre ocurre. No está del todo claro cómo logra funcionar el virus cuando no existe una coincidencia estrecha entre las especificidades de NA y HA. [ cita necesaria ]
Las enzimas neuraminidasas pueden tener actividad endo o exoglicosidasa y se clasifican como EC 3.2.1.29 (endoneuraminidasa) [9] y EC 3.2.1.18 (exoneuraminidasas). [10] En general, los residuos de ácido siálico de los mamíferos se encuentran en posiciones terminales (extremo no reductor) en los glicanos complejos, por lo que las neuraminidasas virales, que son enzimas exoglicosidasas , utilizan estos residuos terminales como sustratos. [ cita necesaria ]