En química orgánica , los enoles son un tipo de grupo funcional o intermediario en química orgánica que contiene un grupo con la fórmula C=C(OH) (R = muchos sustituyentes). El término enol es una abreviatura de alquenol , un acrónimo derivado de "-eno"/"alqueno" y el "-ol". Se conocen muchos tipos de enoles. [1]
La tautomería ceto-enólica se refiere a un equilibrio químico entre una forma "ceto" (un carbonilo , llamado así por el caso común de la cetona ) y un enol. La interconversión de las dos formas implica la transferencia de un átomo de hidrógeno alfa y la reorganización de los electrones de enlace . Las formas ceto y enólica son tautómeros entre sí. [2]
Los ésteres orgánicos , las cetonas y los aldehídos con un hidrógeno α ( enlace C−H adyacente al grupo carbonilo ) suelen formar enoles. La reacción implica la migración de un protón ( H ) del carbono al oxígeno: [1]
En el caso de las cetonas, la conversión se denomina tautomería ceto-enólica, aunque este nombre suele aplicarse de forma más general a todas las tautomerizaciones de este tipo. Normalmente, la constante de equilibrio es tan pequeña que el enol es indetectable espectroscópicamente.
En algunos compuestos con dos (o más) carbonilos, la forma enólica se vuelve dominante. El comportamiento de la 2,4-pentanodiona ilustra este efecto: [3]
Los enoles son derivados del alcohol vinílico , con una conectividad C=C−OH . La desprotonación de carbonilos orgánicos da lugar al anión enolato , que es un nucleófilo fuerte . Un ejemplo clásico de favorecimiento de la forma ceto se puede ver en el equilibrio entre el alcohol vinílico y el acetaldehído (K = [enol]/[ceto] ≈ 3 × 10−7 ). En las 1,3-dicetonas , como la acetilacetona (2,4-pentanodiona), se favorece la forma enólica.
La conversión catalizada por ácido de un enol a la forma ceto se produce por transferencia de protones del O al carbono. El proceso no ocurre intramolecularmente, sino que requiere la participación de un solvente u otros mediadores.
Si R 1 y R 2 (observe la ecuación en la parte superior de la página) son sustituyentes diferentes, se forma un nuevo estereocentro en la posición alfa cuando un enol se convierte en su forma ceto. Dependiendo de la naturaleza de los tres grupos R, los productos resultantes en esta situación serían diastereómeros o enantiómeros . [ cita requerida ]
Los enedoles son alquenos con un grupo hidroxilo en cada carbono del doble enlace C=C. Normalmente, estos compuestos son componentes desfavorecidos en equilibrio con las aciloínas . Un caso especial es el catecol , donde la subunidad C=C es parte de un anillo aromático. Sin embargo, en otros casos, los enedoles se estabilizan mediante grupos carbonilo flanqueantes. Estos enedoles estabilizados se denominan reductonas . Estas especies son importantes en la glicoquímica, por ejemplo, la transformación de Lobry de Bruyn-van Ekenstein . [5]

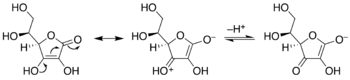
La ribulosa-1,5-bisfosfato es un sustrato clave en el ciclo de Calvin de la fotosíntesis . En el ciclo de Calvin, la ribulosa se equilibra con el enodiol, que luego se une al dióxido de carbono . El mismo enodiol también es susceptible al ataque del oxígeno (O 2 ) en el proceso (indeseable) llamado fotorrespiración .
Los fenoles representan un tipo de enol. En el caso de algunos fenoles y compuestos relacionados, el tautómero ceto desempeña un papel importante. Muchas de las reacciones del resorcinol involucran al tautómero ceto, por ejemplo. El naftaleno-1,4-diol existe en equilibrio observable con la dicetona tetrahidronaftaleno-1,4-diona. [6]
La tautomería ceto-enólica es importante en varias áreas de la bioquímica . [ cita requerida ]
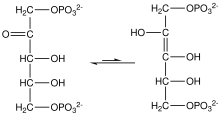
El alto potencial de transferencia de fosfato del fosfoenolpiruvato resulta del hecho de que el compuesto fosforilado queda "atrapado" en la forma enol, menos favorable termodinámicamente, mientras que después de la desfosforilación puede asumir la forma ceto. [ cita requerida ]
La enzima enolasa cataliza la deshidratación del ácido 2-fosfoglicérico al éster de fosfato de enol. El metabolismo de PEP a ácido pirúvico por la piruvato quinasa (PK) genera trifosfato de adenosina (ATP) a través de la fosforilación a nivel de sustrato . [7]
El extremo del doble enlace en los enoles es nucleofílico . Sus reacciones con compuestos orgánicos electrofílicos son importantes tanto en bioquímica como en química orgánica sintética . En el primer caso, la fijación del dióxido de carbono implica la adición de CO2 a un enol. [ cita requerida ]
La desprotonación de cetonas, aldehídos y ésteres enolizables produce enolatos . [8] [9] Los enolatos pueden quedar atrapados mediante la adición de electrófilos en el oxígeno. La sililación produce éter enólico de sililo . [10] La acilación produce ésteres como el acetato de vinilo . [11]
En general, los enoles son menos estables que sus equivalentes cetogénicos debido a la preferencia del doble enlace C=O sobre el doble enlace C=C. Sin embargo, los enoles pueden estabilizarse cinética o termodinámicamente. [ cita requerida ]
Algunos enoles están suficientemente estabilizados cinéticamente como para que puedan caracterizarse. [ cita requerida ]
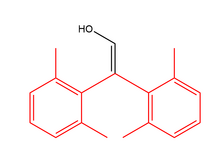
La deslocalización puede estabilizar el tautómero enólico. Por lo tanto, los enoles muy estables son fenoles . [13] Otro factor estabilizador en los 1,3-dicarbonilos es el enlace de hidrógeno intramolecular. [14] Ambos factores influyen en el equilibrio enol-diona en acetilacetona.