Los inhibidores no nucleósidos de la transcriptasa inversa (NNRTI) son fármacos antirretrovirales que se utilizan en el tratamiento del virus de inmunodeficiencia humana ( VIH ). Los NNRTI inhiben la transcriptasa inversa (RT), una enzima que controla la replicación del material genético del VIH. La RT es uno de los objetivos más populares en el campo del desarrollo de fármacos antirretrovirales. [1]
El descubrimiento y desarrollo de los INNTI comenzó a fines de la década de 1980 [2] y a fines de 2009 las autoridades regulatorias habían aprobado cuatro INNTI y varios más estaban en desarrollo clínico . La resistencia a los medicamentos se desarrolla rápidamente si los INNTI se administran como monoterapia y, por lo tanto, los INNTI siempre se administran como parte de una terapia combinada , la terapia antirretroviral altamente activa ( HAART ). [3]
El síndrome de inmunodeficiencia adquirida ( SIDA ) es una de las principales causas de muerte en el mundo. [1] Fue identificado como enfermedad en 1981. Dos años más tarde se describió el agente etiológico del SIDA, el VIH . [4] El VIH es un retrovirus y tiene dos serotipos principales , VIH-1 y VIH-2. La pandemia involucra principalmente al VIH-1, mientras que el VIH-2 tiene una tasa de morbilidad más baja y se limita principalmente a África occidental. [5]
En el año 2009, más de 40 millones de personas en todo el mundo se infectaron con el VIH y el número sigue creciendo. [6] La gran mayoría de las personas infectadas viven en países en desarrollo . [7]
Los medicamentos contra el VIH no curan la infección, pero el tratamiento tiene como objetivo mejorar la calidad de vida de los pacientes y reducir la mortalidad . [8]
En 2009 se comercializaron 25 fármacos antirretrovirales para el tratamiento de la infección por VIH. Los fármacos pertenecen a seis clases diferentes que actúan sobre diferentes dianas. La diana más popular en el campo del desarrollo de fármacos antirretrovirales es la enzima transcriptasa inversa (RT) del VIH-1. [1] Hay dos clases de fármacos que actúan sobre la enzima RT del VIH-1, los inhibidores de la transcriptasa inversa análogos de nucleósidos / nucleótidos (NRTI/NtRTI) y los inhibidores de la transcriptasa inversa no análogos de nucleósidos (NNRTI). Los fármacos de estas clases son componentes importantes de la terapia combinada contra el VIH denominada terapia antirretroviral de gran actividad, más conocida como HAART. [3]
En 1987, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el primer fármaco para el tratamiento de la infección por VIH . Se trataba del inhibidor de la transcriptasa inversa (INTR) llamado zidovudina . A finales de los años 1980, durante el desarrollo de los INTR, comenzó el campo del descubrimiento de los INNTR. El desarrollo de los INNTR mejoró rápidamente en los años 1990 y pronto se convirtieron en la tercera clase de fármacos antirretrovirales, después de los inhibidores de la proteasa . [7] [8]
Los INNTI son específicos del VIH-1 y no tienen actividad contra el VIH-2 y otros retrovirus . El primer INNTI, la nevirapina, fue descubierto por investigadores de Boehringer Ingelheim y aprobado por la FDA en 1996. En los dos años siguientes, la FDA aprobó otros dos INNTI: la delavirdina en 1997 y el efavirenz en 1998. [4] Estos tres fármacos son los denominados INNTI de primera generación. La necesidad de INNTI con un mejor perfil de resistencia condujo al desarrollo de la siguiente generación de INNTI. Los investigadores de la Fundación Janssens y Tibotec descubrieron el primer fármaco de esta clase, la etravirina , que fue aprobado por la FDA en 2008. El segundo fármaco de esta clase, la rilpivirina , también fue descubierto por Tibotec y fue aprobado por la FDA en 2011. Además de estos cuatro INNTI, hay varios otros en desarrollo clínico. [7]
La transcriptasa inversa (RT) es una enzima que controla la replicación del material genético del VIH y otros retrovirus. [1] La enzima tiene dos funciones enzimáticas. En primer lugar, actúa como una polimerasa donde transcribe el genoma de ARN monocatenario en ADN monocatenario y posteriormente construye una cadena complementaria de ADN. Esto proporciona una doble hélice de ADN que se puede integrar en el cromosoma de la célula huésped . [7] En segundo lugar, tiene actividad de ribonucleasa H (RNasa H) ya que degrada la cadena de ARN del intermediario ARN-ADN que se forma durante la síntesis de ADN viral. [9]
La RT del VIH-1 es un heterodímero asimétrico de 1000 aminoácidos compuesto por las subunidades p66 (560 aminoácidos) y p51 (440 aminoácidos). [1] La subunidad p66 tiene dos dominios, una polimerasa y una ribonucleasa H. El dominio de la polimerasa contiene cuatro subdominios , que se han denominado "dedos", "palma", "pulgar" y "conexión" y a menudo se compara con una mano derecha. [7] El papel de la subunidad p66 es llevar a cabo la actividad de la RT, mientras que contiene los sitios activos de la enzima. Se cree que p51 desempeña principalmente un papel estructural. [9]
A pesar de la diversidad química de los NNRTI, todos se unen al mismo sitio en el RT. La unión ocurre alostéricamente en un bolsillo hidrofóbico ubicado aproximadamente a 10 Å del sitio catalítico en el dominio de palma del sitio de la subunidad p66 de la enzima. [1] [7] El bolsillo de unión de NNRTI (NNIBP) contiene cinco aminoácidos aromáticos (Tyr-181, Tyr-188, Phe-227 y Trp-229), seis hidrófobos (Pro-59, Leu-100, Val-106, Val-179, Leu-234 y Pro-236) y cinco hidrófilos (Lys-101, Lys-103, Ser-105, Asp-132 y Glu-224) que pertenecen a la subunidad p66 y dos aminoácidos adicionales (Ile-135 y Glu-138) que pertenecen a la subunidad p51. [7] Cada NNRTI interactúa con diferentes residuos de aminoácidos en el NNIBP. [10]
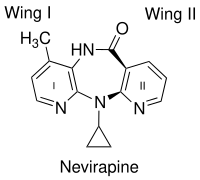
Un factor importante en la unión de los INNTI de primera generación, como la nevirapina, es la forma de mariposa. A pesar de su diversidad química, asumen una forma de mariposa muy similar. [10] Dos anillos aromáticos de INNTI se conforman dentro de la enzima para parecerse a las alas de una mariposa (figura 2). La estructura de la mariposa tiene un centro hidrofílico como un "cuerpo" y dos fracciones hidrofóbicas que representan las alas. [11] El ala I suele ser un anillo heteroaromático y el ala II es un sustituyente fenilo o alilo. El ala I tiene un grupo funcional en un lado del anillo que es capaz de aceptar y/o donar enlaces de hidrógeno con la cadena principal de los aminoácidos Lys-101 y Lys-103. El ala II interactúa a través de interacciones π-π con un bolsillo hidrofóbico, formado en su mayor parte por las cadenas laterales de aminoácidos aromáticos. En el cuerpo de la mariposa, una parte hidrofóbica llena un pequeño bolsillo que está formado principalmente por las cadenas laterales de Lys-103, Val-106 y Val-179. [12] Sin embargo, se ha descubierto que muchos otros INNTR se unen a la RT de diferentes modos. Los INNTR de segunda generación, como las diarilpirimidinas (DAPY), tienen forma de herradura con dos alas hidrofóbicas laterales y un anillo de pirimidina que es la parte polar central. [13]
El NNIBP es elástico y su conformación depende del tamaño, la composición química específica y el modo de unión del NNRTI. La estructura total de la RT tiene una flexibilidad segmentaria que depende de la naturaleza del NNRTI unido. Es importante que el inhibidor tenga flexibilidad para poder unirse en los bolsillos modificados de un objetivo mutante. La flexibilidad del inhibidor puede no afectar las interacciones inhibidor-objetivo. [10]

Los NNRTI actúan uniéndose de forma no competitiva a la enzima RT (figura 3). La unión provoca un cambio conformacional en la estructura tridimensional de la enzima y crea el NNIBP. [6] [7] La unión de NNRTI a la RT del VIH-1 hace que el dominio pulgar p66 se extienda demasiado porque induce cambios en la conformación del rotámero en los residuos de aminoácidos Tyr-181 y Tyr-188. [14] Esto afecta a la actividad catalítica de la enzima y bloquea la replicación del VIH-1 al inhibir el sitio activo de la polimerasa de la subunidad p66 de la RT. [15] El cambio conformacional global desestabiliza además la enzima en su plantilla de ácido nucleico y reduce su capacidad para unirse a los nucleótidos. [16] La transcripción del ARN viral se inhibe y, por lo tanto, la tasa de replicación del virus se reduce. [6] Aunque el mecanismo molecular exacto todavía es hipotético, múltiples estudios han demostrado que este es el mecanismo de acción principal. [ cita requerida ]
Además de este mecanismo de acción primario propuesto, se ha demostrado que los INNTI tienen otros mecanismos de acción e interfieren con varios pasos en la reacción de la transcriptasa inversa. [7] Se ha sugerido [ ¿por quién? ] que la inhibición de la transcripción inversa por los INNTI puede deberse a efectos sobre la actividad de la RT Rnasa H y/o la unión de la plantilla/ cebador . Algunos INNTI interfieren con el procesamiento de la poliproteína Gag-Pol del VIH-1 al inhibir la etapa tardía de la replicación del VIH-1. [ cita requerida ]
Es importante obtener una comprensión profunda de los diversos mecanismos de acción de los INNTI para desarrollar INNTI de próxima generación y comprender el mecanismo de resistencia a los medicamentos. [15]
El desarrollo de fármacos anti-VIH eficaces es difícil debido a las amplias variaciones en las secuencias de nucleótidos y aminoácidos. La composición química perfecta de un fármaco anti-VIH debería ser eficaz contra las mutaciones de resistencia a los fármacos . Comprender la enzima RT diana y su estructura, el mecanismo de acción del fármaco y las consecuencias de las mutaciones de resistencia a los fármacos proporciona información útil que puede resultar útil para diseñar INNTR más eficaces. La enzima RT puede sufrir cambios debido a mutaciones que pueden alterar la unión de los INNTR. [10]
Las dos primeras clases de compuestos que se identificaron como INNTI fueron los compuestos 1-(2-2-hidroxietoximetil)-6-(feniltio)timina (HEPT) y tetrahidroimidazo[4,5,1-jkj] [1,4]benzodiazepin-2(1H)-ona y -tiona (TIBO). El descubrimiento de los compuestos TIBO condujo a la definición de la clase INNTI a fines de la década de 1980 [2] cuando se descubrió inesperadamente que inhibían la RT. Este hallazgo inició investigaciones sobre el mecanismo de acción de estos compuestos. Los compuestos HEPT se describieron antes que los compuestos TIBO y originalmente se creyó que eran INNTI. Más tarde se descubrió que compartían un mecanismo de acción común con los compuestos TIBO. [4] [7] Tanto los compuestos HEPT como los TIBO fueron los primeros en identificarse como inhibidores altamente específicos y potentes de la RT del VIH-1, no activos contra otras RT. [4] Estos compuestos no interrumpen la síntesis de ADN celular o mitocondrial . La especificidad de los INNTI para el VIH-1 se considera el sello distintivo de la clase de fármacos INNTI. [7]
Tras el descubrimiento de HEPT y TIBO, se utilizaron métodos de cribado de compuestos para desarrollar BI-RG-587, el primer INNTI conocido comúnmente como nevirapina. Al igual que HEPT y TIBO, la nevirapina bloqueaba la actividad de la RT viral mediante inhibición no competitiva (con respecto a la unión de dNTP). Esto reforzó la idea de que la nueva clase de inhibidores anti-VIH inhibía la actividad de la RT pero no en el sitio activo. Han surgido varias familias moleculares de INNTI tras el cribado y la evolución de muchas moléculas. [8]
La FDA ha aprobado tres compuestos INNTI de primera generación para el tratamiento de la infección por VIH-1. La nevirapina se aprobó en 1996, la delavirdina en 1997 y el efavirenz en 1998 (tabla 1). Dos de estos fármacos, la nevirapina y el efavirenz, son piedras angulares de la TARGA de primera línea, mientras que la delavirdina apenas se utiliza en la actualidad. [7] [8] La estructura de estos tres fármacos muestra la amplia gama de anillos, sustituyentes y enlaces que permiten la actividad contra la RT del VIH-1. Esta diversidad demuestra por qué se han sintetizado tantos no nucleósidos, pero no explica por qué sólo tres fármacos han llegado al mercado. El principal problema ha sido la capacidad de estos compuestos para desarrollar resistencia. [8]
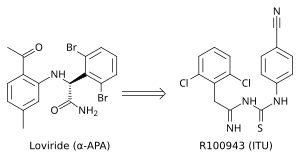
El análisis de la estructura cristalina mostró que los INNTI de primera generación (por ejemplo, TIBO, nevirapina y α-APA) se unen a la RT del VIH-1 en una conformación “similar a una mariposa”. Estos INNTI de primera generación eran vulnerables a las mutaciones de resistencia a fármacos comunes como Tyr-181C y Tyr-188L/H. Esto desencadenó la necesidad de encontrar INNTI nuevos y más eficaces. ITU (imidoiltiourea), una serie prometedora de INNTI, surgió a partir de análogos de α-APA (figura 4). Los compuestos ITU se obtuvieron extendiendo el enlace que une los grupos laterales arilo del α-APA. Un potente compuesto ITU, R100943, se obtuvo mediante una disposición de la composición química de los grupos laterales basada en relaciones estructura-actividad (SAR). Una estructura cristalina del complejo VIH-1/R100943 demostró que los compuestos ITU son más flexibles que el compuesto α-APA. Los compuestos de la ITU mostraron un modo de unión distinto, ya que se unieron en "herradura" o en "U". La parte 2,6-diclorofenilo de R100943, que corresponde químicamente a la parte 2,6-dibromofenilo del ala II del α-APA, ocupó la parte del ala I en el NNIBP, mientras que la parte 4-cianoanilino de R100943 ocupa la posición del ala II en el NNIBP. [10] [17]
R100943 inhibió el VIH-1 y fue considerablemente eficaz contra una serie de mutantes clave resistentes a los INNTR, como la mutación G190A, que causó una resistencia de alto nivel a la lovirida (α-APA) y la nevirapina. Se pensaba que la mutación G190A causaba resistencia al ocupar una parte del bolsillo de unión que de otro modo estaría lleno por la parte de enlace de los INNTR en forma de mariposa. R100943, en el modo de unión en herradura, se encuentra a una distancia de aproximadamente 6,0 Å de G190. En comparación con la nevirapina y la lovirida, que se unen en forma de mariposa, los derivados de ITU revelaron una actividad mejorada contra los mutantes Tyr-181C y Tyr-188L. Un estudio estructural sugirió que un compuesto TIBO potente podría complementar parcialmente los efectos de la mutación Tyr-181C al moverse en el bolsillo de unión de inhibidores no nucleósidos (NNIBP) de la RT mutante. En este contexto, R100943 tiene libertad torsional que permite las alternancias conformacionales del NNRTI. Esta libertad torsional podría ser utilizada por el derivado de ITU para unirse a un NNIBP mutado y compensar así los efectos de una mutación de resistencia. Sin embargo, la potencia de R100943 contra mutantes resistentes al VIH-1 no fue adecuada para que se lo considere un candidato a fármaco eficaz . Además, la estabilidad química de la parte imidoiltiourea del derivado de ITU no fue favorable para un fármaco oral. [10] [18] [19]
Los cambios en los complejos de imidoiltiourea condujeron a la síntesis de una nueva clase de compuestos, la diariltriazina (DATA). En estos compuestos, la parte de tiourea de los compuestos ITU fue reemplazada por un anillo de triazina. Los compuestos DATA fueron más potentes que los compuestos ITU contra las cepas mutantes comunes resistentes a los INNTI. R106168, un compuesto prototipo de DATA, fue bastante fácil de sintetizar. Se realizaron múltiples sustituciones en diferentes posiciones en los tres anillos y en los enlaces que conectan los anillos. En el bolsillo, la mayoría de los derivados de DATA conformaron una conformación de herradura. Las dos alas en R106168 (2,6-diclorobencilo y 4-cianoanilino) ocuparon posiciones en el bolsillo similares a las de las dos alas de los derivados de ITU. La parte central de los compuestos DATA, en la que el anillo de triazina reemplazó al grupo tiourea de los derivados de ITU, está ubicada entre las cadenas laterales de L100 y V179. Esto eliminó una serie de grados de libertad torsional en la parte central, manteniendo al mismo tiempo la flexibilidad entre el anillo de triazina y las alas. [10] [20]
La sustitución o modificación química en la cadena principal de tres anillos aromáticos de los compuestos DATA tuvo un efecto sustancial en la actividad. R120393, un análogo de DATA, fue diseñado con una parte de cloroindol en el ala I para expandir las interacciones con la cadena lateral de W229 conservada del bucle de agarre del cebador de la polimerasa. R120393 tuvo un efecto similar al de R106168 contra la mayoría de los mutantes resistentes a los INNTR. La parte de cloroindol interactuó con el núcleo hidrofóbico del bolsillo e influyó en el modo de unión de R120393, de modo que se adentró más en el bolsillo en comparación con la posición del ala I de otros análogos de DATA. Las estructuras cristalinas mostraron que los compuestos DATA podían unirse al NNIBP en diferentes conformaciones. La capacidad de unirse en múltiples modos hizo que los INNTR fueran más fuertes contra las mutaciones de resistencia a los fármacos. Se pudo observar variabilidad entre los inhibidores cuando se alteraron la composición química, el tamaño del ala I y los dos grupos de enlace que conectaban los anillos. La potencia de los NNRTI cambió cuando los átomos de nitrógeno de triazina fueron sustituidos por carbonos. [10]
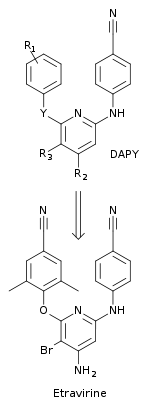
Los investigadores utilizaron un enfoque multidisciplinario para diseñar INNTI con un mejor perfil de resistencia y una mayor barrera genética para el desarrollo de resistencia. [10] Se descubrió una nueva clase de compuestos, diarilpirimida (DAPY), con el reemplazo del anillo central de triazina de los compuestos DATA, con una pirimidina . Esta nueva clase fue más efectiva contra cepas de VIH-1 resistentes a fármacos que los análogos DATA correspondientes. El reemplazo permitió sustituciones en el grupo CH en la posición 5 del anillo aromático central. Se descubrió que uno de los primeros compuestos DAPY, dapivirina (con R 1 = 2,4,6-trimetilanilino, R 2 = R 3 = H e Y = NH) era eficaz contra cepas de VIH-1 resistentes a fármacos. Se realizaron sustituciones químicas sistemáticas en las posiciones R 1 , R 2 , R 3 e Y para encontrar nuevos derivados de DAPY. Esto condujo al descubrimiento de la etravirina, que tiene una sustitución de bromo en la posición 5 (R 3 ) del anillo de pirimidina (con R 1 = 2,6-dimetil-4-cianoanilino, R 2 = NH 2 e Y = O) (figura 5). [10] La etravirina fue descubierta por investigadores de la Jansen Research Foundation y Tibotec y aprobada en 2008 por la FDA. Se utiliza en pacientes adultos con experiencia en tratamiento con infección por VIH que es resistente a múltiples fármacos en combinación con otros medicamentos antirretrovirales. [21]
Al tratar una infección, ya sea bacteriana o vírica, siempre existe el riesgo de que el agente infeccioso desarrolle resistencia a los medicamentos. El tratamiento de la infección por VIH es especialmente susceptible a la resistencia a los medicamentos, lo que constituye un problema clínico grave en el tratamiento quimioterapéutico de la infección. Las cepas de VIH resistentes a los medicamentos surgen si el virus es capaz de replicarse en presencia de medicamentos antirretrovirales. [10]
Las cepas de VIH resistentes a los INNTI presentan mutaciones que ocurren principalmente en y alrededor del NNIBP que afectan directamente la unión del INNTI al alterar el tamaño, la forma y la polaridad en diferentes áreas del bolsillo o al afectar, indirectamente, el acceso al bolsillo. [10] Esas mutaciones se observan principalmente en dominios que abarcan los aminoácidos 98-108, 178-190 o 225-238 de la subunidad p66. Las mutaciones más frecuentes observadas en virus aislados de pacientes que han estado en una quimioterapia que contiene INNTI que ha fallado son Lys-103N y Tyr-181C. La resistencia a los INNTI se ha relacionado con más de 40 sustituciones de aminoácidos in vitro e in vivo . [7]
Los fármacos antirretrovirales nunca se utilizan en monoterapia debido al rápido desarrollo de resistencia. La terapia antirretroviral de gran actividad (TARGA) se introdujo en 1996. [6] El régimen de tratamiento combina tres fármacos de al menos dos clases diferentes de fármacos antirretrovirales. [7]
La ventaja de la etravirina con respecto a otros INNTI es que se requieren múltiples mutaciones para que se desarrolle resistencia a los fármacos. El fármaco también ha demostrado actividad contra virus con mutaciones comunes asociadas a la resistencia a los INNTI y mutaciones de resistencia cruzada . [21]
Las autoridades reguladoras han aprobado cinco fármacos de la clase de los INNTI. Se trata de los INNTI de primera generación nevirapina, delavirdina y efavirenz y los INNTI de próxima generación etravirina y rilpivirina . Varios otros INNTI se sometieron a desarrollo clínico, pero se interrumpieron debido a factores farmacocinéticos , de eficacia y/o seguridad desfavorables. Actualmente hay otros cuatro INNTI en desarrollo clínico, IDX899, RDEA-428 y lersivirina (tabla 2).
La rilpivirina es un compuesto DAPY como la etravirina y se descubrió cuando se realizó una optimización adicional dentro de esta familia de INNTI. El perfil de resistencia y la barrera genética para el desarrollo de resistencia es comparable a la etravirina in vitro . La ventaja de la rilpivirina sobre la etravirina es una mejor biodisponibilidad y es más fácil de formular que la etravirina. La etravirina ha requerido un extenso trabajo de formulación química debido a su baja solubilidad y biodisponibilidad. [7] La rilpivirina fue aprobada por la FDA para la terapia del VIH en mayo de 2011 bajo la marca Edurant. [22] Edurant está aprobado para pacientes sin tratamiento previo con una carga viral de 100.000 copias/ml o menos al inicio de la terapia. [23] Su dosis recomendada es de 25 mg por vía oral una vez al día con una comida, en combinación con otros antirretrovirales. [24] Está contraindicado su uso con inhibidores de la bomba de protones debido al aumento del pH gástrico que provoca una disminución de las concentraciones plasmáticas de rilpivirina, lo que puede dar lugar a una pérdida de la respuesta virológica y una posible resistencia. [24] En agosto de 2011, la Administración de Alimentos y Medicamentos de los EE. UU. aprobó un fármaco de dosis fija que combina rilpivirina con emtricitabina y tenofovir disoproxilo (TDF) con la marca Complera. [25] En marzo de 2016, se aprobó un fármaco de dosis fija más nuevo que también combina rilpivirina con emtricitabina y tenofovir alafenamida (TAF) con la marca Odefsey. [ cita requerida ]
En 2007, investigadores de la compañía farmacéutica Ardea Biosciences presentaron una nueva familia de triazoles NNRTI. El candidato seleccionado de la selección realizada fue RDEA806, perteneciente a la familia de los triazoles . Tiene un perfil de resistencia contra cepas seleccionadas del VIH-1 resistentes a NNRTI similar al de otros NNRTI de próxima generación. [7] El candidato entró en ensayos clínicos de fase IIb a finales de 2009, [26] pero no se han iniciado más ensayos. Ardea se vendió a AstraZeneca en 2012. [27]
La fosdevirina (también conocida como IDX899 y GSK-2248761) es otro inhibidor no nucleósido de la transcriptasa inversa de próxima generación desarrollado por Idenix Pharmaceuticals y ViiV Healthcare. Pertenece a la familia de los 3-fosfoindoles. Los estudios in vitro han demostrado un perfil de resistencia comparable al de los otros inhibidores no nucleósidos de la transcriptasa inversa de próxima generación. [7] En noviembre de 2009, el candidato entró en ensayos clínicos de fase II, pero el ensayo y todo el desarrollo posterior se detuvieron cuando 5 de los 35 sujetos que recibieron fosdevirina experimentaron convulsiones de aparición tardía. [28]
La lersivirina pertenece a la familia de los pirazoles y es otro inhibidor no nucleósido de la transcriptasa inversa de próxima generación que se encuentra en ensayos clínicos y que ha sido desarrollado por la compañía farmacéutica ViiV Healthcare . El perfil de resistencia es similar al de otros inhibidores no nucleósidos de la transcriptasa inversa de próxima generación. A finales de 2009, la lersivirina se encontraba en la fase IIb. [7] En febrero de 2013, ViiV Healthcare anunció la interrupción del programa de desarrollo de la lersivirina. [29]