La transposición de Curtius (o reacción de Curtius o degradación de Curtius ), definida por primera vez por Theodor Curtius en 1885, es la descomposición térmica de una azida de acilo en un isocianato con pérdida de gas nitrógeno . [1] [2] El isocianato luego sufre el ataque de una variedad de nucleófilos como agua, alcoholes y aminas , para producir una amina primaria, un carbamato o un derivado de urea respectivamente. [3] Se han publicado varias revisiones. [4] [5]

La azida de acilo se obtiene generalmente a partir de la reacción de cloruros o anhídridos de ácido [6] con azida de sodio [7] o azida de trimetilsililo [8] Las azidas de acilo también se obtienen a partir del tratamiento de acilhidrazinas con ácido nitroso [ 9] Alternativamente, la azida de acilo se puede formar mediante la reacción directa de un ácido carboxílico con difenilfosforilazida (DPPA). [10] [11]

Se creía que la transposición de Curtius era un proceso de dos pasos, con la pérdida de gas nitrógeno formando un acil nitreno , seguido de la migración del grupo R para dar el isocianato . Sin embargo, investigaciones recientes han indicado que la descomposición térmica es un proceso concertado , [12] con ambos pasos sucediendo juntos, debido a la ausencia de cualquier inserción de nitreno o subproductos de adición observados o aislados en la reacción. [13] Los cálculos termodinámicos también apoyan un mecanismo concertado. [14]
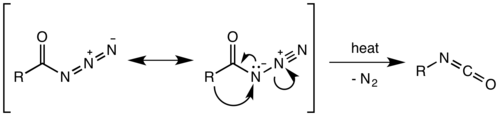
La migración se produce con una retención total de la configuración en el grupo R. La aptitud migratoria del grupo R es aproximadamente terciaria > secundaria ~ arilo > primaria. El isocianato formado puede luego hidrolizarse para dar una amina primaria , o sufrir un ataque nucleofílico con alcoholes y aminas para formar carbamatos y derivados de urea respectivamente.
Las investigaciones han demostrado que la transposición de Curtius está catalizada tanto por los ácidos de Brønsted [15] como por los de Lewis , a través de la protonación o la coordinación con el átomo de oxígeno del acilo, respectivamente. Por ejemplo, Fahr y Neumann han demostrado que el uso de catalizadores de trifluoruro de boro o tricloruro de boro reduce la temperatura de descomposición necesaria para la transposición en aproximadamente 100 °C y aumenta significativamente el rendimiento del isocianato. [16]
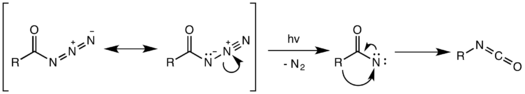
También es posible la descomposición fotoquímica de la azida de acilo. [17] Sin embargo, la reorganización fotoquímica no es concertada y, en cambio, se produce por un intermediario de nitreno , formado por la escisión del enlace débil N–N y la pérdida de gas nitrógeno. El nitreno altamente reactivo puede sufrir una variedad de reacciones de nitreno, como la inserción y adición de nitreno , dando lugar a productos secundarios no deseados. [18] En el siguiente ejemplo, el intermediario de nitreno se inserta en uno de los enlaces C–H del disolvente de ciclohexano para formar N-ciclohexilbenzamida como producto secundario.

En una variación llamada degradación de Darapsky , [19] o síntesis de Darapsky , se produce un reordenamiento de Curtius como uno de los pasos en la conversión de un α-cianoéster en un aminoácido . Se utiliza hidrazina para convertir el éster en una acilhidrazina , que se hace reaccionar con ácido nitroso para dar la azida de acilo. Calentar la azida en etanol produce el carbamato de etilo mediante el reordenamiento de Curtius. La hidrólisis ácida produce la amina a partir del carbamato y el ácido carboxílico a partir del nitrilo simultáneamente, dando como resultado el aminoácido. [20]

La migración y reordenamiento fotoquímico similar a Curtius de una azida fosfínica forma un metafosfonimidato [21] en lo que también se conoce como la reacción de Harger (llamada así en honor al Dr. Martin Harger de la Universidad de Leicester ). [22] A esto le sigue una hidrólisis, en el ejemplo siguiente con metanol , para dar un fosfonamidato.

A diferencia de la transposición de Curtius, en la azida fosfínica se puede elegir entre distintos grupos R que pueden migrar. Harger ha descubierto que los grupos alquilo migran preferentemente a los grupos arilo, y esta preferencia aumenta en el orden metilo < primario < secundario < terciario. Esto probablemente se deba a factores estéricos y conformacionales, ya que cuanto más voluminoso sea el grupo R, menos favorable será la conformación para la migración del fenilo. [23]
El reordenamiento de Curtius es tolerante a una gran variedad de grupos funcionales y tiene una utilidad sintética significativa, ya que se pueden incorporar muchos grupos diferentes dependiendo de la elección del nucleófilo utilizado para atacar al isocianato.
Por ejemplo, cuando se lleva a cabo en presencia de terc -butanol , la reacción genera aminas protegidas con Boc , intermediarios útiles en la síntesis orgánica . [24] [25] Asimismo, cuando la reacción de Curtius se realiza en presencia de alcohol bencílico , se forman aminas protegidas con Cbz . [26]
RB Woodward et al. utilizaron el reordenamiento de Curtius como uno de los pasos en la síntesis total del poliquinano triquinaceno en 1964. Después de la hidrólisis del éster en el intermedio ( 1 ), se efectuó un reordenamiento de Curtius para convertir los grupos de ácido carboxílico en ( 2 ) en los grupos de carbamato de metilo ( 3 ) con un rendimiento del 84%. Los pasos posteriores dieron lugar al triquinaceno ( 4 ). [27]

En su síntesis del fármaco antiviral oseltamivir , también conocido como Tamiflu, Ishikawa et al. utilizaron la transposición de Curtius en uno de los pasos clave para convertir la azida de acilo en el grupo amida en la molécula diana. En este caso, el isocianato formado por la transposición es atacado por un ácido carboxílico para formar la amida. Las reacciones subsiguientes se podrían llevar a cabo en el mismo recipiente de reacción para dar el producto final con un rendimiento general del 57%. Un beneficio importante de la reacción de Curtius destacado por los autores fue que se podía llevar a cabo a temperatura ambiente, lo que minimizaba el riesgo de calentamiento. El esquema en general fue muy eficiente, requiriendo solo tres operaciones de "una sola olla" para producir este importante y valioso fármaco utilizado para el tratamiento de la gripe aviar . [28]

La dievodiamina es un producto natural de la planta Euodia ruticarpa , que se utiliza ampliamente en la medicina tradicional china . La síntesis total de dievodiamina sin grupo protector de Unsworth et al. utiliza la transposición de Curtius en el primer paso de la síntesis, catalizada por trifluoruro de boro . El isocianato activado reacciona rápidamente con el anillo indólico en una reacción de sustitución aromática electrofílica para dar la amida con un rendimiento del 94%, y los pasos posteriores dan dievodamina. [29]
