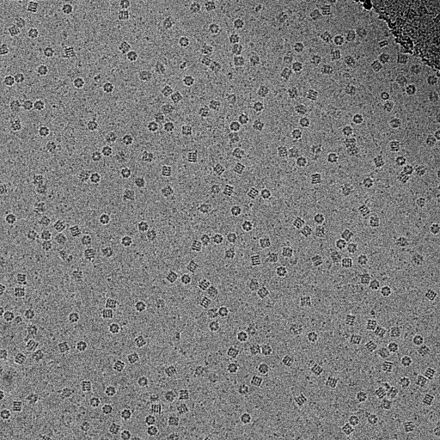
La criomicroscopía electrónica de transmisión ( CryoTEM ), comúnmente conocida como crio-EM , es una forma de microscopía electrónica criogénica , más específicamente un tipo de microscopía electrónica de transmisión (TEM) donde la muestra se estudia a temperaturas criogénicas (generalmente temperaturas de nitrógeno líquido ). [1] La crio-EM, específicamente la microscopía electrónica tridimensional ( 3DEM ), está ganando popularidad en la biología estructural . [2]
La utilidad de la criomicroscopía electrónica de transmisión radica en que permite observar muestras que no han sido teñidas ni fijadas de ninguna manera, mostrándolas en su entorno nativo, a diferencia de la cristalografía de rayos X , que requiere cristalizar la muestra, lo que puede resultar difícil, y colocarla en entornos no fisiológicos, lo que en ocasiones puede dar lugar a cambios conformacionales funcionalmente irrelevantes.
Los avances en la tecnología de detectores de electrones , particularmente DED (Detectores de Electrones Directos), así como algoritmos de imágenes de software más potentes, han permitido la determinación de estructuras macromoleculares con una resolución cercana a la atómica. [3] Las macromoléculas obtenidas mediante imágenes incluyen virus , ribosomas , mitocondrias , canales iónicos y complejos enzimáticos . A partir de 2018, la crio-EM podría aplicarse a estructuras tan pequeñas como la hemoglobina (64 kDa ) [4] y con resoluciones de hasta 1,8 Å . [5] En 2019, las estructuras crio-EM representaron el 2,5% de las estructuras depositadas en el Protein Data Bank , [6] y este número sigue creciendo. [7] Una aplicación de la crio-EM es la tomografía crioelectrónica (crio-ET), donde se crea una reconstrucción 3D de la muestra a partir de imágenes 2D inclinadas.
La razón original de ser de CryoTEM era la de ser un medio para combatir los daños que la radiación provoca en las muestras biológicas. La cantidad de radiación necesaria para obtener una imagen de una muestra en el microscopio electrónico es lo suficientemente alta como para ser una fuente potencial de daños en las muestras de estructuras delicadas. Además, el alto vacío que se requiere en la columna de un microscopio electrónico hace que el entorno de la muestra sea bastante hostil.
El problema del vacío se resolvió parcialmente con la introducción de tinciones negativas , pero incluso con tinciones negativas las muestras biológicas son propensas a colapsar estructuralmente al deshidratarse la muestra. La inclusión de las muestras en hielo por debajo de la temperatura de sublimación fue una posibilidad que se contempló desde el principio, pero el agua tiende a organizarse en una red cristalina de menor densidad al congelarse y esto puede destruir la estructura de cualquier cosa que esté incrustada en ella.
A principios de los años 1980, varios grupos que estudiaban la física del estado sólido intentaban producir hielo vítreo por diferentes medios, como la congelación a alta presión o la congelación instantánea. En un artículo seminal de 1984, el grupo dirigido por Jacques Dubochet en el Laboratorio Europeo de Biología Molecular mostró imágenes de adenovirus incrustados en una capa vitrificada de agua. [8] Este artículo se considera generalmente como el que marca el origen de la crio-EM, y la técnica se ha desarrollado hasta el punto de convertirse en una rutina en numerosos laboratorios de todo el mundo.
La energía de los electrones utilizados para la obtención de imágenes (80–300 kV) es lo suficientemente alta como para que se puedan romper los enlaces covalentes . Cuando las muestras que se obtienen son vulnerables a los daños causados por la radiación, es necesario limitar la exposición a los electrones utilizados para adquirir la imagen. Estas bajas exposiciones requieren que se seleccionen, alineen y promedien las imágenes de miles o incluso millones de moléculas congeladas idénticas para obtener mapas de alta resolución mediante un software especializado. En 2012 se logró una mejora significativa en las características estructurales gracias a la introducción de detectores de electrones directos y mejores algoritmos computacionales. [1] [2]
En 2015, Bridget Carragher y sus colegas del Scripps National Resource for Automated Molecular Microscopy utilizaron técnicas que ella y Clint Potter desarrollaron para determinar la primera estructura crio-EM con una resolución más fina que 3 Å, elevando así a CryoTEM como una herramienta comparable y potencialmente superior a las técnicas tradicionales de cristalografía de rayos X. [9] [10] Desde entonces, se han logrado resoluciones más altas, incluida una estructura de 2,2 Å de la enzima bacteriana β-galactosidasa en 2015 [11] y una estructura de 1,8 Å de la glutamato deshidrogenasa en 2016. [12] Cryo-EM también se ha utilizado para determinar la estructura de varios virus, incluido el virus Zika , [13] y se ha aplicado a grandes complejos como el espliceosoma . [14] En 2017, el Premio Nobel de Química fue otorgado conjuntamente a Jacques Dubochet , Joachim Frank y Richard Henderson , "por desarrollar la microscopía crioelectrónica para la determinación de la estructura de alta resolución de biomoléculas en solución". [15]
El material biológico se extiende sobre una rejilla de microscopio electrónico y se conserva en estado congelado-hidratado mediante congelación rápida, generalmente en etano líquido cerca de la temperatura del nitrógeno líquido . Al mantener las muestras a la temperatura del nitrógeno líquido o más frías, se pueden introducir en el alto vacío de la columna del microscopio electrónico . La mayoría de las muestras biológicas son extremadamente radiosensibles , por lo que se deben obtener imágenes con técnicas de baja dosis (útilmente, la baja temperatura de la criomicroscopía electrónica de transmisión proporciona un factor de protección adicional contra el daño por radiación).
En consecuencia, las imágenes son extremadamente ruidosas . Para algunos sistemas biológicos es posible promediar imágenes para aumentar la relación señal-ruido y recuperar información de alta resolución sobre la muestra utilizando la técnica conocida como análisis de partículas individuales . Este enfoque en general requiere que las cosas que se promedian sean idénticas, aunque ahora se puede estudiar cierta heterogeneidad conformacional limitada (por ejemplo, el ribosoma ). Las reconstrucciones tridimensionales a partir de imágenes CryoTEM de complejos de proteínas y virus se han resuelto a una resolución subnanométrica o casi atómica, lo que permite nuevos conocimientos sobre la estructura y la biología de estos grandes conjuntos.
El análisis de matrices ordenadas de proteínas, como cristales bidimensionales de proteínas transmembrana o matrices helicoidales de proteínas, también permite un tipo de promediado que puede proporcionar información de alta resolución sobre la muestra. Esta técnica se denomina cristalografía electrónica .
El método de película delgada se limita a muestras delgadas (típicamente < 500 nm) porque los electrones no pueden atravesar muestras más gruesas sin múltiples eventos de dispersión. Las muestras más gruesas se pueden vitrificar mediante congelación por inmersión ( criofijación ) en etano (hasta decenas de μm de espesor) o más comúnmente mediante congelación a alta presión (hasta cientos de μm). Luego se pueden cortar en secciones delgadas (de 40 a 200 nm de espesor) con un cuchillo de diamante en un crioultramicrotomo a temperaturas inferiores a −135 °C (temperatura de desvitrificación). Las secciones se recogen en una rejilla de microscopio electrónico y se obtienen imágenes de la misma manera que las muestras vitrificadas en película delgada. Esta técnica se llama criomicroscopía electrónica de transmisión de secciones vítreas (CEMOVIS) o criomicroscopía electrónica de transmisión de secciones congeladas-hidratadas.
Además de permitir la obtención de imágenes de muestras biológicas vitrificadas, CryoTEM también se puede utilizar para obtener imágenes de muestras de materiales que son demasiado volátiles en vacío para obtener imágenes con microscopio electrónico estándar a temperatura ambiente. Por ejemplo, se pueden extraer secciones vitrificadas de interfaces líquido-sólido para su análisis mediante CryoTEM [16] , y el azufre, que es propenso a la sublimación en el vacío de los microscopios electrónicos, se puede estabilizar y obtener imágenes con CryoTEM [17] .
Aunque en la mayoría de los enfoques de la microscopía electrónica se intenta obtener la imagen de mejor resolución del material, no siempre es así en la crio-TEM. Además de todos los beneficios de las imágenes de alta resolución, la relación señal/ruido sigue siendo el principal obstáculo que impide asignar orientación a cada partícula. Por ejemplo, en los complejos de macromoléculas, hay varias estructuras diferentes que se proyectan de 3D a 2D durante la obtención de imágenes y, si no se distinguen, el resultado del procesamiento de imágenes será borroso. Es por eso que los enfoques probabilísticos se vuelven más poderosos en este tipo de investigación. [18] Hay dos enfoques populares que se utilizan ampliamente hoy en día en el procesamiento de imágenes crio-EM, el enfoque de máxima verosimilitud que se descubrió en 1998 [19] y el enfoque bayesiano adaptado relativamente recientemente. [20]
El método de estimación de máxima verosimilitud llega a este campo a partir de las estadísticas. En este método, se suman todas las orientaciones posibles de las partículas para obtener la distribución de probabilidad resultante. Podemos comparar esto con una estimación típica de mínimos cuadrados , en la que las partículas obtienen orientaciones exactas por imagen. [21] De esta manera, las partículas de la muestra obtienen orientaciones "difusas" después de los cálculos, ponderadas por las probabilidades correspondientes. Todo el proceso es iterativo y con cada iteración siguiente el modelo mejora. Las buenas condiciones para hacer el modelo que represente de manera precisa la estructura real son cuando los datos no tienen demasiado ruido y las partículas no tienen ninguna dirección preferencial. La principal desventaja del método de máxima verosimilitud es que el resultado depende de la estimación inicial y la optimización del modelo a veces puede quedarse estancada en el mínimo local. [22]
El enfoque bayesiano que se utiliza actualmente en cryo-TEM es empírico por naturaleza. Esto significa que la distribución de partículas se basa en el conjunto de datos original. De manera similar, en el método bayesiano habitual hay una probabilidad previa fija que cambia después de observar los datos. La principal diferencia con la estimación de máxima verosimilitud radica en un término de reconstrucción especial que ayuda a suavizar los mapas resultantes y, al mismo tiempo, reduce el ruido durante la reconstrucción. [21] La suavización de los mapas se produce al suponer que la probabilidad previa es una distribución gaussiana y analizar los datos en el espacio de Fourier. Dado que se establece la conexión entre el conocimiento previo y el conjunto de datos, hay menos posibilidades de errores de factor humano, lo que aumenta potencialmente la objetividad de la reconstrucción de imágenes. [20]
Con la aparición de nuevos métodos de obtención de imágenes y reconstrucción de imágenes mediante crio-TEM, aparecen nuevas soluciones de software que ayudan a automatizar el proceso. Después de que el enfoque bayesiano empírico se haya implementado en el programa informático de código abierto RELION (REgularized Likelihood OptimizatioN) para la reconstrucción 3D, [23] [24] el programa se ha generalizado en el campo de la crio-TEM. Ofrece una gama de correcciones que mejoran la resolución de las imágenes reconstruidas, permite implementar scripts versátiles utilizando el lenguaje Python y ejecuta las tareas habituales de clasificación de modelos 2D/3D o creación de modelos de novo . [25] [26]
Se pueden utilizar diversas técnicas en CryoTEM. [27] Las técnicas populares incluyen: