
El ciclo del nitrógeno es el ciclo biogeoquímico por el cual el nitrógeno se convierte en múltiples formas químicas a medida que circula entre los ecosistemas atmosféricos , terrestres y marinos . La conversión de nitrógeno puede llevarse a cabo a través de procesos tanto biológicos como físicos. Los procesos importantes en el ciclo del nitrógeno incluyen la fijación , la amonificación , la nitrificación y la desnitrificación . La mayor parte de la atmósfera de la Tierra (78%) es nitrógeno atmosférico , [16] lo que lo convierte en la mayor fuente de nitrógeno. Sin embargo, el nitrógeno atmosférico tiene una disponibilidad limitada para uso biológico, lo que lleva a una escasez de nitrógeno utilizable en muchos tipos de ecosistemas .
El ciclo del nitrógeno es de particular interés para los ecólogos porque la disponibilidad de nitrógeno puede afectar la velocidad de los procesos clave del ecosistema, incluyendo la producción primaria y la descomposición . Las actividades humanas como la combustión de combustibles fósiles, el uso de fertilizantes nitrogenados artificiales y la liberación de nitrógeno en las aguas residuales han alterado drásticamente el ciclo global del nitrógeno . [17] [18] [19] La modificación humana del ciclo global del nitrógeno puede afectar negativamente al sistema ambiental natural y también a la salud humana. [20] [21]
El nitrógeno está presente en el medio ambiente en una amplia variedad de formas químicas, incluido el nitrógeno orgánico, el amonio ( NH+4), nitrito ( NO−2), nitrato ( NO−3), óxido nitroso ( N 2 O ), óxido nítrico (NO) o gas nitrógeno inorgánico ( N 2 ). El nitrógeno orgánico puede estar en forma de un organismo vivo, humus o en los productos intermedios de la descomposición de la materia orgánica. Los procesos en el ciclo del nitrógeno son transformar el nitrógeno de una forma a otra. Muchos de esos procesos son llevados a cabo por microbios , ya sea en su esfuerzo por cosechar energía o para acumular nitrógeno en una forma necesaria para su crecimiento. Por ejemplo, los desechos nitrogenados en la orina animal son descompuestos por bacterias nitrificantes en el suelo para ser utilizados por las plantas. El diagrama al lado muestra cómo estos procesos encajan para formar el ciclo del nitrógeno.
La conversión de nitrógeno gaseoso ( N 2 ) en nitratos y nitritos a través de procesos atmosféricos, industriales y biológicos se denomina fijación de nitrógeno. El nitrógeno atmosférico debe procesarse, o " fijarse ", en una forma utilizable para que lo absorban las plantas. Entre 5 y 10 mil millones de kg por año son fijados por los rayos , pero la mayor parte de la fijación la realizan bacterias de vida libre o simbióticas conocidas como diazótrofos . Estas bacterias tienen la enzima nitrogenasa que combina nitrógeno gaseoso con hidrógeno para producir amoníaco , que es convertido por las bacterias en otros compuestos orgánicos . La mayor parte de la fijación biológica de nitrógeno ocurre por la actividad de la molibdeno (Mo)-nitrogenasa, que se encuentra en una amplia variedad de bacterias y algunas arqueas . La mo-nitrogenasa es una enzima compleja de dos componentes que tiene múltiples grupos prostéticos que contienen metales. [22] Un ejemplo de bacteria de vida libre es Azotobacter . Las bacterias simbióticas fijadoras de nitrógeno, como Rhizobium, suelen vivir en los nódulos de las raíces de las legumbres (como los guisantes, la alfalfa y los algarrobos). Allí forman una relación mutualista con la planta, produciendo amoníaco a cambio de carbohidratos . Debido a esta relación, las legumbres a menudo aumentarán el contenido de nitrógeno de los suelos pobres en nitrógeno. Algunas no legumbres también pueden formar tales simbiosis . Hoy en día, alrededor del 30% del nitrógeno fijado total se produce industrialmente mediante el proceso Haber-Bosch , [23] que utiliza altas temperaturas y presiones para convertir el gas nitrógeno y una fuente de hidrógeno (gas natural o petróleo) en amoníaco. [24]
Las plantas pueden absorber nitrato o amonio del suelo por sus pelos radicales. Si se absorbe nitrato, primero se reduce a iones nitrito y luego a iones amonio para su incorporación a aminoácidos, ácidos nucleicos y clorofila. En las plantas que tienen una relación simbiótica con los rizobios, parte del nitrógeno se asimila en forma de iones amonio directamente desde los nódulos. Ahora se sabe que existe un ciclo más complejo de aminoácidos entre los bacteroides de Rhizobia y las plantas. La planta proporciona aminoácidos a los bacteroides, por lo que no se requiere la asimilación de amoníaco y los bacteroides pasan los aminoácidos (con el nitrógeno recién fijado) de vuelta a la planta, formando así una relación interdependiente. [25] Mientras que muchos animales, hongos y otros organismos heterótrofos obtienen nitrógeno mediante la ingestión de aminoácidos , nucleótidos y otras pequeñas moléculas orgánicas, otros heterótrofos (incluidas muchas bacterias ) pueden utilizar compuestos inorgánicos, como el amonio, como únicas fuentes de N. La utilización de diversas fuentes de N está cuidadosamente regulada en todos los organismos.
Cuando una planta o un animal muere o un animal expulsa desechos, la forma inicial del nitrógeno es orgánica . Las bacterias o los hongos convierten el nitrógeno orgánico de los restos nuevamente en amonio ( NH+4), un proceso llamado amonificación o mineralización . Las enzimas implicadas son:

La conversión de amonio en nitrato se lleva a cabo principalmente por bacterias que viven en el suelo y otras bacterias nitrificantes. En la etapa primaria de la nitrificación, la oxidación del amonio ( NH+4) es realizada por bacterias como la especie Nitrosomonas , que convierte el amoniaco en nitritos ( NO−2). Otras especies bacterianas como Nitrobacter , son responsables de la oxidación de los nitritos ( NO−2) en nitratos ( NO−3) Es importante que el amoníaco ( NH 3 ) se convierta en nitratos o nitritos porque el gas amoníaco es tóxico para las plantas.
Debido a su altísima solubilidad y a que los suelos son altamente incapaces de retener aniones , los nitratos pueden entrar en las aguas subterráneas . El nitrato elevado en las aguas subterráneas es una preocupación para el uso del agua potable porque el nitrato puede interferir con los niveles de oxígeno en la sangre de los bebés y causar metahemoglobinemia o síndrome del bebé azul. [28] Cuando el agua subterránea recarga el flujo de los arroyos, el agua subterránea enriquecida con nitrato puede contribuir a la eutrofización , un proceso que conduce a una alta población y crecimiento de algas, especialmente poblaciones de algas verdeazuladas. Si bien no es directamente tóxico para la vida de los peces, como el amoníaco, el nitrato puede tener efectos indirectos en los peces si contribuye a esta eutrofización. El nitrógeno ha contribuido a graves problemas de eutrofización en algunos cuerpos de agua. Desde 2006, la aplicación de fertilizantes nitrogenados se ha controlado cada vez más en Gran Bretaña y los Estados Unidos. Esto está ocurriendo en la misma línea que el control de los fertilizantes de fósforo, cuya restricción normalmente se considera esencial para la recuperación de los cuerpos de agua eutrofizados.
La desnitrificación es la reducción de nitratos a gas nitrógeno ( N
2), completando el ciclo del nitrógeno. Este proceso lo llevan a cabo especies bacterianas como Pseudomonas y Paracoccus , en condiciones anaeróbicas. Utilizan el nitrato como aceptor de electrones en lugar del oxígeno durante la respiración. Estas bacterias anaeróbicas facultativas (es decir, opcionales) también pueden vivir en condiciones aeróbicas. La desnitrificación ocurre en condiciones anaeróbicas, por ejemplo, suelos anegados. Las bacterias desnitrificantes utilizan nitratos del suelo para llevar a cabo la respiración y, en consecuencia, producen gas nitrógeno, que es inerte y no está disponible para las plantas. La desnitrificación ocurre en microorganismos de vida libre, así como en simbiontes obligados de ciliados anaeróbicos. [29]
La reducción disimilatoria de nitrato a amonio (DNRA), o amonificación de nitrato/nitrito, es un proceso de respiración anaeróbica . Los microbios que realizan la DNRA oxidan la materia orgánica y utilizan el nitrato como aceptor de electrones, reduciéndolo a nitrito y luego a amonio ( NO−3 → NO−2 → Nuevo Hampshire+4). [30] Tanto las bacterias desnitrificantes como las amonificadoras de nitrato competirán por el nitrato en el medio ambiente, aunque la DNRA actúa para conservar el nitrógeno biodisponible como amonio soluble en lugar de producir gas dinitrógeno. [31]
El proceso de oxidación aeróbica del AMM onia AN también se conoce como proceso ANAMMOX , una abreviatura acuñada mediante la unión de las primeras sílabas de cada una de estas tres palabras. Este proceso biológico es una reacción de composición redox , en la que el amoníaco (el agente reductor que da electrones) y el nitrito (el agente oxidante que acepta electrones) transfieren tres electrones y se convierten en una molécula de nitrógeno diatómico ( N
2) gas y dos moléculas de agua. Este proceso constituye una proporción importante de la conversión de nitrógeno en los océanos . La fórmula estequiométricamente equilibrada para la reacción química ANAMMOX se puede escribir de la siguiente manera, donde un ion amonio incluye la molécula de amoniaco, su base conjugada :
Se trata de un proceso exergónico (aquí también una reacción exotérmica ) que libera energía, como lo indica el valor negativo de Δ G °, la diferencia en energía libre de Gibbs entre los productos de la reacción y los reactivos.
Aunque la fijación de nitrógeno es la fuente principal de nitrógeno disponible para las plantas en la mayoría de los ecosistemas , en áreas con lecho rocoso rico en nitrógeno , la descomposición de esta roca también sirve como fuente de nitrógeno. [33] [34] [35] La reducción de nitrato también es parte del ciclo del hierro ; en condiciones anóxicas, el Fe(II) puede donar un electrón al NO.−3y se oxida a Fe(III) mientras que NO−3se reduce a NO−2, N2O , N2 y NH+4dependiendo de las condiciones y especies microbianas involucradas. [36] Las columnas fecales de los cetáceos también actúan como una unión en el ciclo del nitrógeno marino, concentrando el nitrógeno en las zonas epipelágicas de los ambientes oceánicos antes de su dispersión a través de varias capas marinas, mejorando en última instancia la productividad primaria oceánica. [37]
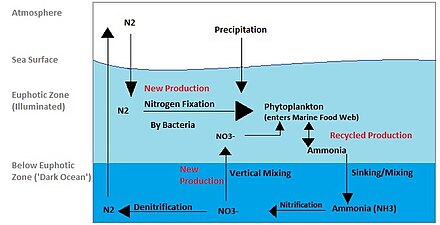


El ciclo del nitrógeno también es un proceso importante en el océano. Si bien el ciclo general es similar, existen diferentes actores [40] y modos de transferencia de nitrógeno en el océano. El nitrógeno ingresa al agua a través de la precipitación, la escorrentía o como N
2de la atmósfera. El fitoplancton no puede utilizar el nitrógeno como N
2por lo que debe sufrir fijación de nitrógeno que es realizada predominantemente por cianobacterias . [41] Sin suministros de nitrógeno fijado entrando al ciclo marino, el nitrógeno fijado se consumiría en aproximadamente 2000 años. [42] El fitoplancton necesita nitrógeno en formas biológicamente disponibles para la síntesis inicial de materia orgánica. El amoníaco y la urea son liberados al agua por excreción del plancton. Las fuentes de nitrógeno son removidas de la zona eufótica por el movimiento descendente de la materia orgánica. Esto puede ocurrir por el hundimiento del fitoplancton, mezcla vertical o hundimiento de desechos de migradores verticales. El hundimiento da como resultado que el amoníaco se introduzca a profundidades más bajas debajo de la zona eufótica. Las bacterias pueden convertir el amoníaco en nitrito y nitrato, pero son inhibidas por la luz, por lo que esto debe ocurrir debajo de la zona eufótica. [43] La amonificación o mineralización es realizada por bacterias para convertir nitrógeno orgánico en amoníaco. Luego puede ocurrir la nitrificación para convertir el amonio en nitrito y nitrato. [44] El nitrato puede regresar a la zona eufótica mediante mezcla vertical y afloramiento, donde puede ser absorbido por el fitoplancton para continuar el ciclo .
2Puede devolverse a la atmósfera mediante desnitrificación .
Se cree que el amonio es la fuente preferida de nitrógeno fijado para el fitoplancton porque su asimilación no implica una reacción redox y, por lo tanto, requiere poca energía. El nitrato requiere una reacción redox para su asimilación, pero es más abundante, por lo que la mayoría del fitoplancton se ha adaptado para tener las enzimas necesarias para llevar a cabo esta reducción ( nitrato reductasa ). Hay algunas excepciones notables y bien conocidas que incluyen la mayoría de Prochlorococcus y algunos Synechococcus que solo pueden absorber nitrógeno como amonio. [42]
Los nutrientes del océano no se distribuyen de manera uniforme. Las áreas de afloramiento proporcionan nitrógeno desde debajo de la zona eufótica. Las zonas costeras proporcionan nitrógeno a partir de la escorrentía y el afloramiento se produce fácilmente a lo largo de la costa. Sin embargo, la velocidad a la que el fitoplancton puede absorber nitrógeno disminuye en aguas oligotróficas durante todo el año y en aguas templadas en verano, lo que da como resultado una menor producción primaria. [45] La distribución de las diferentes formas de nitrógeno también varía a lo largo de los océanos.
El nitrato se agota en las aguas cercanas a la superficie, excepto en las regiones de surgencia. Las regiones costeras de surgencia suelen tener altos niveles de nitrato y clorofila como resultado del aumento de la producción. Sin embargo, hay regiones con alto contenido de nitrato en la superficie pero bajo contenido de clorofila, que se conocen como regiones HNLC (alto contenido de nitrógeno y baja cantidad de clorofila). La mejor explicación para las regiones HNLC se relaciona con la escasez de hierro en el océano, que puede desempeñar un papel importante en la dinámica oceánica y los ciclos de nutrientes. El aporte de hierro varía según la región y llega al océano a través del polvo (de las tormentas de polvo ) y se lixivia de las rocas. Se considera que el hierro es el verdadero elemento limitante de la productividad de los ecosistemas en el océano.
El amonio y el nitrito muestran una concentración máxima a 50–80 m (extremo inferior de la zona eufótica ) con una concentración decreciente por debajo de esa profundidad. Esta distribución puede explicarse por el hecho de que el nitrito y el amonio son especies intermedias. Ambos se producen y consumen rápidamente a través de la columna de agua. [42] La cantidad de amonio en el océano es aproximadamente 3 órdenes de magnitud menor que el nitrato. [42] Entre el amonio, el nitrito y el nitrato, el nitrito tiene la tasa de renovación más rápida. Puede producirse durante la asimilación, nitrificación y desnitrificación del nitrato; sin embargo, se consume de nuevo inmediatamente.
El nitrógeno que entra en la zona eufótica se denomina nitrógeno nuevo porque recién llega desde fuera de la capa productiva. [41] El nitrógeno nuevo puede provenir de debajo de la zona eufótica o de fuentes externas. Las fuentes externas son el afloramiento de aguas profundas y la fijación de nitrógeno. Si la materia orgánica es ingerida, respirada, entregada al agua como amoníaco y reincorporada a la materia orgánica por el fitoplancton, se considera producción reciclada/regenerada.
La nueva producción es un componente importante del medio marino. Una de las razones es que sólo el aporte continuo de nitrógeno nuevo puede determinar la capacidad total del océano para producir una cosecha de peces sostenible. [45] La recolección de peces de zonas de nitrógeno regenerado conducirá a una disminución del nitrógeno y, por lo tanto, a una disminución de la producción primaria. Esto tendrá un efecto negativo en el sistema. Sin embargo, si se recolectan peces de zonas de nitrógeno nuevo, el nitrógeno se repondrá.
Como lo ilustra el diagrama de la derecha, el dióxido de carbono (CO 2 ) adicional es absorbido por el océano y reacciona con el agua, el ácido carbónico ( H
2CO
3) se forma y se descompone en bicarbonato ( HCO−3) y el hidrógeno ( H+) iones (flecha gris), lo que reduce el carbonato biodisponible ( CO2−3) y disminuye el pH del océano (flecha negra). Es probable que esto mejore la fijación de nitrógeno por los diazótrofos (flecha gris), que utilizan H+
iones para convertir el nitrógeno en formas biodisponibles como el amoníaco ( NH
3) y iones amonio ( NH+4). Sin embargo, a medida que el pH disminuye y más amoníaco se convierte en iones de amonio (flecha gris), hay menos oxidación de amoníaco a nitrito (NO–
2), lo que da como resultado una disminución general de la nitrificación y la desnitrificación (flechas negras). Esto, a su vez, conduciría a una mayor acumulación de nitrógeno fijado en el océano, con la posible consecuencia de la eutrofización . Las flechas grises representan un aumento, mientras que las flechas negras representan una disminución del proceso asociado. [39]
.jpg/440px-Global_-_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_Fertilizer_Application_(6074011960).jpg)
.jpg/440px-Global_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_in_Manure_Production_(6173194512).jpg)
Como resultado del cultivo extensivo de legumbres (en particular, soja , alfalfa y trébol ), el uso creciente del proceso Haber-Bosch en la producción de fertilizantes químicos y la contaminación emitida por vehículos y plantas industriales, los seres humanos han más que duplicado la transferencia anual de nitrógeno en formas biológicamente disponibles. [28] Además, los seres humanos han contribuido significativamente a la transferencia de gases traza de nitrógeno de la Tierra a la atmósfera y de la tierra a los sistemas acuáticos. Las alteraciones humanas al ciclo global del nitrógeno son más intensas en los países desarrollados y en Asia, donde las emisiones de los vehículos y la agricultura industrial son más altas. [46]
La generación de Nr, nitrógeno reactivo , ha aumentado más de diez veces en el último siglo debido a la industrialización global . [2] [47] Esta forma de nitrógeno sigue una cascada a través de la biosfera mediante una variedad de mecanismos, y se acumula a medida que la tasa de su generación es mayor que la tasa de desnitrificación . [48]
Óxido nitroso ( N
2O ) ha aumentado en la atmósfera como resultado de la fertilización agrícola, la quema de biomasa, el ganado y los corrales de engorde, y fuentes industriales. [49] N
2El O tiene efectos nocivos en la estratosfera , donde se descompone y actúa como catalizador en la destrucción del ozono atmosférico . El óxido nitroso también es un gas de efecto invernadero y actualmente es el tercer mayor contribuyente al calentamiento global , después del dióxido de carbono y el metano . Si bien no es tan abundante en la atmósfera como el dióxido de carbono, es, para una masa equivalente, casi 300 veces más potente en su capacidad para calentar el planeta. [50]
Amoniaco ( NH
3) en la atmósfera se ha triplicado como resultado de las actividades humanas. Es un reactivo en la atmósfera, donde actúa como un aerosol , disminuyendo la calidad del aire y adhiriéndose a las gotas de agua, lo que finalmente da como resultado ácido nítrico ( H NO 3 ) que produce lluvia ácida . El amoníaco atmosférico y el ácido nítrico también dañan los sistemas respiratorios.
La altísima temperatura de los rayos produce naturalmente pequeñas cantidades de NO
incógnita, Nueva Hampshire
3, y HNO
3, pero la combustión a alta temperatura ha contribuido a un aumento de 6 o 7 veces en el flujo de NO
incógnitaa la atmósfera. Su producción es función de la temperatura de combustión: cuanto más alta sea la temperatura, más NO
incógnitaLa combustión de combustibles fósiles es un contribuyente principal, pero también lo son los biocombustibles e incluso la quema de hidrógeno. Sin embargo, la velocidad a la que se inyecta hidrógeno directamente en las cámaras de combustión de los motores de combustión interna se puede controlar para evitar las temperaturas de combustión más altas que producen NO
incógnita.
El amoníaco y los óxidos nitrosos alteran activamente la química atmosférica . Son precursores de la producción de ozono troposférico (atmósfera inferior), que contribuye al smog y la lluvia ácida , daña las plantas y aumenta los aportes de nitrógeno a los ecosistemas. Los procesos ecosistémicos pueden aumentar con la fertilización nitrogenada , pero los aportes antropogénicos también pueden dar lugar a una saturación de nitrógeno, lo que debilita la productividad y puede dañar la salud de las plantas, los animales, los peces y los seres humanos. [28]
También puede haber disminuciones en la biodiversidad si una mayor disponibilidad de nitrógeno aumenta los pastos que lo demandan, causando una degradación de brezales pobres en nitrógeno y con gran diversidad de especies . [51]

Se ha demostrado que el aumento de los niveles de deposición de nitrógeno tiene varios efectos adversos en los ecosistemas terrestres y acuáticos . [52] [53] Los gases y aerosoles de nitrógeno pueden ser directamente tóxicos para ciertas especies de plantas, afectando la fisiología de la superficie y el crecimiento de las plantas cerca de grandes fuentes puntuales de contaminación por nitrógeno. También pueden producirse cambios en las especies de plantas a medida que la acumulación de compuestos de nitrógeno aumenta la disponibilidad en un ecosistema determinado, lo que acaba modificando la composición de las especies, la diversidad de las plantas y el ciclo del nitrógeno. El amoníaco y el amonio (dos formas reducidas de nitrógeno) pueden ser perjudiciales con el tiempo debido a la mayor toxicidad para las especies de plantas sensibles, [54] en particular las que están acostumbradas a utilizar el nitrato como fuente de nitrógeno, lo que provoca un desarrollo deficiente de sus raíces y brotes. El aumento de la deposición de nitrógeno también conduce a la acidificación del suelo, lo que aumenta la lixiviación de cationes básicos en el suelo y las cantidades de aluminio y otros metales potencialmente tóxicos, además de disminuir la cantidad de nitrificación que se produce y aumentar la hojarasca derivada de las plantas. Debido a los cambios constantes causados por la alta deposición de nitrógeno, la susceptibilidad de un ambiente al estrés y las perturbaciones ecológicas (como plagas y patógenos ) puede aumentar, volviéndolo así menos resistente a situaciones que de otro modo tendrían poco impacto en su vitalidad a largo plazo.
Los riesgos adicionales que plantea la mayor disponibilidad de nitrógeno inorgánico en los ecosistemas acuáticos incluyen la acidificación del agua; la eutrofización de los sistemas de agua dulce y salada; y problemas de toxicidad para los animales, incluidos los humanos. [55] La eutrofización a menudo conduce a niveles más bajos de oxígeno disuelto en la columna de agua, incluidas condiciones hipóxicas y anóxicas, que pueden causar la muerte de la fauna acuática. Los bentos relativamente sésiles, o criaturas que viven en el fondo, son particularmente vulnerables debido a su falta de movilidad, aunque las muertes de grandes peces no son infrecuentes. Las zonas muertas oceánicas cerca de la desembocadura del Mississippi en el Golfo de México son un ejemplo bien conocido de hipoxia inducida por la floración de algas . [56] [57] Los lagos Adirondack de Nueva York , Catskills , Hudson Highlands , Rensselaer Plateau y partes de Long Island muestran el impacto de la deposición de lluvia de ácido nítrico , que resulta en la muerte de peces y muchas otras especies acuáticas. [58]
Amoniaco ( NH
3) es altamente tóxico para los peces y el nivel de amoníaco que se descarga desde las instalaciones de tratamiento de aguas residuales debe ser monitoreado de cerca. La nitrificación mediante aireación antes de la descarga suele ser conveniente para evitar la muerte de los peces. La aplicación en la tierra puede ser una alternativa atractiva a la aireación.
Las fugas de nitrógeno reactivo (Nr) provenientes de las actividades humanas pueden causar la acumulación de nitratos en el entorno acuático natural, lo que puede crear impactos nocivos para la salud humana. El uso excesivo de fertilizantes nitrogenados en la agricultura ha sido una fuente importante de contaminación por nitratos en las aguas subterráneas y superficiales. [59] [60] Debido a su alta solubilidad y baja retención por el suelo, el nitrato puede escapar fácilmente de la capa del subsuelo a las aguas subterráneas, causando contaminación por nitratos. Otras fuentes no puntuales de contaminación por nitratos en las aguas subterráneas se originan en la alimentación del ganado, la contaminación animal y humana y los desechos municipales e industriales. Dado que las aguas subterráneas a menudo sirven como el principal suministro de agua para uso doméstico, la contaminación por nitratos puede extenderse de las aguas subterráneas a las superficiales y al agua potable durante la producción de agua potable , especialmente en el caso de los pequeños suministros de agua para comunidades, donde se utilizan aguas poco reguladas y no sanitarias. [61]
El estándar de la OMS para el agua potable es de 50 mg de NO−3L −1 para exposición a corto plazo y para 3 mg de NO−3L −1 efectos crónicos. [62] Una vez que ingresa al cuerpo humano, el nitrato puede reaccionar con compuestos orgánicos a través de reacciones de nitrosación en el estómago para formar nitrosaminas y nitrosamidas , que están involucradas en algunos tipos de cánceres (por ejemplo, cáncer oral y cáncer gástrico ). [63]
Las actividades humanas también han alterado drásticamente el ciclo global del nitrógeno al producir gases nitrogenados asociados con la contaminación atmosférica global por nitrógeno. Existen múltiples fuentes de flujos atmosféricos de nitrógeno reactivo (Nr). Las fuentes agrícolas de nitrógeno reactivo pueden producir emisiones atmosféricas de amoníaco ( NH 3 ), óxidos de nitrógeno ( NO
incógnita) y óxido nitroso ( N
2O ). Los procesos de combustión en la producción de energía, el transporte y la industria también pueden formar nuevo nitrógeno reactivo a través de la emisión de NO
incógnita, un producto de desecho no intencional. Cuando esos nitrógenos reactivos se liberan a la atmósfera inferior, pueden inducir la formación de smog, material particulado y aerosoles, todos los cuales son importantes contribuyentes a los efectos adversos para la salud humana de la contaminación del aire. [64] En la atmósfera, NO
2puede oxidarse a ácido nítrico ( HNO
3), y puede reaccionar además con NH
3para formar nitrato de amonio ( NH 4 NO 3 ), lo que facilita la formación de nitrato particulado. Además, NH
3Puede reaccionar con otros gases ácidos ( ácidos sulfúrico y clorhídrico ) para formar partículas que contienen amonio, que son los precursores de las partículas de aerosol orgánico secundario en el smog fotoquímico . [65]
{{cite web}}: CS1 maint: multiple names: authors list (link){{cite book}}: CS1 maint: multiple names: authors list (link)