
Un gas respirable es una mezcla de elementos químicos gaseosos y compuestos que se utilizan para la respiración . El aire es el gas respirable natural más común y único, pero también se utilizan otras mezclas de gases, o el oxígeno puro, en equipos de respiración y hábitats cerrados. El oxígeno es el componente esencial de cualquier gas respirable. Los gases respirables para uso hiperbárico se han desarrollado para mejorar el rendimiento del aire ordinario al reducir el riesgo de enfermedad por descompresión , reducir la duración de la descompresión , reducir la narcosis por nitrógeno o permitir un buceo profundo más seguro .
Un gas respirable es una mezcla de elementos químicos gaseosos y compuestos que se utilizan para la respiración . El aire es el gas respirable natural más común y el único. Otras mezclas de gases, u oxígeno puro , también se utilizan en equipos de respiración y hábitats cerrados, como equipos de buceo , equipos de buceo con suministro desde la superficie , cámaras de recompresión , montañismo de gran altitud , aeronaves de alto vuelo , submarinos , trajes espaciales , naves espaciales , equipos de primeros auxilios y soporte vital médico y máquinas de anestesia . [1] [2] [3]
El oxígeno es el componente esencial de cualquier gas respirable, a una presión parcial de entre aproximadamente 0,16 y 1,60 bar a la presión ambiente , ocasionalmente menor para el montañismo a gran altitud , o mayor para el tratamiento con oxígeno hiperbárico . El oxígeno suele ser el único componente metabólicamente activo a menos que el gas sea una mezcla anestésica. Parte del oxígeno del gas respirable se consume en los procesos metabólicos, y los componentes inertes no se modifican y sirven principalmente para diluir el oxígeno a una concentración adecuada, por lo que también se conocen como gases diluyentes.
Por lo tanto, la mayoría de los gases respirables son una mezcla de oxígeno y uno o más gases metabólicamente inertes . [1] [3] Los gases respirables para uso hiperbárico se han desarrollado para mejorar el rendimiento del aire ordinario al reducir el riesgo de enfermedad por descompresión , reducir la duración de la descompresión , reducir la narcosis por nitrógeno o permitir un buceo profundo más seguro . [1] [3] Las técnicas utilizadas para llenar cilindros de buceo con gases distintos del aire se denominan mezcla de gases . [4] [5]
Los gases respirables que se utilizan a presiones ambientales inferiores a la presión atmosférica normal suelen ser oxígeno puro o aire enriquecido con oxígeno para proporcionar suficiente oxígeno para mantener la vida y la conciencia, o para permitir niveles de esfuerzo más elevados que los que serían posibles utilizando aire. Es habitual proporcionar el oxígeno adicional como gas puro añadido al aire respirable en la inhalación o a través de un sistema de soporte vital.

Un gas respirable seguro para uso hiperbárico tiene cuatro características esenciales:
Se utilizan estos gases respirables comunes para el buceo:
El aire respirable es aire atmosférico con un nivel de pureza adecuado para la respiración humana en la aplicación especificada. Para uso hiperbárico, la presión parcial de contaminantes se incrementa en proporción a la presión absoluta y debe limitarse a una composición segura para la profundidad o el rango de presión en el que se va a utilizar.
Los gases respirables para el buceo se clasifican según la fracción de oxígeno. Los límites establecidos por las autoridades pueden diferir ligeramente, ya que los efectos varían gradualmente con la concentración y entre personas, y no son predecibles con precisión. [ cita requerida ]
Los gases respirables para el buceo se mezclan a partir de una pequeña cantidad de gases componentes que proporcionan a la mezcla características especiales que no están disponibles en el aire atmosférico.
El oxígeno (O 2 ) debe estar presente en todos los gases que respiramos. [1] [2] [3] Esto se debe a que es esencial para el proceso metabólico del cuerpo humano , que sustenta la vida. El cuerpo humano no puede almacenar oxígeno para su uso posterior como lo hace con los alimentos. Si el cuerpo se ve privado de oxígeno durante más de unos pocos minutos, se produce pérdida de conocimiento y muerte. Los tejidos y órganos dentro del cuerpo (en particular el corazón y el cerebro) se dañan si se les priva de oxígeno durante mucho más de cuatro minutos.
Llenar un cilindro de buceo con oxígeno puro cuesta aproximadamente cinco veces más que llenarlo con aire comprimido. Como el oxígeno favorece la combustión y provoca óxido en los cilindros de buceo , debe manipularse con precaución al mezclar gases . [4] [5]
Históricamente, el oxígeno se ha obtenido mediante destilación fraccionada de aire líquido , pero cada vez se obtiene más mediante tecnologías no criogénicas, como la adsorción por oscilación de presión (PSA) y la adsorción por oscilación de vacío (VSA). [21]
La fracción del componente de oxígeno de una mezcla de gases respirables a veces se utiliza para nombrar la mezcla:
La fracción de oxígeno determina la profundidad máxima a la que se puede utilizar la mezcla de forma segura para evitar la toxicidad del oxígeno . Esta profundidad se denomina profundidad máxima de operación . [1] [3] [7] [10]
La concentración de oxígeno en una mezcla de gases depende de la fracción y de la presión de la mezcla. Se expresa mediante la presión parcial de oxígeno (P O 2 ). [1] [3] [7] [10]
La presión parcial de cualquier gas componente de una mezcla se calcula como:
Para el componente de oxígeno,
dónde:
La presión parcial mínima segura de oxígeno en un gas respirable se considera comúnmente de 16 kPa (0,16 bar). Por debajo de esta presión parcial, el buceador puede correr el riesgo de perder el conocimiento y morir debido a la hipoxia , dependiendo de factores como la fisiología individual y el nivel de esfuerzo. Cuando se respira una mezcla hipóxica en aguas poco profundas, es posible que no tenga una P O 2 lo suficientemente alta como para mantener al buceador consciente. Por este motivo, se utilizan "gases de viaje" normóxicos o hiperóxicos a profundidades medias entre las fases de "fondo" y "descompresión" de la inmersión.
La P O 2 máxima segura en un gas respirable depende del tiempo de exposición, el nivel de ejercicio y la seguridad del equipo de respiración que se utilice. Normalmente está entre 100 kPa (1 bar) y 160 kPa (1,6 bar); para inmersiones de menos de tres horas, se considera comúnmente que es de 140 kPa (1,4 bar), aunque se sabe que la Marina de los EE. UU. autoriza inmersiones con una P O 2 de hasta 180 kPa (1,8 bar). [1] [2] [3] [7] [10] Con exposiciones altas a P O 2 o más prolongadas, el buceador corre el riesgo de sufrir toxicidad por oxígeno que puede provocar una convulsión . [1] [2] Cada gas respirable tiene una profundidad operativa máxima que está determinada por su contenido de oxígeno. [1] [2] [3] [7] [10] Para la recompresión terapéutica y la terapia con oxígeno hiperbárico, se utilizan comúnmente presiones parciales de 2,8 bar en la cámara, pero no hay riesgo de ahogamiento si el ocupante pierde el conocimiento. [2] Para períodos más largos, como en el buceo de saturación , se pueden tolerar 0,4 bar durante varias semanas.
Los analizadores de oxígeno se utilizan para medir la presión parcial de oxígeno en la mezcla de gases. [4]
Divox es oxígeno de grado respirable etiquetado para uso en buceo. En los Países Bajos , el oxígeno puro para fines respiratorios se considera medicinal a diferencia del oxígeno industrial, como el que se utiliza en soldadura , y solo está disponible con receta médica . La industria del buceo registró Divox como marca comercial de oxígeno de grado respirable para eludir las estrictas normas relativas al oxígeno medicinal, lo que facilita a los buceadores (recreativos) obtener oxígeno para mezclar su gas respirable. En la mayoría de los países, no hay diferencia de pureza entre el oxígeno médico y el oxígeno industrial, ya que se producen exactamente con los mismos métodos y fabricantes, pero se etiquetan y se llenan de forma diferente. La principal diferencia entre ellos es que el registro de fabricación es mucho más extenso en el caso del oxígeno médico, para identificar más fácilmente el registro de fabricación exacto de un "lote" o partida de oxígeno, en caso de que se descubran problemas con su pureza. El oxígeno de grado de aviación es similar al oxígeno médico, pero puede tener un menor contenido de humedad. [4]
Los gases que no tienen ninguna función metabólica en el gas respirable se utilizan para diluir el gas, por lo que se clasifican como gases diluyentes. Algunos de ellos tienen un efecto narcótico reversible a alta presión parcial, por lo que deben limitarse para evitar efectos narcóticos excesivos a la presión máxima a la que se pretende respirar. Los gases diluyentes también afectan a la densidad de la mezcla de gases y, por lo tanto, al trabajo respiratorio .
El nitrógeno (N2 ) es un gas diatómico y el principal componente del aire , el gas respirable más barato y más común que se utiliza para bucear. Provoca narcosis por nitrógeno en el buceador, por lo que su uso se limita a inmersiones más superficiales. El nitrógeno puede provocar enfermedad por descompresión . [1] [2] [3] [22]
La profundidad equivalente en el aire se utiliza para estimar los requisitos de descompresión de una mezcla de nitrox (oxígeno/nitrógeno). La profundidad equivalente en narcóticos se utiliza para estimar la potencia narcótica del trimix (mezcla de oxígeno/helio/nitrógeno). Muchos buceadores consideran que el nivel de narcosis causado por una inmersión de 30 m (100 pies), mientras se respira aire, es un máximo confortable. [1] [2] [3] [23] [24]
El nitrógeno en una mezcla de gases casi siempre se obtiene agregando aire a la mezcla.

El helio (He) es un gas inerte que es menos narcótico que el nitrógeno a presión equivalente (de hecho, no hay evidencia alguna de narcosis causada por el helio), y tiene una densidad mucho menor, por lo que es más adecuado para inmersiones más profundas que el nitrógeno. [1] [3] El helio también puede causar enfermedad por descompresión . A altas presiones, el helio también causa el síndrome nervioso de alta presión , que es un síndrome de irritación del sistema nervioso central que, en algunos aspectos, es opuesto a la narcosis. [1] [2] [3] [25]
Los rellenos de mezcla de helio son considerablemente más caros que los rellenos de aire debido al costo del helio y al costo de mezclar y comprimir la mezcla. [ cita requerida ]
El helio no es adecuado para el inflado de trajes secos debido a sus pobres propiedades de aislamiento térmico : en comparación con el aire, que se considera un aislante razonable, el helio tiene seis veces la conductividad térmica. [26] El bajo peso molecular del helio (PM monoatómico = 4, comparado con el PM del nitrógeno diatómico = 28) aumenta el timbre de la voz del respirador, lo que puede impedir la comunicación. [1] [3] [27] Esto se debe a que la velocidad del sonido es más rápida en un gas de menor peso molecular, lo que aumenta la frecuencia de resonancia de las cuerdas vocales. [1] [27] El helio se fuga de válvulas dañadas o defectuosas más fácilmente que otros gases porque los átomos de helio son más pequeños, lo que les permite pasar a través de espacios más pequeños en los sellos .
El helio se encuentra en cantidades significativas sólo en el gas natural , del que se extrae a bajas temperaturas mediante destilación fraccionada.
El neón (Ne) es un gas inerte que se utiliza a veces en el buceo comercial profundo, pero es muy caro. [1] [3] [11] [17] Al igual que el helio, es menos narcótico que el nitrógeno, pero a diferencia del helio, no distorsiona la voz del buceador. En comparación con el helio, el neón tiene propiedades de aislamiento térmico superiores. [28]
El hidrógeno (H 2 ) se ha utilizado en mezclas de gases para buceo profundo, pero es muy explosivo cuando se mezcla con más de un 4 a 5 % de oxígeno (como el oxígeno que se encuentra en el gas respirable). [1] [3] [11] [14] Esto limita el uso de hidrógeno a inmersiones profundas e impone protocolos complicados para garantizar que se elimine el exceso de oxígeno del equipo de respiración antes de comenzar a respirar hidrógeno. Al igual que el helio, eleva el timbre de la voz del buceador. La mezcla de hidrógeno y oxígeno cuando se usa como gas de buceo a veces se denomina Hydrox . Las mezclas que contienen hidrógeno y helio como diluyentes se denominan Hydreliox.
Muchos gases no son adecuados para su uso como gases respirables para buceo. [5] [29] A continuación se presenta una lista incompleta de gases comúnmente presentes en un entorno de buceo:
El argón (Ar) es un gas inerte que es más narcótico que el nitrógeno, por lo que no suele ser adecuado como gas respirable para buceo. [30] El argón se utiliza para la investigación de la descompresión. [1] [3] [31] [32] A veces lo utilizan para el inflado de trajes secos los buceadores cuyo gas respirable principal es el helio, debido a las buenas propiedades de aislamiento térmico del argón. El argón es más caro que el aire o el oxígeno, pero considerablemente menos caro que el helio. El argón es un componente del aire natural y constituye el 0,934 % en volumen de la atmósfera terrestre. [33]
El dióxido de carbono (CO 2 ) es producido por el metabolismo en el cuerpo humano y puede causar intoxicación por dióxido de carbono . [29] [34] [35] Cuando el gas respirable se recicla en un rebreather o en un sistema de soporte vital , el dióxido de carbono se elimina mediante depuradores antes de que el gas se reutilice.
El monóxido de carbono (CO) es un gas altamente tóxico que compite con el dioxígeno para unirse a la hemoglobina, impidiendo así que la sangre transporte oxígeno (ver intoxicación por monóxido de carbono ). Generalmente se produce por combustión incompleta . [1] [2] [5] [29] Cuatro fuentes comunes son:
En general, se evita el monóxido de carbono en la medida de lo posible colocando la entrada de aire en un lugar no contaminado, filtrando las partículas del aire de entrada, utilizando un diseño de compresor adecuado y lubricantes apropiados, y garantizando que las temperaturas de funcionamiento no sean excesivas. Cuando el riesgo residual es excesivo, se puede utilizar un catalizador de hopcalita en el filtro de alta presión para convertir el monóxido de carbono en dióxido de carbono, que es mucho menos tóxico.
Los hidrocarburos (C x H y ) están presentes en los lubricantes y combustibles de los compresores . Pueden ingresar a los cilindros de buceo como resultado de contaminación, fugas, [ aclaración necesaria ] o debido a una combustión incompleta cerca de la entrada de aire. [2] [4] [5] [29] [36]
El proceso de compresión de gas en un cilindro de buceo elimina la humedad del gas. [5] [29] Esto es bueno para la prevención de la corrosión en el cilindro, pero significa que el buceador inhala gas muy seco. El gas seco extrae humedad de los pulmones del buceador mientras está bajo el agua, lo que contribuye a la deshidratación , que también se cree que es un factor de riesgo predisponente de la enfermedad por descompresión . También es incómodo, causando sequedad en la boca y la garganta y haciendo que el buceador tenga sed. Este problema se reduce en los rebreathers porque la reacción de la cal sodada , que elimina el dióxido de carbono, también devuelve la humedad al gas respirable, [9] y la humedad relativa y la temperatura del gas exhalado son relativamente altas y hay un efecto acumulativo debido a la re-inhalación. [38] En climas cálidos, el buceo en circuito abierto puede acelerar el agotamiento por calor debido a la deshidratación. Otra preocupación con respecto al contenido de humedad es la tendencia de la humedad a condensarse a medida que el gas se descomprime al pasar por el regulador; Esto, junto con la reducción extrema de la temperatura, también debido a la descompresión, puede hacer que la humedad se solidifique en forma de hielo. Esta formación de hielo en un regulador puede provocar que las piezas móviles se atasquen y que el regulador falle o deje de fluir. Esta es una de las razones por las que los reguladores de buceo generalmente se construyen de latón y se croman (para protegerlos). El latón, con sus buenas propiedades de conducción térmica, conduce rápidamente el calor del agua circundante al aire frío recién descomprimido, lo que ayuda a evitar la formación de hielo.

Las mezclas de gases generalmente deben analizarse durante el proceso o después de la mezcla para el control de calidad. Esto es particularmente importante para las mezclas de gases respirables donde los errores pueden afectar la salud y la seguridad del usuario final. Es difícil detectar la mayoría de los gases que probablemente estén presentes en los cilindros de buceo porque son incoloros, inodoros e insípidos. Existen sensores electrónicos para algunos gases, como analizadores de oxígeno , analizadores de helio , detectores de monóxido de carbono y detectores de dióxido de carbono . [2] [4] [5] Los analizadores de oxígeno se encuentran comúnmente bajo el agua en los rebreathers . [9] Los analizadores de oxígeno y helio se utilizan a menudo en la superficie durante la mezcla de gases para determinar el porcentaje de oxígeno o helio en una mezcla de gases respirables. [4] Los métodos químicos y de otro tipo de detección de gases no se utilizan a menudo en el buceo recreativo, pero se utilizan para pruebas periódicas de calidad del aire respirable comprimido de los compresores de aire de buceo. [4]
Las normas de calidad de los gases respirables son publicadas por organizaciones nacionales e internacionales y pueden aplicarse en términos de legislación. En el Reino Unido, la Dirección de Salud y Seguridad indica que los requisitos de los gases respirables para buceadores se basan en la norma BS EN 12021:2014. Las especificaciones se enumeran para aire compatible con oxígeno, mezclas de nitrox producidas mediante la adición de oxígeno, la eliminación de nitrógeno o la mezcla de nitrógeno y oxígeno, mezclas de helio y oxígeno (heliox), mezclas de helio, nitrógeno y oxígeno (trimix) y oxígeno puro, tanto para sistemas de circuito abierto como de recuperación, y para suministro de alta y baja presión (suministro por encima y por debajo de 40 bar). [39]
El contenido de oxígeno es variable dependiendo de la profundidad de operación, pero la tolerancia depende del rango de fracción de gas, siendo ±0,25% para una fracción de oxígeno por debajo del 10% en volumen, ±0,5% para una fracción entre el 10% y el 20%, y ±1% para una fracción por encima del 20%. [39]
El contenido de agua está limitado por los riesgos de formación de hielo en las válvulas de control y la corrosión de las superficies de contención (una mayor humedad no es un problema fisiológico) y generalmente es un factor del punto de rocío . [39]
Otros contaminantes especificados son el dióxido de carbono, el monóxido de carbono, el petróleo y los hidrocarburos volátiles, que están limitados por sus efectos tóxicos. Otros posibles contaminantes deben analizarse en función de la evaluación de riesgos, y la frecuencia requerida de las pruebas de detección de contaminantes también se basa en la evaluación de riesgos. [39]
En Australia, la calidad del aire respirable está especificada en la Norma Australiana 2299.1, Sección 3.13 Calidad del gas respirable. [40]


La mezcla de gases (o mezclado de gases) de gases respirables para el buceo es el llenado de cilindros de gas con gases respirables distintos del aire .
El llenado de cilindros con una mezcla de gases presenta peligros tanto para el que lo realiza como para el buceador. Durante el llenado existe riesgo de incendio debido al uso de oxígeno y riesgo de explosión debido al uso de gases a alta presión. La composición de la mezcla debe ser segura para la profundidad y la duración de la inmersión planificada. Si la concentración de oxígeno es demasiado pobre, el buceador puede perder el conocimiento debido a la hipoxia y si es demasiado rica, puede desarrollar toxicidad por oxígeno . La concentración de gases inertes, como nitrógeno y helio, se planifica y se controla para evitar la narcosis por nitrógeno y la enfermedad por descompresión.
Los métodos utilizados incluyen la mezcla por lotes mediante presión parcial o por fracción de masa, y procesos de mezcla continua. Las mezclas completadas se analizan para determinar su composición, con el fin de garantizar la seguridad del usuario. La legislación puede exigir a los mezcladores de gases que demuestren su competencia si realizan el llenado para otras personas.
La densidad excesiva de un gas respirable puede aumentar el trabajo respiratorio a niveles intolerables y puede causar retención de dióxido de carbono a densidades más bajas. [6] El helio se utiliza como componente para reducir la densidad, así como para reducir la narcosis en profundidad. Al igual que la presión parcial, la densidad de una mezcla de gases es proporcional a la fracción volumétrica de los gases componentes y a la presión absoluta. Las leyes de los gases ideales son suficientemente precisas para los gases a presiones respirables.
La densidad de una mezcla de gases a una temperatura y presión determinadas se puede calcular como:
dónde
Dado que la fracción de gas F i (fracción volumétrica) de cada gas se puede expresar como V i / (V 1 + V 2 + ... + V n )
por sustitución,

Los gases respirables para uso a presión ambiente reducida se utilizan para vuelos a gran altitud en aeronaves no presurizadas , en vuelos espaciales , particularmente en trajes espaciales , y para montañismo a gran altitud . En todos estos casos, la consideración principal es proporcionar una presión parcial adecuada de oxígeno. En algunos casos, al gas respirable se le agrega oxígeno para lograr una concentración suficiente, y en otros casos, el gas respirable puede ser oxígeno puro o casi puro. Se pueden utilizar sistemas de circuito cerrado para conservar el gas respirable, que puede estar en suministro limitado; en el caso del montañismo, el usuario debe llevar el oxígeno suplementario, y en los vuelos espaciales el costo de elevar masa a órbita es muy alto.
El uso médico de gases respirables distintos del aire incluye aplicaciones de oxigenoterapia y anestesia.

Las personas necesitan oxígeno para el metabolismo celular normal . [42] El aire normalmente contiene un 21 % de oxígeno por volumen. [43] Esto normalmente es suficiente, pero en algunas circunstancias el suministro de oxígeno a los tejidos se ve comprometido.
La terapia de oxígeno , también conocida como oxígeno suplementario, es el uso de oxígeno como tratamiento médico . [44] Esto puede incluir niveles bajos de oxígeno en sangre , toxicidad por monóxido de carbono , dolores de cabeza en racimo y para mantener suficiente oxígeno mientras se administran anestésicos inhalados . [45] El oxígeno a largo plazo suele ser útil en personas con niveles bajos de oxígeno crónicos, como en casos de EPOC grave o fibrosis quística . [46] [44] El oxígeno se puede administrar de varias formas, incluida la cánula nasal , la mascarilla facial y dentro de una cámara hiperbárica . [47] [48]
Las altas concentraciones de oxígeno pueden causar toxicidad por oxígeno, como daño pulmonar, o provocar insuficiencia respiratoria en personas predispuestas. [45] [43] También puede resecar la nariz y aumentar el riesgo de incendios en quienes fuman . La saturación de oxígeno objetivo recomendada depende de la afección que se esté tratando. En la mayoría de las afecciones se recomienda una saturación del 94-98%, mientras que en aquellos con riesgo de retención de dióxido de carbono se prefieren saturaciones del 88-92%, y en aquellos con toxicidad por monóxido de carbono o paro cardíaco la saturación debe ser lo más alta posible. [44]
El uso de oxígeno en medicina se volvió común alrededor de 1917. [49] [50] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [51] [52] El costo del oxígeno domiciliario es de aproximadamente US$150 al mes en Brasil y US$400 al mes en los Estados Unidos. [46] El oxígeno domiciliario puede ser proporcionado por tanques de oxígeno o un concentrador de oxígeno . [44] Se cree que el oxígeno es el tratamiento más común que se administra en los hospitales del mundo desarrollado . [53] [44]


El método más común para la anestesia general es el uso de anestésicos generales inhalados. Cada uno tiene su propia potencia, que se correlaciona con su solubilidad en aceite. Esta relación existe porque los fármacos se unen directamente a las cavidades de las proteínas del sistema nervioso central, [ aclaración necesaria ] aunque se han descrito varias teorías sobre la acción de los anestésicos generales . Se cree que los anestésicos inhalados ejercen sus efectos sobre diferentes partes del sistema nervioso central. Por ejemplo, el efecto inmovilizador de los anestésicos inhalados resulta de un efecto sobre la médula espinal, mientras que la sedación, la hipnosis y la amnesia afectan a zonas del cerebro. [54] : 515
Un anestésico inhalatorio es un compuesto químico que posee propiedades anestésicas generales y que puede administrarse por inhalación. Entre los agentes de gran interés clínico contemporáneo se encuentran los agentes anestésicos volátiles , como el isoflurano , el sevoflurano y el desflurano , y los gases anestésicos, como el óxido nitroso y el xenón .
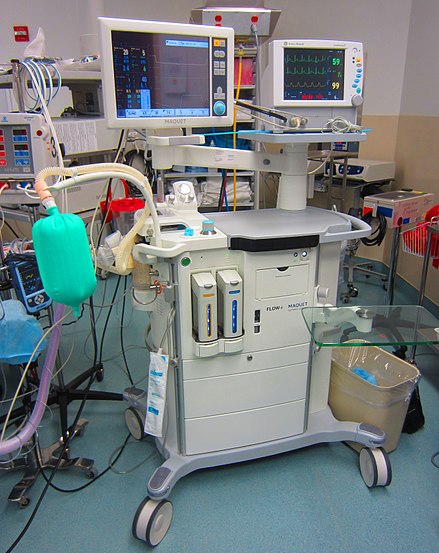
Los gases anestésicos son administrados por anestesistas (un término que incluye anestesiólogos , enfermeras anestesistas y asistentes de anestesiólogos ) a través de una máscara de anestesia, una vía aérea con máscara laríngea o un tubo traqueal conectado a un vaporizador de anestesia y un sistema de suministro de anestesia . La máquina de anestesia (inglés del Reino Unido) o máquina de anestesia (inglés de EE. UU.) o máquina de Boyle se utiliza para apoyar la administración de anestesia . El tipo más común de máquina de anestesia en uso en el mundo desarrollado es la máquina de anestesia de flujo continuo, que está diseñada para proporcionar un suministro preciso y continuo de gases médicos (como oxígeno y óxido nitroso ), mezclados con una concentración precisa de vapor anestésico (como isoflurano ), y entregarlo al paciente a una presión y flujo seguros. Las máquinas modernas incorporan un ventilador , una unidad de succión y dispositivos de monitoreo del paciente . El gas exhalado pasa a través de un depurador para eliminar el dióxido de carbono, y el vapor anestésico y el oxígeno se reponen según sea necesario antes de devolver la mezcla al paciente. [ cita requerida ]