La 17α-hidroxiprogesterona ( 17α-OHP ), también conocida como 17-OH progesterona ( 17-OHP ), [1] o hidroxiprogesterona ( OHP ), es una hormona esteroide progestágena endógena relacionada con la progesterona . [2] [3] [4] También es un intermediario químico en la biosíntesis de muchos otros esteroides endógenos, incluidos andrógenos , estrógenos , glucocorticoides y mineralocorticoides , así como neuroesteroides .
El 17α-OHP es un agonista del receptor de progesterona (PR) de manera similar a la progesterona, aunque débilmente en comparación. [5] Además, es un antagonista del receptor de mineralocorticoides (MR) [6] así como un agonista parcial del receptor de glucocorticoides (GR), aunque con una potencia muy baja ( EC 50 >100 veces menor en relación con el cortisol) . ) en este último sitio, también de manera similar a la progesterona. [5] [7] [8]
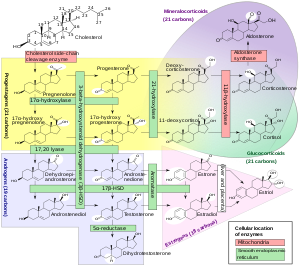
El 17α-OHP se deriva de la progesterona a través de la 17α-hidroxilasa (codificada por CYP17A1 ) [ cita necesaria ]
El 17α-OHP aumenta en el tercer trimestre del embarazo debido principalmente a la producción suprarrenal fetal. [ cita necesaria ]
Este esteroide se produce principalmente en las glándulas suprarrenales y, hasta cierto punto, en las gónadas , específicamente en el cuerpo lúteo del ovario . Los niveles normales son de 3 a 90 ng/dl en niños, y en mujeres, de 20 a 100 ng/dl antes de la ovulación y de 100 a 500 ng/dl durante la fase lútea . [9] [10]
Las mediciones de los niveles de 17α-OHP son útiles en la evaluación de pacientes con sospecha de hiperplasia suprarrenal congénita , ya que las enzimas típicas que son defectuosas, a saber, 21-hidroxilasa y 11β-hidroxilasa , conducen a una acumulación de 17α-OHP. Por el contrario, los raros pacientes con deficiencia de 17α-hidroxilasa tendrán niveles muy bajos o indetectables de 17α-OHP. Los niveles de 17α-OHP también se pueden utilizar para medir la contribución de la actividad progestacional del cuerpo lúteo durante el embarazo como progesterona, pero tenga en cuenta que la placenta también contribuye con 17α-OHP . [ cita necesaria ]
Los inmunoensayos como RIA ( radioinmunoensayo ) o IRMA (ensayo inmunorradiométrico) utilizados para determinar clínicamente el 17α-OHP son propensos a tener reactividad cruzada con los precursores de esteroides 17α-OHP y sus conjugados sulfatados. La cromatografía de gases o líquidos y la espectrometría de masas (por ejemplo, LC-MS/MS) logran una mayor especificidad que los inmunoensayos. [11] [12]
La medición de 17α-OHP mediante LC-MS/MS mejora la detección neonatal de hiperplasia suprarrenal congénita debido a la deficiencia de 21-hidroxilasa , porque los precursores de esteroides 17α-OHP y sus conjugados sulfatados, que están presentes en los primeros dos días después del nacimiento y durante más tiempo en los pre- Los recién nacidos a término presentan reacciones cruzadas en inmunoensayos con 17α-OHP, dando niveles falsamente altos de 17α-OHP. [11] [12]
Aunque el 17α-OHP no se ha utilizado como medicamento, se ha estudiado y revisado su farmacocinética . [13]
Los ésteres de 17α-OHP, como el caproato de hidroxiprogesterona y, en mucha menor medida, el acetato de hidroxiprogesterona y el heptanoato de hidroxiprogesterona , se han utilizado en medicina como progestágenos . [2] [3] [4] Cuando se hace referencia a "hidroxiprogesterona" desde el punto de vista del uso médico, a lo que generalmente se hace referencia es, en general, al caproato de hidroxiprogesterona. [ cita necesaria ]
17α-OHP, también conocido como 17α-hidroxipregn-4-eno-3,20-diona, es un esteroide pregnano natural . Presenta grupos cetona en las posiciones C3 y C20, un grupo hidroxilo en la posición C17α y un doble enlace entre las posiciones C4 y C5. [ cita necesaria ]
El 17α-OHP es el compuesto original de una clase de progestinas denominadas derivados de 17α-hidroxiprogesterona . [14] [15] [16] Entre otros, esta clase de medicamentos incluye acetato de clormadinona , acetato de ciproterona , caproato de hidroxiprogesterona , acetato de medroxiprogesterona y acetato de megestrol . [14] [15] [16]
Hidroxiprogesterona es el nombre genérico del 17α-OHP y su DCIy PROHIBIR. [2] [3] [4]