Un enlace químico es la asociación de átomos o iones para formar moléculas , cristales y otras estructuras. El enlace puede resultar de la fuerza electrostática entre iones con cargas opuestas, como en los enlaces iónicos , o mediante el intercambio de electrones, como en los enlaces covalentes , o de alguna combinación de estos efectos. Los enlaces químicos se describen según su fuerza: existen "enlaces fuertes" o "enlaces primarios", como los enlaces covalentes , iónicos y metálicos , y "enlaces débiles" o "enlaces secundarios", como las interacciones dipolo-dipolo , la fuerza de dispersión de London y los enlaces de hidrógeno .
Como las cargas eléctricas opuestas se atraen, los electrones con carga negativa que rodean el núcleo y los protones con carga positiva dentro de un núcleo se atraen entre sí. Los electrones compartidos entre dos núcleos serán atraídos por ambos. La " interferencia constructiva de la función de onda mecánica cuántica " [1] estabiliza los núcleos emparejados (ver Teorías del enlace químico). Los núcleos enlazados mantienen una distancia óptima (la distancia de enlace) que equilibra los efectos atractivos y repulsivos que se explican cuantitativamente mediante la teoría cuántica . [2] [3]
Los átomos en las moléculas , cristales , metales y otras formas de materia se mantienen unidos por enlaces químicos, que determinan la estructura y las propiedades de la materia.
Todos los enlaces pueden describirse mediante la teoría cuántica , pero, en la práctica, las reglas simplificadas y otras teorías permiten a los químicos predecir la fuerza, la direccionalidad y la polaridad de los enlaces. [4] La regla del octeto y la teoría VSEPR son ejemplos. Las teorías más sofisticadas son la teoría del enlace de valencia , que incluye la hibridación orbital [5] y la resonancia , [6] y la teoría de orbitales moleculares [7] que incluye la combinación lineal de orbitales atómicos y la teoría del campo de ligandos . La electrostática se utiliza para describir las polaridades de los enlaces y los efectos que tienen sobre las sustancias químicas.
Un enlace químico es una atracción entre átomos. Esta atracción puede ser vista como el resultado de diferentes comportamientos de los electrones más externos o de valencia de los átomos. Estos comportamientos se fusionan entre sí sin problemas en diversas circunstancias, de modo que no se puede trazar una línea clara entre ellos. Sin embargo, sigue siendo útil y habitual diferenciar entre diferentes tipos de enlace, que dan lugar a diferentes propiedades de la materia condensada .
En la visión más simple de un enlace covalente , uno o más electrones (a menudo un par de electrones) son atraídos hacia el espacio entre los dos núcleos atómicos. La energía se libera por la formación del enlace. [8] Esto no es como resultado de la reducción de la energía potencial, porque la atracción de los dos electrones hacia los dos protones se compensa con las repulsiones electrón-electrón y protón-protón. En cambio, la liberación de energía (y, por lo tanto, la estabilidad del enlace) surge de la reducción de la energía cinética debido a que los electrones están en un orbital más distribuido espacialmente (es decir, una longitud de onda de De Broglie más larga ) en comparación con cada electrón confinado más cerca de su núcleo respectivo. [9] Estos enlaces existen entre dos átomos identificables particulares y tienen una dirección en el espacio, lo que permite mostrarlos como líneas de conexión individuales entre átomos en dibujos, o modelarlos como palos entre esferas en modelos.
En un enlace covalente polar , uno o más electrones se comparten de forma desigual entre dos núcleos. Los enlaces covalentes a menudo dan lugar a la formación de pequeñas colecciones de átomos mejor conectados llamados moléculas , que en sólidos y líquidos están unidos a otras moléculas por fuerzas que a menudo son mucho más débiles que los enlaces covalentes que mantienen unidas las moléculas internamente. Estos enlaces intermoleculares débiles dan a las sustancias moleculares orgánicas, como ceras y aceites, su carácter blando y sus bajos puntos de fusión (en líquidos, las moléculas deben dejar de estar en contacto estructurado u orientado entre sí). Sin embargo, cuando los enlaces covalentes unen largas cadenas de átomos en moléculas grandes (como en polímeros como el nailon ), o cuando los enlaces covalentes se extienden en redes a través de sólidos que no están compuestos de moléculas discretas (como el diamante o el cuarzo o los minerales de silicato en muchos tipos de roca), entonces las estructuras que resultan pueden ser fuertes y resistentes, al menos en la dirección orientada correctamente con redes de enlaces covalentes. [10] Además, los puntos de fusión de dichos polímeros y redes covalentes aumentan considerablemente.
En una visión simplificada de un enlace iónico , el electrón de enlace no se comparte en absoluto, sino que se transfiere. En este tipo de enlace, el orbital atómico externo de un átomo tiene una vacante que permite la adición de uno o más electrones. Estos electrones recién agregados potencialmente ocupan un estado de energía más bajo (efectivamente más cercano a una mayor carga nuclear) que el que experimentan en un átomo diferente. Por lo tanto, un núcleo ofrece una posición de enlace más firmemente a un electrón que otro núcleo, con el resultado de que un átomo puede transferir un electrón al otro. Esta transferencia hace que un átomo asuma una carga neta positiva y el otro asuma una carga neta negativa. El enlace entonces resulta de la atracción electrostática entre los iones con carga positiva y negativa . Los enlaces iónicos pueden verse como ejemplos extremos de polarización en enlaces covalentes. A menudo, tales enlaces no tienen una orientación particular en el espacio, ya que resultan de la atracción electrostática igual de cada ion hacia todos los iones a su alrededor. Los enlaces iónicos son fuertes (y por ello las sustancias iónicas requieren altas temperaturas para fundirse) pero también frágiles, ya que las fuerzas entre iones son de corto alcance y no salvan fácilmente grietas y fracturas. Este tipo de enlace da lugar a las características físicas de los cristales de sales minerales clásicas, como la sal de mesa.
Un tipo de enlace que se menciona con menos frecuencia es el enlace metálico . En este tipo de enlace, cada átomo de un metal dona uno o más electrones a un "mar" de electrones que residen entre muchos átomos de metal. En este mar, cada electrón es libre (en virtud de su naturaleza ondulatoria ) de asociarse con una gran cantidad de átomos a la vez. El enlace se produce porque los átomos de metal se cargan positivamente debido a la pérdida de sus electrones, mientras que los electrones permanecen atraídos por muchos átomos, sin ser parte de ningún átomo determinado. El enlace metálico puede verse como un ejemplo extremo de deslocalización de electrones en un gran sistema de enlaces covalentes, en el que participa cada átomo. Este tipo de enlace suele ser muy fuerte (lo que da como resultado la resistencia a la tracción de los metales). Sin embargo, el enlace metálico es de naturaleza más colectiva que otros tipos, por lo que permite que los cristales metálicos se deformen más fácilmente, porque están compuestos de átomos atraídos entre sí, pero no de ninguna manera particularmente orientada. Esto da como resultado la maleabilidad de los metales. La nube de electrones en el enlace metálico provoca la conductividad eléctrica y térmica característicamente buena de los metales, y también su lustre brillante que refleja la mayoría de las frecuencias de luz blanca.

Las primeras especulaciones sobre la naturaleza del enlace químico , que datan del siglo XII, suponían que ciertos tipos de especies químicas estaban unidas por un tipo de afinidad química . En 1704, Sir Isaac Newton esbozó su famosa teoría del enlace atómico, en la "Pregunta 31" de su Opticks , según la cual los átomos se unen entre sí mediante alguna " fuerza ". En concreto, tras reconocer las diversas teorías populares en boga en ese momento sobre cómo se razonaba que los átomos se unían entre sí, es decir, "átomos en forma de gancho", "pegados entre sí por el reposo" o "pegados entre sí por movimientos conspiradores", Newton afirma que preferiría inferir de su cohesión que "las partículas se atraen entre sí por alguna fuerza que, en contacto inmediato, es extremadamente fuerte, a pequeñas distancias realiza las operaciones químicas y llega no muy lejos de las partículas con algún efecto sensible".
En 1819, tras la invención de la pila voltaica , Jöns Jakob Berzelius desarrolló una teoría de la combinación química que enfatizaba los caracteres electronegativos y electropositivos de los átomos que se combinaban. A mediados del siglo XIX, Edward Frankland , FA Kekulé , AS Couper, Alexander Butlerov y Hermann Kolbe , basándose en la teoría de los radicales , desarrollaron la teoría de la valencia , originalmente llamada "poder de combinación", en la que los compuestos se unían debido a una atracción de polos positivos y negativos. En 1904, Richard Abegg propuso su regla de que la diferencia entre las valencias máxima y mínima de un elemento es a menudo ocho. En este punto, la valencia todavía era un número empírico basado solo en propiedades químicas.
Sin embargo, la naturaleza del átomo se hizo más clara con el descubrimiento de Ernest Rutherford en 1911 de un núcleo atómico rodeado de electrones, en el que citó a Nagaoka rechazando el modelo de Thomson con el argumento de que las cargas opuestas son impenetrables. En 1904, Nagaoka propuso un modelo planetario alternativo del átomo en el que un centro cargado positivamente está rodeado por una serie de electrones giratorios, a la manera de Saturno y sus anillos. [11]
El modelo de Nagaoka hizo dos predicciones:
Rutherford menciona el modelo de Nagaoka en su artículo de 1911 en el que propone el núcleo atómico . [12]
En la Conferencia Solvay de 1911, en la discusión sobre qué podría regular las diferencias de energía entre los átomos, Max Planck afirmó: "Los intermediarios podrían ser los electrones". [13] Estos modelos nucleares sugirieron que los electrones determinan el comportamiento químico.
Después vino el modelo de átomo nuclear con órbitas electrónicas de Niels Bohr de 1913. En 1916, el químico Gilbert N. Lewis desarrolló el concepto de enlaces de pares de electrones , en el que dos átomos pueden compartir de uno a seis electrones, formando así el enlace de un solo electrón , un enlace simple , un enlace doble o un enlace triple ; en palabras del propio Lewis, "Un electrón puede formar parte de la capa de dos átomos diferentes y no se puede decir que pertenezca exclusivamente a uno de ellos". [14]
También en 1916, Walther Kossel propuso una teoría similar a la de Lewis, sólo que su modelo suponía transferencias completas de electrones entre átomos, y por lo tanto era un modelo de enlace iónico . Tanto Lewis como Kossel estructuraron sus modelos de enlace sobre la base de la regla de Abegg (1904).
En 1913, Niels Bohr propuso un modelo de enlace químico. Según su modelo de molécula diatómica , los electrones de los átomos de la molécula forman un anillo giratorio cuyo plano es perpendicular al eje de la molécula y equidistante de los núcleos atómicos. El equilibrio dinámico del sistema molecular se logra mediante el equilibrio de fuerzas entre las fuerzas de atracción de los núcleos hacia el plano del anillo de electrones y las fuerzas de repulsión mutua de los núcleos. El modelo de Bohr del enlace químico tuvo en cuenta la repulsión de Coulomb : los electrones en el anillo están a la distancia máxima entre sí. [15] [16]
En 1927, el físico danés Øyvind Burrau derivó la primera descripción cuántica matemáticamente completa de un enlace químico simple, es decir, el producido por un electrón en el ion molecular de hidrógeno, H2 + . [ 17] Este trabajo demostró que el enfoque cuántico de los enlaces químicos podía ser fundamental y cuantitativamente correcto, pero los métodos matemáticos utilizados no podían extenderse a moléculas que contenían más de un electrón. Un enfoque más práctico, aunque menos cuantitativo, fue propuesto el mismo año por Walter Heitler y Fritz London . El método de Heitler-London forma la base de lo que ahora se llama teoría del enlace de valencia . [18] En 1929, la aproximación del método de orbitales moleculares (LCAO) de combinación lineal de orbitales atómicos fue introducida por Sir John Lennard-Jones , quien también sugirió métodos para derivar estructuras electrónicas de moléculas de F2 ( flúor ) y O2 ( oxígeno ) , a partir de principios cuánticos básicos. Esta teoría de orbitales moleculares representaba un enlace covalente como un orbital formado por la combinación de los orbitales atómicos de Schrödinger de la mecánica cuántica que se habían planteado como hipótesis para los electrones en átomos individuales. Las ecuaciones para el enlace de electrones en átomos multielectrónicos no se pudieron resolver a la perfección matemática (es decir, analíticamente ), pero las aproximaciones para ellas dieron muchas predicciones y resultados cualitativos buenos. La mayoría de los cálculos cuantitativos en la química cuántica moderna utilizan la teoría del enlace de valencia o la teoría de orbitales moleculares como punto de partida, aunque un tercer enfoque, la teoría del funcional de la densidad , se ha vuelto cada vez más popular en los últimos años.
En 1933, HH James y AS Coolidge realizaron un cálculo sobre la molécula de dihidrógeno que, a diferencia de todos los cálculos anteriores que utilizaban únicamente funciones de la distancia del electrón al núcleo atómico, utilizaba funciones que también sumaban explícitamente la distancia entre los dos electrones. [19] Con hasta 13 parámetros ajustables obtuvieron un resultado muy cercano al resultado experimental para la energía de disociación. Extensiones posteriores han utilizado hasta 54 parámetros y han dado una excelente concordancia con los experimentos. Este cálculo convenció a la comunidad científica de que la teoría cuántica podía dar concordancia con los experimentos. Sin embargo, este enfoque no tiene ninguna de las imágenes físicas de las teorías del enlace de valencia y de los orbitales moleculares y es difícil de extender a moléculas más grandes.
Debido a que los átomos y las moléculas son tridimensionales, es difícil utilizar un único método para indicar orbitales y enlaces. En las fórmulas moleculares, los enlaces químicos (orbitales de enlace) entre átomos se indican de diferentes maneras según el tipo de discusión. A veces, se descuidan algunos detalles. Por ejemplo, en química orgánica a veces uno se preocupa solo por el grupo funcional de la molécula. Así, la fórmula molecular del etanol puede escribirse en forma conformacional , forma tridimensional, forma bidimensional completa (indicando cada enlace sin direcciones tridimensionales), forma bidimensional comprimida (CH 3 –CH 2 –OH), separando el grupo funcional de otra parte de la molécula (C 2 H 5 OH), o por sus constituyentes atómicos (C 2 H 6 O), según lo que se discuta. A veces, incluso los electrones de la capa de valencia no enlazantes (con las direcciones aproximadas bidimensionales) están marcados, por ejemplo para el carbono elemental . ' C ' . Algunos químicos también pueden marcar los orbitales respectivos, por ejemplo, el hipotético anión eteno −4 ( \ / C=C / \ −4 ) indicando la posibilidad de formación de enlace.
Los enlaces químicos fuertes son las fuerzas intramoleculares que mantienen unidos a los átomos en las moléculas . Un enlace químico fuerte se forma a partir de la transferencia o compartición de electrones entre centros atómicos y depende de la atracción electrostática entre los protones en los núcleos y los electrones en los orbitales.
Los tipos de enlaces fuertes difieren debido a la diferencia en la electronegatividad de los elementos constituyentes. La electronegatividad es la tendencia de un átomo de un elemento químico dado a atraer electrones compartidos al formar un enlace químico, donde cuanto mayor sea la electronegatividad asociada, más electrones atraerá. La electronegatividad sirve como una forma sencilla de estimar cuantitativamente la energía de enlace , que caracteriza a un enlace a lo largo de la escala continua desde el enlace covalente hasta el iónico . Una gran diferencia en la electronegatividad conduce a un carácter más polar (iónico) en el enlace.
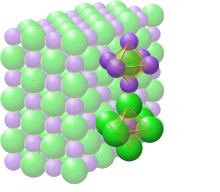
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No existe un valor preciso que distinga el enlace iónico del covalente, pero es probable que una diferencia de electronegatividad de más de 1,7 sea iónica, mientras que una diferencia de menos de 1,7 sea covalente. [21] El enlace iónico conduce a iones positivos y negativos separados . Las cargas iónicas están comúnmente entre −3 e a +3 e . El enlace iónico ocurre comúnmente en sales metálicas como el cloruro de sodio (sal de mesa). Una característica típica de los enlaces iónicos es que las especies forman cristales iónicos, en los que ningún ion está emparejado específicamente con ningún otro ion individual en un enlace direccional específico. Más bien, cada especie de ion está rodeada por iones de carga opuesta, y el espaciamiento entre él y cada uno de los iones de carga opuesta cerca de él es el mismo para todos los átomos circundantes del mismo tipo. Por lo tanto, ya no es posible asociar un ion con ningún otro átomo ionizado individual específico cerca de él. Esta es una situación diferente a la de los cristales covalentes, donde los enlaces covalentes entre átomos específicos todavía son discernibles a partir de las distancias más cortas entre ellos, medidas mediante técnicas como la difracción de rayos X.
Los cristales iónicos pueden contener una mezcla de especies covalentes e iónicas, como por ejemplo las sales de ácidos complejos como el cianuro de sodio , NaCN. La difracción de rayos X muestra que en NaCN, por ejemplo, los enlaces entre los cationes sodio (Na + ) y los aniones cianuro (CN − ) son iónicos , sin ningún ion sodio asociado con ningún cianuro en particular . Sin embargo, los enlaces entre los átomos de carbono (C) y nitrógeno (N) en el cianuro son del tipo covalente , de modo que cada carbono está fuertemente unido a un solo nitrógeno, al que está físicamente mucho más cerca que a otros carbonos o nitrógenos en un cristal de cianuro de sodio.
Cuando estos cristales se funden en líquidos, los enlaces iónicos se rompen primero porque no son direccionales y permiten que las especies cargadas se muevan libremente. De manera similar, cuando estas sales se disuelven en agua, los enlaces iónicos generalmente se rompen por la interacción con el agua, pero los enlaces covalentes continúan manteniéndose. Por ejemplo, en solución, los iones de cianuro, aún unidos como iones CN − individuales , se mueven independientemente a través de la solución, al igual que los iones de sodio, como Na + . En el agua, los iones cargados se separan porque cada uno de ellos se siente más fuertemente atraído por varias moléculas de agua que entre sí. La atracción entre iones y moléculas de agua en tales soluciones se debe a un tipo de enlace químico débil de tipo dipolo-dipolo . En los compuestos iónicos fundidos, los iones continúan siendo atraídos entre sí, pero no de una manera ordenada o cristalina.
El enlace covalente es un tipo común de enlace en el que dos o más átomos comparten electrones de valencia de manera más o menos equitativa. El tipo más simple y común es el enlace simple en el que dos átomos comparten dos electrones. Otros tipos incluyen el enlace doble , el enlace triple , los enlaces de uno y tres electrones , el enlace de dos electrones con tres centros y el enlace de cuatro electrones con tres centros .
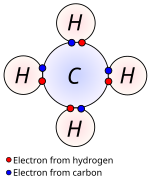
En los enlaces covalentes no polares, la diferencia de electronegatividad entre los átomos enlazados es pequeña, típicamente de 0 a 0,3. Los enlaces dentro de la mayoría de los compuestos orgánicos se describen como covalentes. La figura muestra el metano (CH 4 ), en el que cada hidrógeno forma un enlace covalente con el carbono. Consulte los enlaces sigma y los enlaces pi para obtener descripciones de LCAO de dichos enlaces. [22]
Las moléculas que se forman principalmente a partir de enlaces covalentes no polares a menudo son inmiscibles en agua u otros disolventes polares , pero mucho más solubles en disolventes no polares como el hexano .
Un enlace covalente polar es un enlace covalente con un carácter iónico significativo . Esto significa que los dos electrones compartidos están más cerca de uno de los átomos que del otro, lo que crea un desequilibrio de carga. Este tipo de enlaces se producen entre dos átomos con electronegatividades moderadamente diferentes y dan lugar a interacciones dipolo-dipolo . La diferencia de electronegatividad entre los dos átomos en estos enlaces es de 0,3 a 1,7.
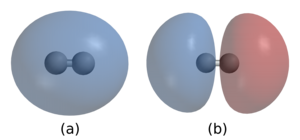
Un enlace simple entre dos átomos corresponde a la compartición de un par de electrones. El átomo de hidrógeno (H) tiene un electrón de valencia. Dos átomos de hidrógeno pueden formar una molécula, unida por el par de electrones compartido. Cada átomo de H tiene ahora la configuración electrónica de gas noble de helio (He). El par de electrones compartidos forma un enlace covalente simple. La densidad electrónica de estos dos electrones de enlace en la región entre los dos átomos aumenta a partir de la densidad de dos átomos de H que no interactúan.

Un enlace doble tiene dos pares de electrones compartidos, uno en un enlace sigma y otro en un enlace pi, con una densidad electrónica concentrada en dos lados opuestos del eje internuclear. Un enlace triple consta de tres pares de electrones compartidos, que forman un enlace sigma y dos enlaces pi. Un ejemplo es el nitrógeno. Los enlaces cuádruples y superiores son muy raros y se producen solo entre ciertos átomos de metales de transición .

Un enlace covalente coordinado es un enlace covalente en el que los dos electrones de enlace compartidos son del mismo átomo involucrado en el enlace. Por ejemplo, el trifluoruro de boro (BF 3 ) y el amoniaco (NH 3 ) forman un aducto o complejo de coordinación F 3 B←NH 3 con un enlace B–N en el que un par solitario de electrones en N se comparte con un orbital atómico vacío en B. El BF 3 con un orbital vacío se describe como un aceptor de pares de electrones o ácido de Lewis , mientras que el NH 3 con un par solitario que se puede compartir se describe como un donador de pares de electrones o base de Lewis . Los electrones se comparten aproximadamente por igual entre los átomos en contraste con el enlace iónico. Tal enlace se muestra con una flecha que apunta al ácido de Lewis. (En la Figura, las líneas sólidas son enlaces en el plano del diagrama, los enlaces en cuña apuntan hacia el observador y los enlaces discontinuos apuntan lejos del observador).
Los complejos de metales de transición generalmente están unidos por enlaces covalentes coordinados. Por ejemplo, el ion Ag + reacciona como un ácido de Lewis con dos moléculas de la base de Lewis NH3 para formar el ion complejo Ag(NH3 ) 2+ , que tiene dos enlaces covalentes coordinados Ag←N .
En el enlace metálico, los electrones de enlace están deslocalizados en una red de átomos. Por el contrario, en los compuestos iónicos, las ubicaciones de los electrones de enlace y sus cargas son estáticas. El libre movimiento o deslocalización de los electrones de enlace conduce a propiedades metálicas clásicas como el brillo ( reflectividad superficial de la luz ), la conductividad eléctrica y térmica , la ductilidad y la alta resistencia a la tracción .
Existen varios tipos de enlaces débiles que pueden formarse entre dos o más moléculas que no están unidas de forma covalente. Las fuerzas intermoleculares hacen que las moléculas se atraigan o se repelan entre sí. A menudo, estas fuerzas influyen en las características físicas (como el punto de fusión ) de una sustancia.
Las fuerzas de Van der Waals son interacciones entre moléculas de capa cerrada . Incluyen interacciones coulombianas entre cargas parciales en moléculas polares y repulsiones de Pauli entre capas cerradas de electrones. [23] : 696
Las fuerzas de Keesom son las fuerzas entre los dipolos permanentes de dos moléculas polares. [23] : 701 Las fuerzas de dispersión de London son las fuerzas entre dipolos inducidos de diferentes moléculas. [23] : 703 También puede haber una interacción entre un dipolo permanente en una molécula y un dipolo inducido en otra molécula. [23] : 702
Los enlaces de hidrógeno de la forma A--H•••B ocurren cuando A y B son dos átomos altamente electronegativos (generalmente N, O o F) de modo que A forma un enlace covalente altamente polar con H de modo que H tiene una carga positiva parcial, y B tiene un par solitario de electrones que es atraído por esta carga positiva parcial y forma un enlace de hidrógeno. [23] : 702 Los enlaces de hidrógeno son responsables de los altos puntos de ebullición del agua y el amoníaco con respecto a sus análogos más pesados. En algunos casos, un enlace halógeno similar puede formarse mediante un átomo de halógeno ubicado entre dos átomos electronegativos en diferentes moléculas.
A distancias cortas, las fuerzas repulsivas entre átomos también se vuelven importantes. [23] : 705-6
En el límite (poco realista) del enlace iónico "puro" , los electrones están perfectamente localizados en uno de los dos átomos del enlace. Estos enlaces pueden entenderse mediante la física clásica . La fuerza entre los átomos depende de potenciales electrostáticos isotrópicos continuos. La magnitud de la fuerza es simplemente proporcional al producto de las dos cargas iónicas según la ley de Coulomb . [ cita requerida ]
Los enlaces covalentes se entienden mejor mediante la teoría del enlace de valencia (VB) o la teoría de orbitales moleculares (MO) . Las propiedades de los átomos involucrados se pueden entender utilizando conceptos como número de oxidación , carga formal y electronegatividad . La densidad electrónica dentro de un enlace no se asigna a átomos individuales, sino que está deslocalizada entre átomos. En la teoría del enlace de valencia, el enlace se conceptualiza como construido a partir de pares de electrones que están localizados y compartidos por dos átomos a través de la superposición de orbitales atómicos. Los conceptos de hibridación orbital y resonancia amplían esta noción básica del enlace de pares de electrones. En la teoría de orbitales moleculares, el enlace se ve como deslocalizado y distribuido en orbitales que se extienden por toda la molécula y se adaptan a sus propiedades de simetría, típicamente considerando combinaciones lineales de orbitales atómicos (LCAO). La teoría del enlace de valencia es químicamente más intuitiva al estar localizada espacialmente, lo que permite centrar la atención en las partes de la molécula que experimentan cambios químicos. Por el contrario, los orbitales moleculares son más "naturales" desde un punto de vista mecánico cuántico, ya que las energías orbitales son físicamente significativas y están directamente vinculadas a las energías de ionización experimentales de la espectroscopia de fotoelectrones . En consecuencia, la teoría del enlace de valencia y la teoría de los orbitales moleculares a menudo se consideran marcos competitivos pero complementarios que ofrecen diferentes perspectivas sobre los sistemas químicos. Como enfoques para la teoría de la estructura electrónica, tanto los métodos MO como VB pueden dar aproximaciones a cualquier nivel deseado de precisión, al menos en principio. Sin embargo, en niveles inferiores, las aproximaciones difieren, y un enfoque puede ser más adecuado para los cálculos que involucran un sistema o propiedad en particular que el otro. [ cita requerida ]
A diferencia de las fuerzas coulombianas esféricamente simétricas en los enlaces iónicos puros, los enlaces covalentes son generalmente dirigidos y anisotrópicos . Estos suelen clasificarse en función de su simetría con respecto a un plano molecular como enlaces sigma y enlaces pi . En el caso general, los átomos forman enlaces que son intermedios entre iónicos y covalentes, dependiendo de la electronegatividad relativa de los átomos involucrados. Los enlaces de este tipo se conocen como enlaces covalentes polares . [24]
Un enlace covalente polar existe cuando átomos con diferentes electronegatividades comparten electrones en un enlace covalente.