El glucagón es una hormona peptídica producida por las células alfa del páncreas . Aumenta la concentración de glucosa y ácidos grasos en el torrente sanguíneo y se considera la principal hormona catabólica del organismo. [1] También se utiliza como medicamento para tratar diversas afecciones de salud. Su efecto es opuesto al de la insulina , que reduce la glucosa extracelular. [2] Se produce a partir del proglucagón , codificado por el gen GCG .
El páncreas libera glucagón cuando la cantidad de glucosa en el torrente sanguíneo es demasiado baja. El glucagón hace que el hígado realice la glucogenólisis : convierte el glucógeno almacenado en glucosa , que se libera en el torrente sanguíneo. [3] Por otro lado, los niveles altos de glucosa en sangre estimulan la liberación de insulina. La insulina permite que la glucosa sea absorbida y utilizada por los tejidos dependientes de insulina. Por lo tanto, el glucagón y la insulina son parte de un sistema de retroalimentación que mantiene estables los niveles de glucosa en sangre. El glucagón aumenta el gasto energético y se eleva en condiciones de estrés. [4] El glucagón pertenece a la familia de hormonas secretinas .
El glucagón es un polipéptido de 29 aminoácidos . Su estructura primaria en humanos es: NH2 - His - Ser - Gln - Gly - Thr - Phe - Thr - Ser - Asp - Tyr - Ser - Lys - Tyr - Leu - Asp - Ser - Arg - Arg - Ala - Gln - Asp - Phe - Val - Gln - Trp - Leu - Met - Asn - Thr - COOH (HSQGTFTSDYSKYLDSRRAQDFVQWLMNT).
El polipéptido tiene una masa molecular de 3485 daltons . [5] El glucagón es una hormona peptídica (no esteroide ).
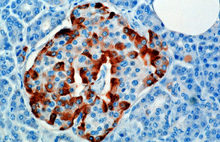
La hormona se sintetiza y secreta a partir de las células alfa (células α) de los islotes de Langerhans , que se encuentran en la porción endocrina del páncreas. El glucagón se produce a partir del gen del preproglucagón Gcg . Primero, la peptidasa señal elimina el péptido señal del preproglucagón , formando la proteína proglucagón de 160 aminoácidos . [6] Luego, la proproteína convertasa 2 escinde el proglucagón a glucagón (aminoácidos 33-61) en las células α de los islotes pancreáticos. En las células L intestinales , el proglucagón se escinde en los productos alternativos glicentina (1–69), polipéptido pancreático relacionado con la glicentina (1–30), oxintomodulina (33–69), péptido similar al glucagón 1 (72–107 o 108) y péptido similar al glucagón 2 (126–158). [6]
En los roedores, las células alfa se encuentran en el borde exterior del islote. La estructura del islote humano está mucho menos segregada y las células alfa se distribuyen por todo el islote en estrecha proximidad a las células beta. Las células alfa del estómago también producen glucagón. [7]
Investigaciones recientes han demostrado que la producción de glucagón también puede tener lugar fuera del páncreas, siendo el intestino el sitio más probable de síntesis de glucagón extrapancreático. [8]
La producción, que de otro modo sería libre, se ve suprimida/regulada por la amilina , una hormona peptídica cosecretada con la insulina de las células β pancreáticas. [9] A medida que los niveles de glucosa plasmática disminuyen, la reducción posterior en la secreción de amilina alivia su supresión de las células α, lo que permite la secreción de glucagón.
La secreción de glucagón es estimulada por:
La secreción de glucagón se inhibe por:
El glucagón generalmente eleva la concentración de glucosa en la sangre al promover la gluconeogénesis y la glucogenólisis . [17] El glucagón también disminuye la síntesis de ácidos grasos en el tejido adiposo y el hígado, además de promover la lipólisis en estos tejidos, lo que hace que liberen ácidos grasos a la circulación donde pueden catabolizarse para generar energía en tejidos como el músculo esquelético cuando sea necesario. [18]
La glucosa se almacena en el hígado en forma de polisacárido glucógeno, que es un glucano (un polímero formado por moléculas de glucosa). Las células del hígado ( hepatocitos ) tienen receptores de glucagón . Cuando el glucagón se une a los receptores de glucagón, las células del hígado convierten el glucógeno en moléculas de glucosa individuales y las liberan en el torrente sanguíneo, en un proceso conocido como glucogenólisis . A medida que estas reservas se agotan, el glucagón estimula al hígado y al riñón a sintetizar glucosa adicional mediante gluconeogénesis . El glucagón desactiva la glucólisis en el hígado, lo que hace que los intermediarios glucolíticos se transporten a la gluconeogénesis.
El glucagón también regula la tasa de producción de glucosa a través de la lipólisis. El glucagón induce la lipólisis en humanos en condiciones de supresión de insulina (como la diabetes mellitus tipo 1 ). [19]
La producción de glucagón parece depender del sistema nervioso central a través de vías que aún no se han definido. En animales invertebrados , se ha informado que la eliminación del pedúnculo ocular afecta la producción de glucagón. La extirpación del pedúnculo ocular en cangrejos de río jóvenes produce hiperglucemia inducida por glucagón . [20]
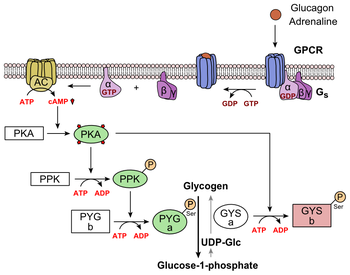
El glucagón se une al receptor de glucagón , un receptor acoplado a la proteína G , ubicado en la membrana plasmática de la célula. El cambio de conformación en el receptor activa una proteína G , una proteína heterotrimérica con subunidades α , β y γ. Cuando la proteína G interactúa con el receptor, sufre un cambio conformacional que da como resultado el reemplazo de la molécula de GDP que estaba unida a la subunidad α con una molécula de GTP . [21] Esta sustitución da como resultado la liberación de la subunidad α de las subunidades β y γ. La subunidad alfa activa específicamente la siguiente enzima en la cascada, la adenilato ciclasa .
La adenilato ciclasa fabrica monofosfato de adenosina cíclico (AMP cíclico o AMPc), que activa la proteína quinasa A (proteína quinasa dependiente de AMPc). Esta enzima, a su vez, activa la fosforilasa quinasa , que luego fosforila la glucógeno fosforilasa b (PYG b), convirtiéndola en la forma activa llamada fosforilasa a (PYG a). La fosforilasa a es la enzima responsable de la liberación de glucosa 1-fosfato de los polímeros de glucógeno. Un ejemplo de la vía sería cuando el glucagón se une a una proteína transmembrana. Las proteínas transmembrana interactúan con Gɑβ𝛾. Gαs se separa de Gβ𝛾 e interactúa con la proteína transmembrana adenilil ciclasa. La adenilil ciclasa cataliza la conversión de ATP a AMPc. El AMPc se une a la proteína quinasa A y el complejo fosforila la glucógeno fosforilasa quinasa. [22] La fosforilasa quinasa de glucógeno fosforilada fosforila la fosforilasa de glucógeno . La fosforilasa de glucógeno fosforilada corta las unidades de glucosa del glucógeno como glucosa 1-fosfato.
Además, el control coordinado de la glucólisis y la gluconeogénesis en el hígado se ajusta mediante el estado de fosforilación de las enzimas que catalizan la formación de un potente activador de la glucólisis llamado fructosa 2,6-bisfosfato. [23] La enzima proteína quinasa A (PKA) que fue estimulada por la cascada iniciada por el glucagón también fosforilará un solo residuo de serina de la cadena polipeptídica bifuncional que contiene las enzimas fructosa 2,6-bisfosfatasa y fosfofructoquinasa-2. Esta fosforilación covalente iniciada por el glucagón activa la primera e inhibe la segunda. Esto regula la reacción que cataliza la fructosa 2,6-bisfosfato (un potente activador de la fosfofructoquinasa-1, la enzima que es el paso regulador primario de la glucólisis) [24] al disminuir la velocidad de su formación, inhibiendo así el flujo de la vía de la glucólisis y permitiendo que predomine la gluconeogénesis. Este proceso es reversible en ausencia de glucagón (y, por tanto, en presencia de insulina).
La estimulación de la PKA por el glucagón inactiva la enzima glucolítica piruvato quinasa , [25] inactiva la glucógeno sintasa , [26] y activa la lipasa sensible a las hormonas , [27] que cataboliza los glicéridos en glicerol y ácidos grasos libres, en los hepatocitos.
El glucagón también inactiva la acetil-CoA carboxilasa , que crea malonil-CoA a partir de acetil-CoA, a través de quinasas dependientes de AMPc y/o independientes de AMPc. [28]
El malonil-CoA es un producto formado por la ACC durante la síntesis de novo y un inhibidor alostérico de la carnitina palmitoiltransferasa I (CPT1) , una enzima mitocondrial importante para llevar los ácidos grasos al espacio intermembrana de las mitocondrias para la β-oxidación. [29] El glucagón disminuye el malonil-CoA a través de la inhibición de la acetil-CoA carboxilasa y a través de la reducción de la glucólisis mediante su reducción antes mencionada en la fructosa 2,6-bisfosfato. Por lo tanto, la reducción en el malonil-CoA es un regulador común para los efectos del aumento del metabolismo de los ácidos grasos del glucagón.
Los niveles anormalmente elevados de glucagón pueden ser causados por tumores pancreáticos , como el glucagonoma , cuyos síntomas incluyen eritema migratorio necrolítico , [30] aminoácidos reducidos e hiperglucemia. Puede ocurrir solo o en el contexto de neoplasia endocrina múltiple tipo 1. [ 31]
El glucagón elevado es el principal contribuyente a la cetoacidosis hiperglucémica en la diabetes tipo 1 no diagnosticada o mal tratada. A medida que las células beta dejan de funcionar, la insulina y el GABA pancreático ya no están presentes para suprimir la producción libre de glucagón. Como resultado, el glucagón se libera de las células alfa al máximo, lo que provoca una rápida descomposición del glucógeno en glucosa y una cetogénesis rápida . [32] Se encontró que un subconjunto de adultos con diabetes tipo 1 tardó 4 veces más en promedio en acercarse a la cetoacidosis cuando se les administró somatostatina (inhibe la producción de glucagón) sin insulina. [ cita requerida ] La inhibición del glucagón ha sido una idea popular del tratamiento de la diabetes, sin embargo, algunos han advertido que hacerlo dará lugar a una diabetes frágil en pacientes con glucosa en sangre adecuadamente estable. [ cita requerida ]
Se cree que la ausencia de células alfa (y, por lo tanto, de glucagón) es una de las principales influencias en la extrema volatilidad de la glucosa en sangre en el contexto de una pancreatectomía total .
A principios de la década de 1920, varios grupos observaron que los extractos pancreáticos inyectados en animales diabéticos darían como resultado un breve aumento del azúcar en sangre antes de la disminución del azúcar en sangre impulsada por la insulina. [6] En 1922, C. Kimball y John R. Murlin identificaron un componente de los extractos pancreáticos responsable de este aumento del azúcar en sangre, llamándolo "glucagón", un acrónimo de " gluc ose agon ist". [6] [33] En la década de 1950, los científicos de Eli Lilly aislaron glucagón puro, lo cristalizaron y determinaron su secuencia de aminoácidos. [6] [34] [35] Esto condujo al desarrollo del primer radioinmunoensayo para detectar glucagón, descrito por el grupo de Roger Unger en 1959. [6]
No se logró una comprensión más completa de su papel en la fisiología y la enfermedad hasta la década de 1970, cuando se desarrolló un radioinmunoensayo específico. [36]
En 1979, mientras trabajaba en el laboratorio de Joel Habener en el Hospital General de Massachusetts , Richard Goodman recolectó células de islotes de cuerpos de Brockman de rape americano para investigar la somatostatina . [37] Al empalmar ADN de células de islotes de rape en bacterias, Goodman pudo identificar el gen que codifica la somatostatina. [37] P. Kay Lund se unió al laboratorio de Habener y usó las bacterias de Goodman para buscar el gen del glucagón. [37] En 1982, Lund y Goodman publicaron su descubrimiento de que el gen del proglucagón codifica tres péptidos distintos: el glucagón y dos péptidos nuevos. [37] Graeme Bell en Chiron Corporation dirigió un equipo que aisló los dos últimos péptidos, que ahora se conocen como péptido similar al glucagón-1 y péptido similar al glucagón-2. [37] Esto abrió la puerta al descubrimiento del receptor del péptido similar al glucagón-1 y luego a los medicamentos que se dirigen a ese receptor, conocidos como agonistas del receptor GLP-1 . [37]