En química , la simetría molecular describe la simetría presente en las moléculas y la clasificación de estas moléculas según su simetría. La simetría molecular es un concepto fundamental en química, ya que puede utilizarse para predecir o explicar muchas de las propiedades químicas de una molécula , como por ejemplo si tiene o no un momento dipolar , así como sus transiciones espectroscópicas permitidas . Para ello es necesario utilizar la teoría de grupos . Esto implica clasificar los estados de la molécula utilizando las representaciones irreducibles de la tabla de caracteres del grupo de simetría de la molécula. La simetría es útil en el estudio de los orbitales moleculares , con aplicaciones al método de Hückel , a la teoría del campo de ligandos y a las reglas de Woodward-Hoffmann . Muchos libros de texto de nivel universitario sobre química física , química cuántica , espectroscopia y química inorgánica tratan la simetría. [1] [2] [3] [4] [5] Otro marco a mayor escala es el uso de sistemas cristalinos para describir la simetría cristalográfica en materiales a granel.
Existen muchas técnicas para determinar la simetría de una molécula determinada, entre ellas la cristalografía de rayos X y diversas formas de espectroscopia . La notación espectroscópica se basa en consideraciones de simetría.
La simetría del grupo puntual de una molécula se define por la presencia o ausencia de 5 tipos de elementos de simetría .

Los cinco elementos de simetría tienen asociados cinco tipos de operaciones de simetría , que hacen que la geometría de la molécula sea indistinguible de la geometría inicial. A veces se distinguen de los elementos de simetría mediante un acento circunflejo . Por lo tanto, Ĉ n es la rotación de una molécula alrededor de un eje y Ê es la operación de identidad. Un elemento de simetría puede tener más de una operación de simetría asociada. Por ejemplo, el eje C 4 de la molécula de tetrafluoruro de xenón cuadrado (XeF 4 ) está asociado con dos rotaciones Ĉ 4 en direcciones opuestas (90° y 270°), una rotación Ĉ 2 (180°) y Ĉ 1 (0° o 360°). Debido a que Ĉ 1 es equivalente a Ê , Ŝ 1 a σ y Ŝ 2 a î , todas las operaciones de simetría se pueden clasificar como rotaciones propias o impropias.
Para las moléculas lineales, la rotación en el sentido de las agujas del reloj o en el sentido contrario de las agujas del reloj alrededor del eje molecular en cualquier ángulo Φ es una operación de simetría.


Las operaciones de simetría de una molécula (u otro objeto) forman un grupo . En matemáticas, un grupo es un conjunto con una operación binaria que satisface las cuatro propiedades que se enumeran a continuación.
En un grupo de simetría , los elementos del grupo son las operaciones de simetría (no los elementos de simetría), y la combinación binaria consiste en aplicar primero una operación de simetría y luego la otra. Un ejemplo es la secuencia de una rotación C 4 alrededor del eje z y una reflexión en el plano xy, denotada σ(xy) C 4 . Por convención, el orden de las operaciones es de derecha a izquierda.
Un grupo de simetría obedece las propiedades definitorias de cualquier grupo.
El orden de un grupo es el número de elementos que lo componen. En el caso de grupos de órdenes pequeños, las propiedades del grupo se pueden verificar fácilmente considerando su tabla de composición, una tabla cuyas filas y columnas corresponden a los elementos del grupo y cuyas entradas corresponden a sus productos.

La aplicación sucesiva (o composición ) de una o más operaciones de simetría de una molécula tiene un efecto equivalente al de alguna operación de simetría individual de la molécula. Por ejemplo, una rotación de C 2 seguida de una reflexión σ v se considera una operación de simetría σ v ' : σ v * C 2 = σ v '. ("Operación A seguida de B para formar C " se escribe BA = C ). [8] Además, el conjunto de todas las operaciones de simetría (incluida esta operación de composición) obedece a todas las propiedades de un grupo, dadas anteriormente. Por lo tanto, ( S , * ) es un grupo, donde S es el conjunto de todas las operaciones de simetría de alguna molécula y * denota la composición (aplicación repetida) de las operaciones de simetría.
Este grupo se denomina grupo puntual de esa molécula, porque el conjunto de operaciones de simetría deja fijo al menos un punto (aunque para algunas simetrías un eje entero o un plano entero permanece fijo). En otras palabras, un grupo puntual es un grupo que resume todas las operaciones de simetría que tienen todas las moléculas de esa categoría. [8] La simetría de un cristal, por el contrario, se describe mediante un grupo espacial de operaciones de simetría, que incluye las traslaciones en el espacio.
Se pueden determinar las operaciones de simetría del grupo puntual para una molécula particular considerando la simetría geométrica de su modelo molecular. Sin embargo, cuando se utiliza un grupo puntual para clasificar estados moleculares, las operaciones en él no se deben interpretar de la misma manera. En cambio, las operaciones se interpretan como rotaciones y/o reflejos de las coordenadas vibrónicas (vibración-electrónicas) y estas operaciones conmutan con el hamiltoniano vibrónico. Son "operaciones de simetría" para ese hamiltoniano vibrónico. El grupo puntual se utiliza para clasificar por simetría los estados propios vibrónicos de una molécula rígida. La clasificación por simetría de los niveles rotacionales, los estados propios del hamiltoniano completo (rotación-vibración-electrónica), se puede lograr mediante el uso del grupo de permutación-inversión apropiado, como lo introdujo Longuet-Higgins . [9]
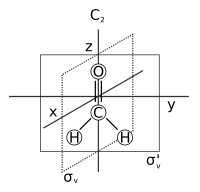
Al asignar a cada molécula un grupo puntual, las moléculas se clasifican en categorías con propiedades de simetría similares. Por ejemplo, PCl 3 , POF 3 , XeO 3 y NH 3 comparten operaciones de simetría idénticas. [10] Todas pueden experimentar la operación de identidad E , dos operaciones de rotación de C 3 diferentes y tres reflexiones planas σ v diferentes sin alterar sus identidades, por lo que se colocan en un grupo puntual, C 3v , con orden 6. [8] De manera similar, el agua (H 2 O) y el sulfuro de hidrógeno (H 2 S) también comparten operaciones de simetría idénticas. Ambos experimentan la operación de identidad E , una rotación C 2 y dos reflexiones σ v sin alterar sus identidades, por lo que ambos se colocan en un grupo puntual, C 2v , con orden 4. [11] Este sistema de clasificación ayuda a los científicos a estudiar las moléculas de manera más eficiente, ya que las moléculas químicamente relacionadas en el mismo grupo puntual tienden a exhibir esquemas de enlace similares, diagramas de enlace molecular y propiedades espectroscópicas. [8] La simetría del grupo puntual describe la simetría de una molécula cuando se fija en su configuración de equilibrio en un estado electrónico particular. No permite el efecto túnel entre mínimos ni el cambio de forma que puede surgir de los efectos de distorsión centrífuga de la rotación molecular.
En la siguiente tabla se enumeran muchos de los grupos de puntos aplicables a las moléculas, etiquetados con la notación de Schoenflies , que es común en química y espectroscopia molecular. Las descripciones incluyen formas comunes de moléculas, que pueden explicarse mediante el modelo RPECV . En cada fila, las descripciones y los ejemplos no tienen simetrías superiores, lo que significa que el grupo de puntos nombrado captura todas las simetrías de puntos.
Un conjunto de matrices que se multiplican entre sí de una manera que imita la tabla de multiplicación de los elementos de un grupo se denomina representación del grupo. Por ejemplo, para el grupo puntual C 2v , las tres matrices siguientes forman parte de una representación del grupo:
Aunque existe un número infinito de representaciones de este tipo, las representaciones irreducibles (o "irreps") del grupo son todo lo que se necesita, ya que todas las demás representaciones del grupo pueden describirse como una suma directa de las representaciones irreducibles. Además, las representaciones irreducibles son aquellas representaciones matriciales en las que las matrices están en su forma más diagonal posible.

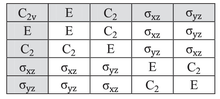
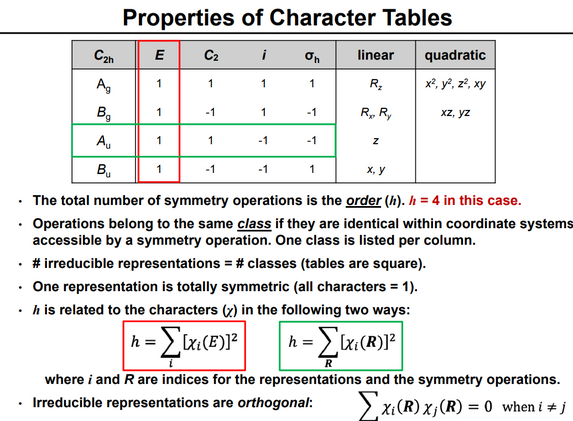
Para cualquier grupo, su tabla de caracteres da una tabulación (para las clases del grupo) de los caracteres (la suma de los elementos diagonales) de las matrices de todas las representaciones irreducibles del grupo. Como el número de representaciones irreducibles es igual al número de clases, la tabla de caracteres es cuadrada.
Las representaciones se etiquetan según un conjunto de convenciones:
Las tablas también recogen información sobre cómo los vectores base cartesianos, las rotaciones sobre ellos y las funciones cuadráticas de ellos se transforman mediante las operaciones de simetría del grupo, señalando qué representación irreducible se transforma de la misma manera. Estas indicaciones se encuentran convencionalmente en el lado derecho de las tablas. Esta información es útil porque los orbitales químicamente importantes (en particular los orbitales p y d ) tienen las mismas simetrías que estas entidades.
La tabla de caracteres para el grupo de puntos de simetría C 2v se muestra a continuación:
Consideremos el ejemplo del agua (H 2 O), que tiene la simetría C 2v descrita anteriormente. El orbital 2 p x del oxígeno tiene simetría B 1 como en la cuarta fila de la tabla de caracteres anterior, con x en la sexta columna). Está orientado perpendicularmente al plano de la molécula y cambia de signo con una operación C 2 y σ v '(yz), pero permanece inalterado con las otras dos operaciones (obviamente, el carácter para la operación de identidad es siempre +1). El conjunto de caracteres de este orbital es, por tanto, {1, −1, 1, −1}, correspondiente a la representación irreducible B 1. Del mismo modo, se observa que el orbital 2 p z tiene la simetría de la representación irreducible A 1 ( es decir , ninguna de las operaciones de simetría lo cambia), 2 p y B 2 y el orbital 3 d xy A 2. Estas asignaciones y otras se indican en las dos columnas más a la derecha de la tabla.
Hans Bethe utilizó caracteres de operaciones de grupos puntuales en su estudio de la teoría de campos de ligandos en 1929, y Eugene Wigner utilizó la teoría de grupos para explicar las reglas de selección de la espectroscopia atómica . [14] Las primeras tablas de caracteres fueron compiladas por László Tisza (1933), en relación con los espectros vibracionales. Robert Mulliken fue el primero en publicar tablas de caracteres en inglés (1933), y E. Bright Wilson las utilizó en 1934 para predecir la simetría de los modos normales vibracionales . [15] El conjunto completo de 32 grupos puntuales cristalográficos fue publicado en 1936 por Rosenthal y Murphy. [16]
Cada modo normal de vibración molecular tiene una simetría que forma una base para una representación irreducible del grupo de simetría molecular. [17] Por ejemplo, la molécula de agua tiene tres modos normales de vibración: estiramiento simétrico en el que las dos longitudes de enlace OH varían en fase entre sí, estiramiento asimétrico en el que varían fuera de fase y flexión en el que varía el ángulo de enlace. La simetría molecular del agua es C 2v con cuatro representaciones irreducibles A 1 , A 2 , B 1 y B 2 . Los modos de estiramiento simétrico y flexión tienen simetría A 1 , mientras que el modo asimétrico tiene simetría B 2 . La simetría general de los tres modos vibracionales es, por lo tanto, Γ vib = 2A 1 + B 2 . [17] [18]
La simetría molecular del amoniaco (NH 3 ) es C 3v , con operaciones de simetría E, C 3 y σ v . [6] Para N = 4 átomos, el número de modos vibracionales para una molécula no lineal es 3N-6 = 6, debido al movimiento relativo del átomo de nitrógeno y los tres átomos de hidrógeno. Los tres átomos de hidrógeno viajan simétricamente a lo largo de los enlaces NH, ya sea en la dirección del átomo de nitrógeno o alejándose de él. Este modo se conoce como estiramiento simétrico (v₁) y refleja la simetría en el estiramiento del enlace NH. De los tres modos vibracionales, este tiene la frecuencia más alta . [19]

En la vibración de flexión (ν₂), el átomo de nitrógeno permanece en el eje de simetría, mientras que los tres átomos de hidrógeno se mueven en direcciones diferentes entre sí, lo que genera cambios en los ángulos de enlace. Los átomos de hidrógeno se mueven como un paraguas, por lo que este modo se conoce a menudo como "modo paraguas". [21]
También existe un modo de estiramiento asimétrico (ν₃) en el que un átomo de hidrógeno se aproxima al átomo de nitrógeno mientras que los otros dos hidrógenos se alejan.
Se puede determinar el número total de grados de libertad para cada especie de simetría (o representación irreducible ). El amoniaco tiene cuatro átomos y cada átomo está asociado con tres componentes vectoriales . El grupo de simetría C 3v para NH 3 tiene las tres especies de simetría A 1 , A 2 y E. Los modos de vibración incluyen los modos vibracional, rotacional y traslacional.
Modos totales = 3A 1 + A 2 + 4E. Esto es un total de 12 modos porque cada E corresponde a 2 modos degenerados (con la misma energía).
Modos rotacionales = A2 + E (3 modos)
Modos de traducción = A 1 + E
Modos vibracionales = Modos totales - Modos rotacionales - Modos traslacionales = 3A 1 + A 2 + 4E - A 2 - E - A 1 - E = 2A 1 + 2E (6 modos).

Cada orbital molecular también tiene la simetría de una representación irreducible. Por ejemplo, el etileno (C 2 H 4 ) tiene un grupo de simetría D 2h , y su orbital molecular más alto ocupado ( HOMO ) es el orbital de enlace pi que forma una base para su representación irreducible B 1u . [22]
Como se discutió anteriormente en la sección Grupos puntuales y grupos de permutación-inversión, los grupos puntuales son útiles para clasificar los estados vibracionales y electrónicos de moléculas rígidas (a veces llamadas moléculas semirrígidas ) que experimentan solo pequeñas oscilaciones alrededor de una única geometría de equilibrio. Longuet-Higgins introdujo un tipo más general de grupo de simetría [9] adecuado no solo para clasificar los estados vibracionales y electrónicos de moléculas rígidas sino también para clasificar sus estados rotacionales y de espín nuclear. Además, dichos grupos se pueden utilizar para clasificar los estados de moléculas no rígidas (o fluxionales ) que hacen túnel entre geometrías equivalentes [23] y para permitir los efectos distorsionadores de la rotación molecular. Estos grupos se conocen como grupos de permutación-inversión , porque las operaciones de simetría en ellos son permutaciones energéticamente factibles de núcleos idénticos, o inversión con respecto al centro de masa (la operación de paridad ), o una combinación de las dos. [9]
Abundan los ejemplos de falta de rigidez molecular. Por ejemplo, el etano (C 2 H 6 ) tiene tres conformaciones escalonadas equivalentes . El efecto túnel entre las conformaciones se produce a temperaturas ordinarias por rotación interna de un grupo metilo con respecto al otro. No se trata de una rotación de toda la molécula sobre el eje C 3 , aunque cada conformación tiene simetría D 3d , como en la tabla anterior. De manera similar, el amoníaco (NH 3 ) tiene dos conformaciones piramidales equivalentes ( C 3v ) que se interconvierten mediante el proceso conocido como inversión de nitrógeno .
Además, las moléculas de metano (CH 4 ) y H 3 + tienen estructuras de equilibrio altamente simétricas con simetrías de grupo puntual T d y D 3h respectivamente; carecen de momentos dipolares eléctricos permanentes pero tienen espectros de rotación pura muy débiles debido a la distorsión centrífuga rotacional. [24] [25]
A veces es necesario considerar juntos estados electrónicos que tienen diferentes simetrías de grupo puntual en equilibrio. Por ejemplo, en su estado electrónico fundamental (N), la molécula de etileno C 2 H 4 tiene simetría de grupo puntual D 2h, mientras que en el estado excitado (V) tiene simetría D 2d . Para tratar estos dos estados juntos es necesario permitir la torsión y utilizar el grupo doble del grupo de permutación-inversión G 16 . [26]
Cada modo normal de vibración formará un conjunto base para una representación irreducible del grupo puntual de la molécula.