Valoración complexométrica
El Fe(III) forma un complejo de color rojo que se mantiene mientras exista tiocianato libre en la disolución.
Una vez sobrepasado el punto de equivalencia desaparece el color, dando por terminada la valoración.
El catión Ag+ forma un complejo con el ion cianuro (CN-) lo que sirve para su valoración, según la reacción: Este complejo tiene una constante de formación muy alta (Kf = 7,1 x 1019), por lo que la reacción es muy completa.Cuando se alcanza el punto final aparece una turbidez blanca debida a la formación del complejo dicianoargentato(I) de plata, que es muy poco soluble (método de Liebig): También es posible valorar ciertos metales que forman complejos muy estables con el ion cianuro, utilizando cianuro de potasio como valorante.
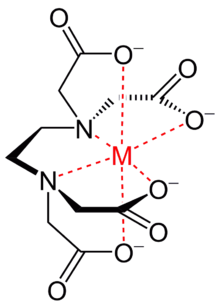
Sin embargo, en la práctica el EDTA está, por lo general, sólo parcialmente ionizado, y por lo tanto forma menos de seis enlaces covalentes coordinados con los cationes metálicos.
El EDTA forma un complejo octaédrico con la mayoría de los cationes metálicos divalentes, M2+, en solución acuosa.
Sin embargo, como el EDTA se une a los cationes metálicos mucho más fuertemente que al colorante utilizado como indicador, el EDTA se desplaza el colorante de los cationes metálicos de la solución analito.
Múltiples iones metálicos pueden ser valorados secuencialmente mediante un cuidadoso control del pH.