Unión de orbitales moleculares
[3] Los orbitales de enlace conducen a una especie más estable que cuando los dos hidrógenos son monoatómicos.
Los orbitales anti-enlace son menos estables porque, con muy poca o ninguna densidad de electrones en el medio, los dos núcleos (que tienen la misma carga) se repelen entre sí.
Por lo tanto, se necesitaría más energía para mantener los dos átomos juntos a través del orbital antienlazante.
Por lo tanto, el hidrógeno prefiere existir como molécula diatómica y no monoatómica.
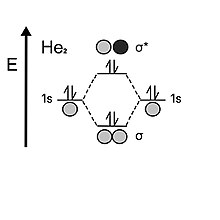
[4] Al mirar el helio, el átomo contiene dos electrones en cada capa de valencia 1s.
[5] Los enlaces pi son creados por las interacciones "laterales" de los orbitales.
La forma esférica tridimensional de los orbitales s no tiene direccionalidad en el espacio y los orbitales px, py y p z están todos a 90° entre sí.