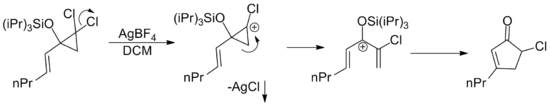Reacción de ciclización de Nazarov
Originalmente fue descubierto por Ivan Nikolaevich Nazarov (1906-1957) en 1941, mientras estudiaba los reordenamientos de Alil Vinil cetonas.
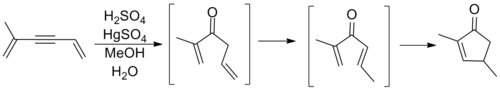
Esto genera un catión oxialil que sufre una reacción de eliminación para perder un β-hidrógeno.
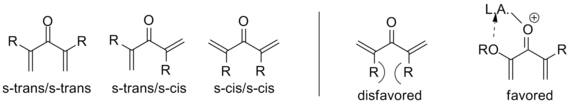
Para lograr esta transformación, la molécula debe estar en la conformación s-trans/s-trans, colocando los grupos vinilo en una orientación adecuada.
La propensión del sistema a entrar en esta conformación influye drásticamente en la velocidad de reacción, con sustratos α-sustituidos que tienen una mayor población del confórmero requerido debido a la tensión alílica.
Sin embargo, las modificaciones a la reacción enfocadas en remediar sus problemas continúan siendo un área activa de investigación académica.
En particular, la investigación se ha centrado en algunas áreas clave: hacer que la reacción sea catalítica en el promotor, efectuar la reacción con promotores más suaves para mejorar la tolerancia del grupo funcional, dirigir la regioselectividad del paso de eliminación y mejorar la estereoselectividad general.
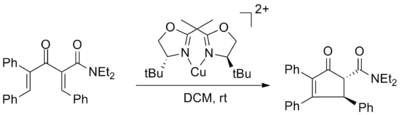
Además, se han desarrollado variantes enantioselectivas de varios tipos.
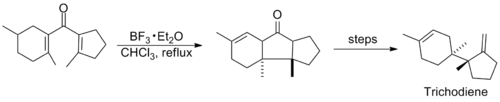
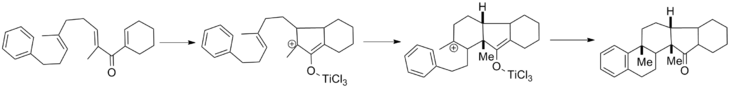
[13] La reacción de ciclización de Nazarov dirigida por silicio se empleó posteriormente en la síntesis del producto natural silfineno, que se muestra a continuación.
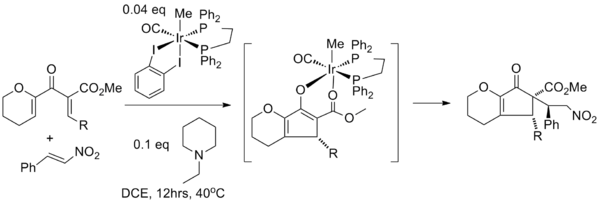
[14] A menudo es posible lograr la activación catalítica utilizando solo un grupo donante o extractor, aunque la eficiencia de la reacción (rendimiento, tiempo de reacción, etc.) suele ser menor.
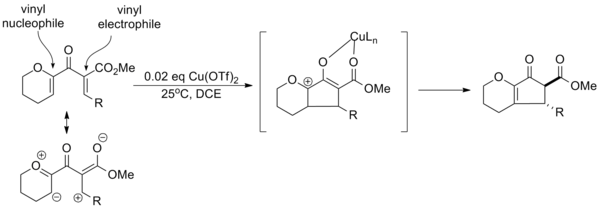
Sin embargo, estos dos pasos pueden ser interrumpidos por varios nucleófilos y electrofilos, respectivamente.
A continuación se muestra una reacción en cascada en la que la captura de cationes sucesiva genera un núcleo pentacíclico en un solo paso con diastereoselectividad completa.
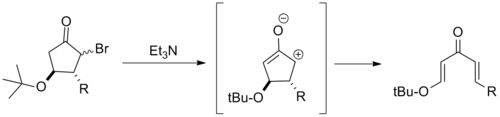
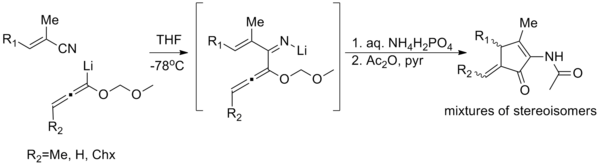
Casi todos los intentos se basan en la idea de torquoselectividad; Seleccionar una dirección para que los grupos vinílicos 'giren' a su vez establezca la estereoquímica como se muestra a continuación.
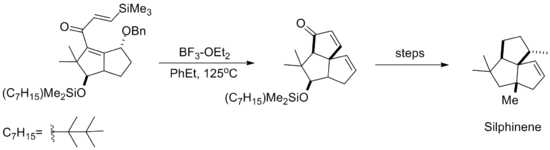
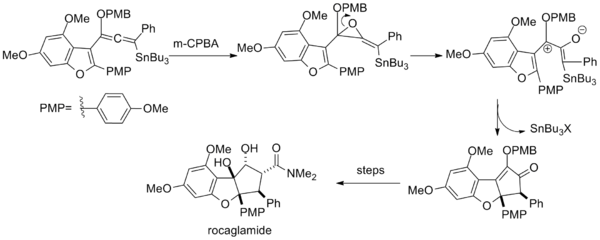
(El material de partida no es enantiopuro, pero la retención del exceso enantiomérico sugiere que el auxiliar dirige la ciclización.
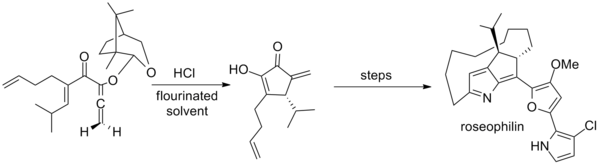
El paso clave emplea una mezcla inusual de hexafluoro-2-propanol y trifluoroetanol como solvente.
[25][26] Incluso estos tienden a sufrir una estereoselectividad deficiente, bajos rendimientos o un alcance estrecho.