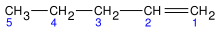Alqueno
Antiguamente se los denominaba como olefinas dadas las propiedades que presentaban sus representantes más simples, principalmente el eteno, para reaccionar con halógenos y producir óleos.
[1][2][3] Los alquenos acíclicos, con un solo doble enlace y ningún otro grupo funcional (también conocidos como mono-enos) forman una serie homóloga de hidrocarburos con la fórmula general CnH2n } con n igual o superior a 2 (es decir, dos hidrógenos menos que el alcano correspondiente).
Cuando n es cuatro o más, son posibles isómeros, que se distinguen por la posición y conformación del doble enlace.
Los alquenos son compuestos generalmente incoloros no polares, algo similares a los alcanos pero más reactivos.
Los primeros miembros de la serie son gases o líquidos a temperatura ambiente.
Nombrar al hidrocarburo principal: Se ha de encontrar la cadena carbonada más larga que contenga el enlace doble, no necesariamente la de mayor tamaño, colocando los localizadores que tengan el menor número en los enlaces dobles, numerando los átomos de carbono en la cadena comenzando en el extremo más cercano al enlace doble.
Si la cadena principal tiene sustituyentes iguales en el mismo átomo de carbono separando por comas los números localizadores que se repiten en el átomo, estos se separan por un guion de los prefijos: di, tri, tetra, etc.
Los sustituyentes se escriben de acuerdo con el orden alfabético con su respectivo localizador químico.
De estar el alqueno fuera de la cadena principal, este se nombra como sustituyente con la terminación “-enilo", contando al carbono unido a la cadena principal como el carbono número 1.
Los alquenos que tienen cuatro o más átomos de carbono pueden formar diversos isómeros estructurales.
Al combinarse estos orbitales sp2 los electrones compartidos forman un enlace σ, situado entre ambos carbonos.
En la primera figura puede observarse el radical metilo, con un orbital sp2 que enlaza a un átomo de hidrógeno al carbono.
En consecuencia, los isómeros cis o trans se interconvierten tan lentamente que pueden manipularse libremente en condiciones ambientales sin isomerización.
Los alquenos más complejos pueden nombrarse con la notación E-Z para moléculas con tres o cuatro sustituyentes (grupos laterales) diferentes.
Esto se utiliza principalmente para la fabricación de pequeños alquenos (hasta seis carbonos).
[12] En relación con esto está la deshidrogenación catalítica, en la que un alcano pierde hidrógeno a altas temperaturas para producir un alqueno correspondiente.
La presencia del doble enlace modifica ligeramente las propiedades físicas de los alquenos frente a los alcanos.
La presencia del doble enlace se nota más en aspectos como la polaridad y la acidez.
El enlace alquilo-alquenilo está polarizado en la dirección del átomo con orbital sp2, ya que la componente s de un orbital sp2 es mayor que en un sp3 (esto podría interpretarse como la proporción de s a p en la molécula, siendo 1:2 en sp2 y 1:3 en sp3, aunque dicha idea es simplemente intuitiva).
Esto se debe a que los electrones situados en orbitales híbridos con mayor componente s están más ligados al núcleo que los p, por tanto el orbital sp2 es ligeramente atrayente de electrones y aparece una polarización neta hacia él.