Fosforilasa cinasa
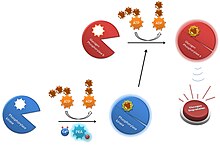
Cuando no están modificadas las subunidades α y β inhiben la catálisis enzimática, pero la fosforilación de ambas unidades por la proteína cinasa A reduce sus actividades inhibidoras.
La subunidad δ es la proteína eucariota calmodulina que tiene 4 sitios de unión para el ion calcio.
Los genes relacionados con la fosforilasa cinasa son: Las fichas proteína de esta página representan las subunidades gamma catalíticas.
El sustrato de la PHK, la glucógeno fosforilasa, fue aislada por Carl and Gerty Cori en los años 1930.
Por razones desconocidas en aquel momento, la única forma de aislar la glucógeno fosforilasa "a" del tejido muscular era mediante filtración por papel - otros métodos como la centrifugación no funcionaban.
[9][10][11] Los detalles precisos del mecanismo catalítico de la fosforilasa cinasa todavía están en estudio.
Las hormonas, los impulsos nerviosos y la contracción del músculo estimulan la liberación de iones calcio.
Adicionalmente, la liberación de iones calcio del retículo sarcoplasmático durante la contracción muscular inactiva la subunidad δ inhibidora y activa totalmente la PHK.
El glucagón y la epinefrina pueden empezar la cascada cAMP-proteína cinasa A, pero la epinefrina también se puede unir a un receptor alfa-adrenérgico para empezar una cascada fosfoinositida resultando en la liberación de Ca2+ del retículo endoplasmático.
[26][27] Clínicamente, estas enfermedades se manifiestan por un desarrollo físico lento durante la niñez y por un tamaño anormalmente grande del hígado.
Estas dos enfermedades están debidas a mutaciones en el gen PHKA2, que codifica la subunidad α de la fosforilasa cinasa.