Electrón
[8] Un electrón no tiene componentes o subestructura conocidos; en otras palabras, generalmente se define como una partícula elemental.
Cuando un electrón colisiona con un positrón, las dos partículas pueden resultar totalmente aniquiladas y producir fotones de rayos gamma.
Los electrones son especialmente apropiados para demostrar experimentalmente esta dualidad a causa de su ínfima masa.
Sin embargo, el electrón no fue identificado como una partícula hasta 1897 por Joseph John Thomson y su equipo de físicos británicos.
Además, aplicando un campo magnético, Crookes fue capaz de desviar los rayos, con lo cual demostró que el haz se comportaba como si estuviera cargado negativamente.
[30] El físico británico nacido en Alemania Arthur Schuster continuó los experimentos iniciados por Crookes colocando placas de metal paralelas a los rayos catódicos y aplicando un potencial eléctrico entre ellas.
[28][31] En 1896, el físico británico Joseph John Thomson, junto con sus colegas John Sealy Townsend y Harold Albert Wilson,[12] llevó a cabo experimentos que indicaron que los rayos catódicos eran realmente partículas únicas y no ondas, átomos o moléculas, tal como se creía anteriormente.
[28] En 1896, mientras estudiaba los minerales naturalmente fluorescentes, el físico francés Henri Becquerel descubrió que estos emitían radiación sin estar expuestos a ninguna fuente de energía externa.
En 1911, Charles Wilson usó este principio para concebir su cámara de niebla, la cual permitía fotografiar los caminos trazados por partículas cargadas tales como electrones.
[39] En 1914, los experimentos llevados a cabo hasta ese momento por los físicos Ernest Rutherford, Henry Moseley, James Franck y Gustav Hertz ya habían establecido en gran medida la estructura del átomo como un núcleo denso de carga positiva rodeado por electrones de masa reducida.
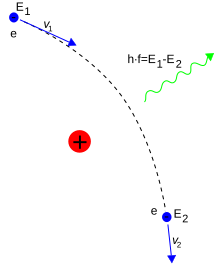
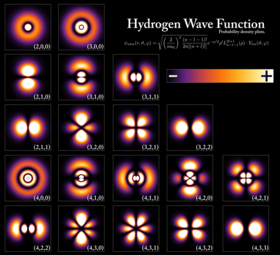
Los electrones se podían mover entre estos estados —u órbitas— mediante la emisión o absorción de fotones a frecuencias específicas.
Dirac aplicó consideraciones relativísticas y simétricas a la formulación hamiltoniana de la mecánica cuántica del campo electromagnético.
[56] Esta partícula fue descubierta en 1932 por Carl David Anderson, quien propuso que los electrones estándar se llamaran «negatrones» y que el término «electrón» se usara como un término genérico para describir las variantes cargadas tanto positiva como negativamente.
[58] El primer intento con éxito de acelerar electrones utilizando la inducción electromagnética fue llevado a cabo en 1942 por Donald Kerst.
En realidad, el llamado radio clásico del electrón tiene poco que ver con la estructura fundamental verdadera de esta partícula.
[77] Los electrones son partículas idénticas porque no se pueden distinguir el uno del otro a partir de sus propiedades físicas intrínsecas.
Esta propiedad de inducción, por ejemplo, es la que da el campo magnético necesario para hacer funcionar un motor eléctrico.
La emisión de energía puede tener lugar cuando un electrón en movimiento es desviado por una partícula cargada (por ejemplo, un protón).
[103] Otros métodos de transferencia orbital son las colisiones con partículas y el efecto Auger.
[114] Cuando los electrones libres —tanto en el vacío como en un metal— se mueven, producen un flujo neto de carga llamado corriente eléctrica que genera un campo magnético.
[119] Los metales son unos conductores del calor relativamente buenos, básicamente porque los electrones deslocalizados se encuentran libres para transportar energía térmica entre átomos.
Mediante su interacción con el medio generan una luz tenue que se llama radiación de Cherenkov.
La mayoría de las partículas que sobrevivieron se aniquilaron unas a otras liberando radiación gamma, la cual recalentó brevemente el Universo.
Algunos isótopos pueden sufrir una desintegración beta negativa por la que emiten un electrón y un antineutrón del núcleo.
[138] Según la física clásica, estos objetos estelares masivos ejercen una atracción gravitatoria lo suficientemente fuerte como para impedir que nada —ni siquiera la radiación electromagnética— escape más allá del radio de Schwarzschild.
Cuando un electrón enlazado se mueve entre diferentes niveles de energía del átomo, este absorbe o emite fotones a frecuencias características.
El ARPES se puede usar para determinar la dirección, velocidad y difusión de los electrones dentro del material.
[155][156] La litografía por haz de electrones (EBL, en su acrónimo en inglés) es un método para grabar semiconductores a resoluciones más pequeñas que un micrómetro.
La teleradioterapia mediante electrones es útil para tratar lesiones de la piel tales como carcinomas basocelulares.
Sin embargo, actualmente ya han sido reemplazados por aparatos de estado sólido tales como el transistor.