Ecuación química
[1] La ecuación química ayuda a visualizar más fácilmente los reactivos y los productos.
[2] Una ecuación química debe satisfacer una serie de leyes, de forma simultánea:[3][4] Nótese que no se especifica que el proceso en cuestión ocurra realmente en la naturaleza o el laboratorio.
Cada sustancia se especifica mediante su fórmula química, opcionalmente precedida de un número llamado coeficiente estequiométrico.[5].
Si no se escribe explícitamente, el coeficiente es igual a 1.
Las sustancias múltiples en cualquier lado de la ecuación están separadas entre sí por un signo más.
Como ejemplo, la ecuación para la reacción de ácido clorhídrico con sodio puede denotarse: Dado que las fórmulas son bastante simples, esta ecuación podría leerse como "dos H-C-L más dos N-A rendimientos[6] dos N-A-C-L y H dos".
donde: La interpretación física de los coeficientes estequiométricos, si estos son números enteros y positivos, puede ser en átomos o moles.
Así, se diría de la ecuación de geometría estequiométrica se subdivide en la siguiente: Por ejemplo el gas dihidrógeno (H2) puede reaccionar con dioxígeno (O2) para dar agua en fase (termodinámica) gas (H2O).
Los números delante de las fórmulas son llamados coeficientes estequiométricos.
Finalmente (pero no menos importante), se deben agregar (entre paréntesis y como subíndice) los estados de agregación molecular de cada sustancia participante: sólido (s), líquido (l), acuoso (aq) o gaseoso (g).
Una ecuación química se equilibra asignando valores adecuados a los coeficientes estequiométricos.
Las ecuaciones sencillas pueden equilibrarse por inspección, es decir, por ensayo y error.
Otra técnica consiste en resolver un sistema de ecuaciones lineales.
Las ecuaciones equilibradas suelen escribirse con los coeficientes de número-natural más pequeños.
Así, el ejemplo introductorio puede reescribirse como En algunas circunstancias, los coeficientes fraccionarios son incluso inevitables.
Balance de la ecuación química para la combustión total de metano se realiza mediante los siguientes pasos: Para cada elemento químico (o nucleído o resto no modificado o carga) i, el requerimiento de su conservación se puede expresar mediante la ecuación matemática: donde Los resultados son un sistema de ecuaciones lineales homogéneas, las cuales se resuelven directamente utilizando métodos matemáticos.
Una solución "preferida" es una con un número entero, mayormente positivo [11] Asignemos variables a los coeficientes estequiométricos de la ecuación química del apartado anterior y escribamos las ecuaciones lineales correspondientes:
Una letra griega delta (Δ) mayúscula a un triángulo (△)[12] se coloca en la flecha de la reacción para indicar que se agrega energía en forma de calor a la reacción.
Del mismo modo, si una reacción requiere un determinado medio con ciertas características específicas, entonces el nombre del ácido o la base que se utiliza como medio puede colocarse encima de la flecha.

4 + 2 O
2 → CO
2 + 2 H
2 O , hay que anteponer un coeficiente 2 al gas oxígeno en el lado de los reactantes y al agua en el lado de los productos para que, según la ley de conservación de la masa, la cantidad de cada elemento no varíe durante la reacción.
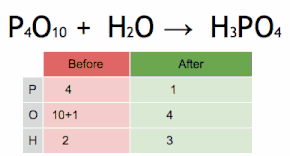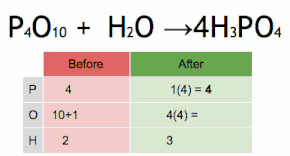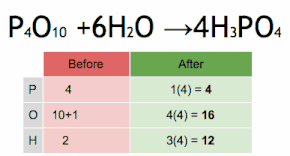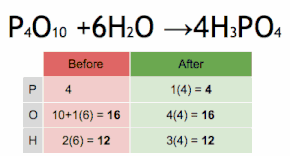
Esta ecuación química se equilibra multiplicando primero H 3 PO 4 por 4 para igualar el número de átomos de P, y luego multiplicando a H 2 O por seis para equilibrar el número de átomos de H y O.