El etiquetado isotópico (o marcaje isotópico ) es una técnica utilizada para rastrear el paso de un isótopo (un átomo con una variación detectable en el recuento de neutrones) a través de una reacción química , una vía metabólica o una célula biológica . El reactivo se "marca" reemplazando uno o más átomos específicos con sus isótopos. Luego se deja que el reactivo experimente la reacción. La posición de los isótopos en los productos se mide para determinar la secuencia que siguió el átomo isotópico en la reacción o la ruta metabólica de la célula. Los nucleidos utilizados en el marcaje isotópico pueden ser nucleidos estables o radionucleidos . En este último caso, el marcaje se denomina radiomarcaje .
En el marcaje isotópico, existen múltiples formas de detectar la presencia de isótopos marcadores; a través de su masa , modo vibratorio o desintegración radiactiva . La espectrometría de masas detecta la diferencia en la masa de un isótopo, mientras que la espectroscopia infrarroja detecta la diferencia en los modos de vibración del isótopo. La resonancia magnética nuclear detecta átomos con diferentes proporciones giromagnéticas. La desintegración radiactiva se puede detectar mediante una cámara de ionización o autorradiografías de geles.
Un ejemplo del uso del marcaje isotópico es el estudio del fenol (C 6 H 5 OH) en agua mediante la sustitución del hidrógeno común ( protio ) por deuterio ( marcaje de deuterio ). Al agregar fenol al agua deuterada (agua que contiene D 2 O además de la habitual H 2 O), se observa la sustitución del hidrógeno por deuterio en el grupo hidroxilo del fenol (lo que da como resultado C 6 H 5 OD), lo que indica que el fenol sufre fácilmente Reacciones de intercambio de hidrógeno con agua. Sólo el grupo hidroxilo se ve afectado, lo que indica que los otros 5 átomos de hidrógeno no participan en las reacciones de intercambio. [ cita necesaria ]

Un trazador isotópico (también "marcador isotópico" o "etiqueta isotópica") se utiliza en química y bioquímica para ayudar a comprender las reacciones e interacciones químicas. En esta técnica, uno o más átomos de la molécula de interés se sustituyen por un átomo del mismo elemento químico , pero de un isótopo diferente (como un isótopo radiactivo utilizado en el rastreo radiactivo ). Como el átomo marcado tiene el mismo número de protones, se comportará casi exactamente de la misma manera que su homólogo no marcado y, con pocas excepciones, no interferirá con la reacción que se investiga. La diferencia en el número de neutrones , sin embargo, hace que se pueda detectar por separado del resto de átomos del mismo elemento.
La resonancia magnética nuclear (RMN) y la espectrometría de masas (EM) se utilizan para investigar los mecanismos de las reacciones químicas. La RMN y la EM detectan diferencias isotópicas, lo que permite determinar información sobre la posición de los átomos marcados en la estructura de los productos. Con información sobre la posición de los átomos isotópicos en los productos, se puede determinar la vía de reacción que utilizan los metabolitos iniciales para convertirse en productos. Los isótopos radiactivos se pueden probar utilizando autorradiografías de geles en electroforesis en gel . La radiación emitida por los compuestos que contienen isótopos radiactivos oscurece un trozo de película fotográfica , registrando la posición de los compuestos marcados entre sí en el gel.
Los trazadores de isótopos se utilizan habitualmente en forma de proporciones de isótopos. Al estudiar la proporción entre dos isótopos del mismo elemento, evitamos efectos que involucran la abundancia general del elemento, que generalmente anulan las variaciones mucho más pequeñas en las abundancias isotópicas. Los trazadores isotópicos son algunas de las herramientas más importantes en geología porque pueden usarse para comprender procesos de mezcla complejos en los sistemas terrestres. En el título Geoquímica de isótopos se analiza más a fondo la aplicación de los trazadores isotópicos en geología .
Los trazadores isotópicos suelen subdividirse en dos categorías: trazadores de isótopos estables y trazadores de isótopos radiogénicos . Los trazadores de isótopos estables implican únicamente isótopos no radiogénicos y normalmente dependen de la masa. En teoría, cualquier elemento con dos isótopos estables puede utilizarse como trazador isotópico. Sin embargo, los trazadores de isótopos estables más utilizados implican isótopos relativamente ligeros, que se fraccionan fácilmente en los sistemas naturales. Véase también firma isotópica . Un trazador de isótopos radiogénicos [2] implica un isótopo producido por desintegración radiactiva , que suele estar en proporción con un isótopo no radiogénico (cuya abundancia en la tierra no varía debido a la desintegración radiactiva).
El etiquetado de isótopos estables implica el uso de isótopos no radiactivos que pueden actuar como trazadores utilizados para modelar varios sistemas químicos y bioquímicos. El isótopo elegido puede actuar como etiqueta en ese compuesto que puede identificarse mediante resonancia magnética nuclear (RMN) y espectrometría de masas (EM). Algunos de los isótopos estables más comunes son 2 H, 13 C y 15 N, que pueden producirse además en disolventes de RMN , aminoácidos , ácidos nucleicos , lípidos , metabolitos comunes y medios de crecimiento celular . [4] Los compuestos producidos utilizando isótopos estables se especifican por el porcentaje de isótopos marcados (es decir, el 30 % de glucosa 13 C uniformemente marcada contiene una mezcla que está marcada en un 30 % con isótopos de 13 carbono y un 70 % de carbono naturalmente marcado) o por el porcentaje específico de isótopos marcados. posiciones de carbono marcadas en el compuesto (es decir, glucosa 1-13 C que está marcada en la primera posición de carbono de la glucosa).
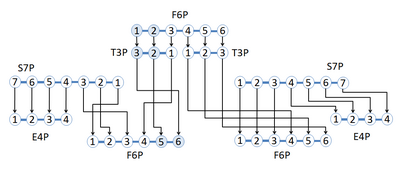
Se muestra una red de reacciones adoptadas de la vía de la glucólisis y la vía de las pentosas fosfato en la que el isótopo de carbono marcado se reorganiza en diferentes posiciones de carbono a lo largo de la red de reacciones. La red comienza con fructosa 6-fosfato (F6P), que tiene 6 átomos de carbono con una etiqueta 13 C en las posiciones de carbono 1 y 2. 1,2- 13 C F6P se convierte en dos gliceraldehído 3-fosfato (G3P), uno 2,3 - 13 C T3P y un T3P sin etiquetar. El 2,3-13 C T3P ahora se puede hacer reaccionar con sedoheptulosa 7-fosfato (S7P) para formar un eritrosa 4-fosfato (E4P) sin marcar y un 5,6-13 C F6P. El T3P sin etiquetar reaccionará con el S7P para sintetizar productos sin etiquetar. [3] La figura demuestra el uso del marcaje con isótopos estables para descubrir el reordenamiento de los átomos de carbono a través de reacciones que utilizan compuestos marcados en posiciones específicas.

El análisis de flujo metabólico (MFA) mediante etiquetado de isótopos estables es una herramienta importante para explicar el flujo de ciertos elementos a través de las vías y reacciones metabólicas dentro de una célula . Se alimenta la célula con un marcador isotópico y luego se permite que la célula crezca utilizando el alimento marcado. Para el análisis del flujo metabólico estacionario, la célula debe alcanzar un estado estacionario (los isótopos que entran y salen de la célula permanecen constantes con el tiempo) o un estado casi estacionario (el estado estacionario se alcanza durante un período de tiempo determinado). [5] Se determina el patrón isotópico del metabolito de salida. El patrón de isótopos de salida proporciona información valiosa, que se puede utilizar para encontrar la magnitud del flujo , la tasa de conversión de reactivos a productos , a través de cada reacción. [6]
La figura demuestra la capacidad de utilizar diferentes etiquetas para determinar el flujo a través de una determinada reacción. Supongamos que el metabolito original, un compuesto de tres carbonos, tiene la capacidad de dividirse en un metabolito de dos carbonos y un metabolito de un carbono en una reacción y luego recombinarse o seguir siendo un metabolito de tres carbonos. Si la reacción cuenta con dos isótopos del metabolito en igual proporción, uno completamente marcado (círculos azules), comúnmente conocido como uniformemente marcado, y otro completamente sin marcar (círculos blancos). La ruta del lado izquierdo del diagrama no muestra ningún cambio en los metabolitos, mientras que el lado derecho muestra la división y la recombinación. Como se muestra, si el metabolito solo toma la vía por el lado izquierdo, permanece en una proporción de 50 a 50 de metabolito uniformemente marcado y no marcado. Si el metabolito sólo toma el lado derecho pueden ocurrir nuevos patrones de etiquetado, todos en igual proporción. Pueden ocurrir otras proporciones dependiendo de la cantidad del metabolito original que sigue el lado izquierdo de la vía versus el lado derecho de la vía. Aquí se muestran las proporciones para una situación en la que la mitad de los metabolitos toman el lado izquierdo y la otra mitad el derecho, pero pueden ocurrir otras proporciones. [7] Estos patrones de átomos marcados y átomos no marcados en un compuesto representan isotopómeros . Midiendo la distribución de isotopómeros de los metabolitos etiquetados de manera diferente, se puede determinar el flujo a través de cada reacción. [8]
MFA combina los datos recopilados del etiquetado de isótopos con la estequiometría de cada reacción, restricciones y un procedimiento de optimización para resolver un mapa de flujo. Las reacciones ir reversibles proporcionan las restricciones termodinámicas necesarias para encontrar los flujos. Se construye una matriz que contiene la estequiometría de las reacciones. Los flujos intracelulares se estiman mediante el uso de un método iterativo en el que los flujos simulados se conectan al modelo estequiométrico. Los flujos simulados se muestran en un mapa de flujo, que muestra la velocidad de los reactivos que se convierten en productos para cada reacción. [6] En la mayoría de los mapas de flujo, cuanto más gruesa es la flecha, mayor es el valor de flujo de la reacción. [9]
Se puede utilizar cualquier técnica para medir la diferencia entre isotopómeros . Los dos métodos principales, la resonancia magnética nuclear (RMN) y la espectrometría de masas (EM), se han desarrollado para medir isotopómeros de masa en el marcaje de isótopos estables.
La RMN de protones fue la primera técnica utilizada para experimentos de marcado con 13 C. Con este método, cada posición de carbono protonado dentro de un grupo de metabolitos particular se puede observar por separado de las otras posiciones. [10] Esto permite conocer el porcentaje de isotopómeros marcados en esa posición específica. El límite de la RMN de protones es que si hay n átomos de carbono en un metabolito, solo puede haber como máximo n valores de enriquecimiento posicional diferentes, lo que es solo una pequeña fracción de la información total del isotopómero. Aunque el uso del marcaje de RMN de protones es limitante, los experimentos de RMN de protones puros son mucho más fáciles de evaluar que los experimentos con más información de isotopómeros.
Además de la RMN de protones , el uso de técnicas de RMN 13C permitirá una visión más detallada de la distribución de los isotopómeros. Un átomo de carbono marcado producirá diferentes señales de división hiperfinas dependiendo del estado de etiquetado de sus vecinos directos en la molécula. [10] Un pico singlete emerge si los átomos de carbono vecinos no están marcados. Un pico doblete surge si sólo se marca un átomo de carbono vecino. El tamaño de la división del doblete depende del grupo funcional del átomo de carbono vecino. Si se marcan dos átomos de carbono vecinos, un doblete de dobletes puede degenerar en un triplete si las divisiones del doblete son iguales.
Los inconvenientes de utilizar técnicas de RMN para fines de análisis del flujo metabólico es que se diferencia de otras aplicaciones de RMN porque es una disciplina bastante especializada. Es posible que un espectrómetro de RMN no esté disponible directamente para todos los equipos de investigación. La optimización de los parámetros de medición de RMN y el análisis adecuado de las estructuras de los picos requieren un especialista en RMN capacitado. Ciertos metabolitos también pueden requerir procedimientos de medición especializados para obtener datos de isotopómeros adicionales. Además, se necesitan herramientas de software especialmente adaptadas para determinar la cantidad precisa de áreas de picos, así como para identificar la descomposición de picos singletes, dobletes y tripletes entrelazados.
A diferencia de la resonancia magnética nuclear, la espectrometría de masas (MS) es otro método más aplicable y sensible a los experimentos de análisis de flujo metabólico. Los instrumentos MS están disponibles en diferentes variantes. A diferencia de la resonancia magnética nuclear bidimensional ( 2D-NMR ), los instrumentos de MS funcionan directamente con hidrolizado . [10]
En la cromatografía de gases-espectrometría de masas ( GC-MS ), la MS se acopla a un cromatógrafo de gases para separar los compuestos del hidrolizado. A continuación, los compuestos que eluyen de la columna de GC se ionizan y al mismo tiempo se fragmentan. La ventaja de utilizar GC-MS es que no solo se miden los isotopómeros de masa del ion molecular sino también el espectro de isotopómeros de masa de varios fragmentos, lo que aumenta significativamente la información medida.
En la cromatografía líquida-espectrometría de masas ( LC-MS ), el GC se reemplaza por un cromatógrafo líquido. [11] La principal diferencia es que la derivatización química no es necesaria. Sin embargo, las aplicaciones de LC-MS a MFA son raras.
En cada caso, los instrumentos de MS dividen una distribución de isotopómero particular por su peso molecular. Todos los isotopómeros de un metabolito particular que contienen la misma cantidad de átomos de carbono marcados se recolectan en una señal máxima. Debido a que cada isotopómero contribuye exactamente a un pico en el espectro de MS, el valor porcentual se puede calcular para cada pico, lo que produce la fracción de isotopómero en masa. [10] Para un metabolito con n átomos de carbono, se producen n+1 mediciones. Después de la normalización quedan exactamente n cantidades informativas de isotopómeros en masa. [10]
El inconveniente de utilizar técnicas de MS es que para la cromatografía de gases, la muestra debe prepararse mediante derivatización química para obtener moléculas con carga. Existen numerosos compuestos que se utilizan para derivatizar muestras. N,N-Dimetilformamida dimetil acetal (DMFDMA) [12] y N-(terc-butildimetilsilil)-N-metiltrifluoroacetamida (MTBSTFA) [13] son dos ejemplos de compuestos que se han utilizado para derivatizar aminoácidos.
Además, los fuertes efectos isotópicos observados afectan el tiempo de retención de isotopómeros marcados de manera diferente en la columna de GC. También se debe evitar la sobrecarga de la columna del GC. [13]
Por último, la abundancia natural de otros átomos además del carbono también conduce a una alteración en el espectro de isotopómeros de masa. Por ejemplo, cada átomo de oxígeno de la molécula también podría estar presente como un isótopo de 17 O y un isótopo de 18 O. Un impacto más significativo de la abundancia natural de isótopos es el efecto del silicio con una abundancia natural de los isótopos 29 Si y 30 Si. El Si se utiliza en agentes derivatizantes para técnicas de MS. [10]
El etiquetado radioisotópico es una técnica para rastrear el paso de una muestra de sustancia a través de un sistema. La sustancia está "marcada" incluyendo radionucleidos en su composición química. Cuando estos decaen , se puede determinar su presencia detectando la radiación que emiten. El marcaje radioisotópico es un caso especial de marcaje isotópico.
Para estos fines, un tipo de desintegración radiactiva particularmente útil es la emisión de positrones . Cuando un positrón choca con un electrón, libera dos fotones de alta energía que viajan en direcciones diametralmente opuestas. Si el positrón se produce dentro de un objeto sólido, es probable que lo haga antes de viajar más de un milímetro. [ cita necesaria ] Si se pueden detectar ambos fotones, la ubicación del evento de desintegración se puede determinar con mucha precisión.
Estrictamente hablando, el etiquetado radioisotópico incluye solo casos en los que los experimentadores introducen artificialmente la radiactividad, pero algunos fenómenos naturales permiten realizar análisis similares. En particular, la datación radiométrica utiliza un principio estrechamente relacionado.
El uso de trazadores de isótopos estables para estudiar la nutrición mineral y el metabolismo en humanos se informó por primera vez en la década de 1960. [14] Si bien los radioisótopos se habían utilizado en la investigación sobre nutrición humana durante varias décadas antes, los isótopos estables presentaban una opción más segura, especialmente en sujetos por los cuales existe una gran preocupación por la exposición a la radiación, por ejemplo, mujeres embarazadas y lactantes y niños. Otras ventajas que ofrecen los isótopos estables incluyen la capacidad de estudiar elementos que no tienen radioisótopos adecuados y estudiar el comportamiento de los trazadores a largo plazo. [15] [16] Así, el uso de isótopos estables se volvió común con la creciente disponibilidad de materiales isotópicamente enriquecidos y espectrómetros de masas inorgánicos. El uso de isótopos estables en lugar de radioisótopos tiene varios inconvenientes: se requieren mayores cantidades de trazador, que tiene el potencial de perturbar el mineral existente de forma natural; la preparación de muestras analíticas es más compleja y la instrumentación de espectrometría de masas más costosa; la presencia del marcador en cuerpos completos o tejidos particulares no se puede medir externamente. [17] Sin embargo, las ventajas han prevalecido al hacer de los isótopos estables el estándar en los estudios en humanos.
La mayoría de los minerales que son esenciales para la salud humana y de particular interés para los investigadores en nutrición tienen isótopos estables, algunos de ellos muy adecuados como trazadores biológicos debido a su baja abundancia natural. [15] [17] El hierro , el zinc , el calcio , el cobre , el magnesio , el selenio y el molibdeno se encuentran entre los minerales esenciales que tienen isótopos estables a los que se han aplicado métodos de trazadores de isótopos. En particular, se han estudiado ampliamente el hierro, el zinc y el calcio.
Los aspectos de la nutrición/metabolismo mineral que se estudian incluyen la absorción (del tracto gastrointestinal al cuerpo), la distribución, el almacenamiento, la excreción y la cinética de estos procesos. Los trazadores de isótopos se administran a los sujetos por vía oral (con o sin alimentos, o con un suplemento mineral) y/o por vía intravenosa. Luego se mide el enriquecimiento de isótopos en el plasma sanguíneo, los eritrocitos, la orina y/o las heces. [18] [19] El enriquecimiento también se ha medido en la leche materna [20] y el contenido intestinal. El diseño del experimento con trazadores a veces difiere entre minerales debido a diferencias en su metabolismo. Por ejemplo, la absorción de hierro generalmente se determina a partir de la incorporación del trazador en los eritrocitos, mientras que la absorción de zinc o calcio se mide a partir de la aparición del trazador en plasma, orina o heces. [21] [22] La administración de múltiples trazadores de isótopos en un solo estudio es común, lo que permite el uso de métodos de medición más confiables e investigaciones simultáneas de múltiples aspectos del metabolismo.
La medición de la absorción de minerales de la dieta, a menudo concebida como biodisponibilidad , es la aplicación más común de los métodos de trazadores isotópicos a la investigación en nutrición. Entre los propósitos de tales estudios se encuentran las investigaciones de cómo la absorción se ve influenciada por el tipo de alimento (por ejemplo, fuente vegetal versus animal, leche materna versus fórmula), otros componentes de la dieta (por ejemplo, fitato ), enfermedades y trastornos metabólicos (por ejemplo, disfunción entérica ambiental). ), el ciclo reproductivo, la cantidad de minerales en la dieta, la deficiencia crónica de minerales , la edad del sujeto y los mecanismos homeostáticos. Cuando se dispone de resultados de tales estudios para un mineral, pueden servir como base para estimaciones de las necesidades fisiológicas y dietéticas humanas del mineral. [23] [24]
Cuando el marcador se administra con alimentos con el fin de observar la absorción y el metabolismo de minerales, puede tener la forma de una etiqueta intrínseca o extrínseca. [25] [26] Una etiqueta intrínseca es un isótopo que se ha introducido en el alimento durante su producción, enriqueciendo así el contenido mineral natural del alimento, mientras que el etiquetado extrínseco se refiere a la adición de un isótopo trazador al alimento durante el estudio. Debido a que es un enfoque costoso y que consume mucho tiempo, el etiquetado intrínseco no se utiliza de forma rutinaria. Los estudios que comparan las mediciones de absorción utilizando el etiquetado intrínseco y extrínseco de varios alimentos generalmente han demostrado una buena concordancia entre los dos métodos de etiquetado, lo que respalda la hipótesis de que los minerales extrínsecos y naturales se manejan de manera similar en el tracto gastrointestinal humano.
El enriquecimiento se cuantifica a partir de la medición de las relaciones isotópicas , la relación entre el isótopo trazador y un isótopo de referencia, mediante espectrometría de masas. Diferentes investigadores han adoptado múltiples definiciones y cálculos de enriquecimiento. [27] Los cálculos de enriquecimiento se vuelven más complejos cuando se utilizan múltiples trazadores simultáneamente. Debido a que las preparaciones de isótopos enriquecidos nunca son isotópicamente puras, es decir, contienen todos los isótopos del elemento en abundancias no naturales, los cálculos de enriquecimiento de múltiples trazadores de isótopos deben tener en cuenta la perturbación de cada proporción de isótopos por la presencia de los otros trazadores. [27]
Debido a la prevalencia de las deficiencias minerales y su impacto crítico en la salud y el bienestar humanos en los países pobres en recursos, la Agencia Internacional de Energía Atómica ha publicado recientemente descripciones detalladas y completas de métodos de isótopos estables para facilitar la difusión de este conocimiento a investigadores más allá. centros académicos occidentales. [21] [28]
En proteómica , el estudio del conjunto completo de proteínas expresadas por un genoma , la identificación de biomarcadores de enfermedades puede implicar el uso de etiquetado de isótopos estables mediante aminoácidos en cultivos celulares (SILAC), que proporciona formas de aminoácidos marcadas con isótopos que se utilizan para estimar los niveles de proteínas. . [29] En la proteína recombinante, las proteínas manipuladas se producen en grandes cantidades y el etiquetado de isótopos es una herramienta para analizar proteínas relevantes. El método solía consistir en enriquecer selectivamente los núcleos con 13 C o 15 N o agotar 1 H de ellos. El recombinante se expresaría en E. coli con medios que contengan cloruro de amonio 15 N como fuente de nitrógeno. [30] Las proteínas resultantes marcadas con 15 N luego se purifican mediante afinidad por el metal inmovilizado y se estima su porcentaje. Para aumentar el rendimiento de proteínas marcadas y reducir el costo de los medios marcados con isótopos, un procedimiento alternativo aumenta principalmente la masa celular utilizando medios no marcados antes de introducirla en una cantidad mínima de medios marcados. [31] Otra aplicación del marcaje isotópico sería medir la síntesis de ADN, es decir, la proliferación celular in vitro . Utiliza el marcaje con H 3 -timidina para comparar el patrón de síntesis (o secuencia) en las células. [32]
Los trazadores isotópicos se utilizan para examinar procesos en sistemas naturales, especialmente en ambientes terrestres y acuáticos. En la ciencia del suelo, los trazadores de 15 N se utilizan ampliamente para estudiar el ciclo del nitrógeno, mientras que el 13 C y el 14 C, estables y radioisótopos de carbono respectivamente, se utilizan para estudiar el recambio de compuestos orgánicos y la fijación de CO 2 por los autótrofos . Por ejemplo, Marsh et al. (2005) utilizaron urea marcada doblemente ( 15 N- y 14 C) para demostrar la utilización del compuesto por oxidantes de amoníaco como fuente de energía (oxidación de amoníaco) y fuente de carbono (fijación de carbono quimioautótrofa). [33] El agua deuterada también se utiliza para rastrear el destino y las edades del agua en un árbol [34] o en un ecosistema. [35]
Los trazadores también se utilizan ampliamente en oceanografía para estudiar una amplia gama de procesos. Los isótopos utilizados suelen aparecer de forma natural con fuentes y tasas de formación y desintegración bien establecidas. Sin embargo, también se pueden utilizar con gran éxito isótopos antropogénicos. Los investigadores miden las proporciones isotópicas en diferentes lugares y momentos para inferir información sobre los procesos físicos del océano.
El océano es una extensa red de transporte de partículas. Los isótopos de torio pueden ayudar a los investigadores a descifrar el movimiento vertical y horizontal de la materia. El 234 Th tiene una tasa de producción constante y bien definida en el océano y una vida media de 24 días. Se ha demostrado que este isótopo natural varía linealmente con la profundidad. Por lo tanto, cualquier cambio en este patrón lineal puede atribuirse al transporte de 234 Th en partículas. Por ejemplo, proporciones isotópicas bajas en aguas superficiales con valores muy altos a unos pocos metros de profundidad indicarían un flujo vertical en dirección descendente. Además, es posible localizar el isótopo de torio en una profundidad determinada para descifrar el transporte lateral de partículas. [36]
La circulación dentro de los sistemas locales, como bahías, estuarios y aguas subterráneas, puede examinarse con isótopos de radio. El 223 Ra tiene una vida media de 11 días y puede ocurrir naturalmente en lugares específicos de ríos y fuentes de agua subterránea. La proporción isotópica del radio disminuirá a medida que el agua del río de origen ingrese a una bahía o estuario. Midiendo la cantidad de 223 Ra en distintos lugares, se puede descifrar un patrón de circulación. [37] Este mismo proceso exacto también se puede utilizar para estudiar el movimiento y la descarga de aguas subterráneas. [38]
Se pueden utilizar varios isótopos de plomo para estudiar la circulación a escala global. Los diferentes océanos (es decir, el Atlántico, el Pacífico, el Índico, etc.) tienen firmas isotópicas diferentes. Esto se debe a diferencias en las proporciones isotópicas de sedimentos y rocas dentro de los diferentes océanos. [39] Debido a que los diferentes isótopos del plomo tienen vidas medias de 50 a 200 años, no hay tiempo suficiente para que las proporciones isotópicas se homogenicen en todo el océano. Por lo tanto, se puede utilizar un análisis preciso de las proporciones isotópicas de Pb para estudiar la circulación de los diferentes océanos. [40]
Los isótopos con vidas medias extremadamente largas y sus productos de desintegración pueden utilizarse para estudiar procesos de varios millones de años, como la tectónica y el cambio climático extremo. Por ejemplo, en la datación rubidio-estroncio , la proporción isotópica de estroncio ( 87 Sr/ 86 Sr) se puede analizar dentro de los núcleos de hielo para examinar los cambios a lo largo de la vida de la Tierra. Las diferencias en esta proporción dentro del núcleo de hielo indicarían alteraciones significativas en la geoquímica de la Tierra. [40]
Los procesos antes mencionados se pueden medir utilizando isótopos naturales. Sin embargo, los isótopos antropogénicos también son extremadamente útiles para mediciones oceanográficas. Las pruebas de armas nucleares liberaron una gran cantidad de isótopos poco comunes en los océanos del mundo. 3 H, 129 I y 137 Cs se pueden encontrar disueltos en agua de mar, mientras que 241 Am y 238 Pu están unidos a partículas. Los isótopos disueltos en agua son particularmente útiles para estudiar la circulación global. Por ejemplo, las diferencias en las proporciones isotópicas laterales dentro de un océano pueden indicar fuertes frentes o giros de agua. [41] Por el contrario, los isótopos unidos a partículas se pueden utilizar para estudiar el transporte de masa dentro de columnas de agua. Por ejemplo, niveles altos de Am o Pu pueden indicar una surgencia cuando se observan a grandes profundidades, o una surgencia cuando se observan en la superficie. [42]
{{cite book}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite book}}: CS1 maint: multiple names: authors list (link) CS1 maint: numeric names: authors list (link){{cite book}}: CS1 maint: others (link)