La temperatura termodinámica es una cantidad definida en termodinámica a diferencia de la teoría cinética o la mecánica estadística .
Históricamente, Lord Kelvin definió la temperatura termodinámica en términos de una relación macroscópica entre el trabajo termodinámico y la transferencia de calor como se define en termodinámica, pero el kelvin fue redefinido por un acuerdo internacional en 2019 en términos de fenómenos que ahora se entienden como manifestaciones de la energía cinética. del libre movimiento de partículas microscópicas como átomos, moléculas y electrones. Desde el punto de vista termodinámico, por razones históricas, por cómo se define y se mide, esta definición cinética microscópica se considera una temperatura "empírica". Se adoptó porque en la práctica generalmente se puede medir con mayor precisión que la temperatura termodinámica de Kelvin.
Una temperatura termodinámica de cero es de particular importancia para la tercera ley de la termodinámica . Por convención, se informa en la escala Kelvin de temperatura en la que la unidad de medida es el kelvin (símbolo de unidad: K). A modo de comparación, una temperatura de 295 K corresponde a 21,85 °C y 71,33 °F.
La temperatura termodinámica, a diferencia de la temperatura SI, se define en términos de un ciclo macroscópico de Carnot. La temperatura termodinámica es de importancia en termodinámica porque se define en términos puramente termodinámicos. La temperatura SI es conceptualmente muy diferente de la temperatura termodinámica. La temperatura termodinámica se definió rigurosamente históricamente mucho antes de que existiera un conocimiento cabal de las partículas microscópicas como los átomos, las moléculas y los electrones.
El Sistema Internacional de Unidades (SI) especifica la escala absoluta internacional para medir la temperatura y la unidad de medida kelvin (símbolo de unidad: K) para valores específicos a lo largo de la escala. El kelvin también se usa para indicar intervalos de temperatura (un lapso o diferencia entre dos temperaturas) según el siguiente ejemplo de uso: "Una soldadura de estaño/plomo 60/40 no es eutéctica y es plástica en un rango de 5 kelvin a medida que se solidifica". ". Un intervalo de temperatura de un grado Celsius tiene la misma magnitud que un kelvin.
La magnitud del kelvin se redefinió en 2019 en relación con la propiedad física subyacente a la temperatura termodinámica: la energía cinética del movimiento de las partículas atómicas libres. La redefinición fijó la constante de Boltzmann exactamente en1,380 649 × 10 −23 julios por kelvin (J/K). [1]
La propiedad microscópica que confiere temperatura a las sustancias materiales se puede comprender fácilmente examinando la ley de los gases ideales , que relaciona, según la constante de Boltzmann, cómo la energía térmica provoca cambios definidos con precisión en la presión y la temperatura de ciertos gases. Esto se debe a que los gases monoatómicos como el helio y el argón se comportan cinéticamente como bolas de billar esféricas y perfectamente elásticas que se mueven libremente y que se mueven sólo en un subconjunto específico de los posibles movimientos que pueden ocurrir en la materia: el que comprende los tres grados de libertad de traslación . Los grados de libertad de traslación son los conocidos movimientos similares a bolas de billar a lo largo de los ejes X, Y y Z del espacio 3D (ver Fig. 1, a continuación). Esta es la razón por la que todos los gases nobles tienen la misma capacidad calorífica específica por átomo y por la que ese valor es el más bajo de todos los gases.
Sin embargo, las moléculas (dos o más átomos unidos químicamente) tienen estructura interna y, por lo tanto, grados de libertad internos adicionales (ver Fig. 3, a continuación), lo que hace que las moléculas absorban más energía térmica para cualquier cantidad dada de aumento de temperatura que las moléculas monoatómicas. gases. La energía térmica nace en todos los grados de libertad disponibles; esto está de acuerdo con el teorema de equipartición , por lo que todos los grados de libertad internos disponibles tienen la misma temperatura que sus tres grados de libertad externos. Sin embargo, la propiedad que da a todos los gases su presión , que es la fuerza neta por unidad de área sobre un recipiente que surge de las partículas de gas que retroceden de él, es función de la energía cinética transmitida por los tres grados de traslación de los átomos y moléculas que se mueven libremente. de libertad. [2]
Fijar la constante de Boltzmann en un valor específico, junto con otras reglas, tuvo el efecto de establecer con precisión la magnitud del intervalo unitario de temperatura del SI, el kelvin, en términos del comportamiento cinético promedio de los gases nobles. Además, el punto de partida de la escala de temperatura termodinámica, el cero absoluto, se reafirmó como el punto en el que la energía cinética promedio cero permanece en una muestra; el único movimiento de partículas que queda es el que comprende vibraciones aleatorias debidas a la energía del punto cero.
Las escalas de temperatura son numéricas. El cero numérico de una escala de temperatura no está ligado al cero absoluto de temperatura. Sin embargo, algunas escalas de temperatura tienen su cero numérico coincidente con el cero absoluto de temperatura. Algunos ejemplos son la escala de temperatura internacional SI, la escala de temperatura de Rankine y la escala de temperatura termodinámica. Otras escalas de temperatura tienen su cero numérico alejado del cero absoluto de temperatura. Algunos ejemplos son la escala Fahrenheit y la escala Celsius.
En el punto cero de la temperatura termodinámica, el cero absoluto , las partículas constituyentes de la materia tienen un movimiento mínimo y no pueden enfriarse más. [3] [4] El cero absoluto, que es una temperatura de cero kelvin (0 K), corresponde precisamente a −273,15 °C y −459,67 °F. A la materia en el cero absoluto no le queda energía cinética promedio transferible y el único movimiento de partículas restante se debe a un fenómeno mecánico cuántico siempre generalizado llamado ZPE ( energía de punto cero ). [5] Aunque los átomos en, por ejemplo, un recipiente de helio líquido que estaba precisamente en el cero absoluto todavía se empujarían ligeramente debido a la energía del punto cero, un motor térmico teóricamente perfecto con helio como uno de sus fluidos de trabajo nunca podría transferir cualquier energía cinética neta ( energía térmica ) al otro fluido de trabajo y no podría ocurrir ningún trabajo termodinámico .
La temperatura generalmente se expresa en términos absolutos cuando se examina científicamente las interrelaciones de la temperatura con otras propiedades físicas de la materia, como su volumen o presión (ver la ley de Gay-Lussac ), o la longitud de onda de la radiación de cuerpo negro emitida . La temperatura absoluta también es útil al calcular velocidades de reacciones químicas (consulte la ecuación de Arrhenius ). Además, la temperatura absoluta se usa típicamente en criogenia y fenómenos relacionados como la superconductividad , según el siguiente ejemplo de uso: "Convenientemente, la temperatura de transición del tantalio ( Tc ) de 4,4924 kelvin está ligeramente por encima del punto de ebullición del helio de 4,2221 K".
La constante de Boltzmann y sus fórmulas relacionadas describen el ámbito de la cinética de partículas y los vectores de velocidad, mientras que ZPE ( energía de punto cero ) es un campo de energía que empuja las partículas en formas descritas por las matemáticas de la mecánica cuántica. En colisiones atómicas y moleculares en gases, ZPE introduce un grado de caos , es decir, imprevisibilidad, en la cinética de rebote; es tan probable que haya menos movimiento de partículas inducido por ZPE después de una colisión determinada como más . Esta naturaleza aleatoria de ZPE es la razón por la que no tiene ningún efecto neto sobre la presión o el volumen de cualquier cantidad masiva (una cantidad estadísticamente significativa de partículas) de gases. Sin embargo, en temperatura T = 0 materia condensada ; Por ejemplo, en sólidos y líquidos, la ZPE provoca empujones interatómicos donde, de otro modo, los átomos estarían perfectamente estacionarios. Dado que los efectos del mundo real que el ZPE tiene sobre las sustancias pueden variar a medida que se altera un sistema termodinámico (por ejemplo, debido al ZPE, el helio no se congelará a menos que esté bajo una presión de al menos 2,5 MPa (25 bar )), el ZPE es Es en gran medida una forma de energía térmica y puede incluirse adecuadamente al contar la energía interna de una sustancia.
Aunque ha habido muchas otras escalas de temperatura a lo largo de la historia, solo ha habido dos escalas para medir la temperatura termodinámica donde el cero absoluto es su punto nulo (0): la escala Kelvin y la escala Rankine .
En todo el mundo científico, donde las mediciones modernas casi siempre se realizan utilizando el Sistema Internacional de Unidades, la temperatura termodinámica se mide utilizando la escala Kelvin. La escala Rankine forma parte de las unidades de ingeniería inglesas en los Estados Unidos y se utiliza en ciertos campos de la ingeniería, particularmente en obras de referencia heredadas. La escala Rankine utiliza el grado Rankine (símbolo: °R) como unidad, que tiene la misma magnitud que el grado Fahrenheit (símbolo: °F).
Un incremento unitario de un kelvin es exactamente 1,8 veces un grado Rankine; por lo tanto, para convertir una temperatura específica en la escala Kelvin a la escala Rankine, x K = 1,8 x °R , y para convertir una temperatura en la escala Rankine a la escala Kelvin, x °R = x /1,8 K. En consecuencia, el cero absoluto es "0" en ambas escalas, pero el punto de fusión del hielo de agua (0 °C y 273,15 K) es 491,67 °R.
Para convertir intervalos de temperatura (un lapso o diferencia entre dos temperaturas), se utilizan las mismas fórmulas del párrafo anterior; por ejemplo, un rango de 5 kelvins es exactamente igual a un rango de 9 grados Rankine.
Durante 65 años, entre 1954 y la redefinición de las unidades básicas del SI en 2019 , un intervalo de temperatura de un kelvin se definió como1/273.16la diferencia entre el punto triple del agua y el cero absoluto. La resolución de 1954 de la Oficina Internacional de Pesas y Medidas (conocida por el acrónimo en francés BIPM), más resoluciones y publicaciones posteriores, definieron el punto triple del agua exactamente como 273,16 K y reconocieron que era una "práctica común" aceptar que Debido a convenciones anteriores (es decir, que 0 °C se había definido durante mucho tiempo como el punto de fusión del agua y que se había determinado experimentalmente que el punto triple del agua era indistinguiblemente cercano a 0,01 °C), la diferencia entre la escala Celsius y La escala Kelvin se acepta como 273,15 kelvin; es decir, 0 °C corresponden a 273,15 kelvin. [6] El efecto neto de esta, así como de resoluciones posteriores, fue doble: 1) definieron el cero absoluto exactamente como 0 K, y 2) definieron que el punto triple de agua especial controlada isotópicamente llamado agua oceánica media estándar de Viena se produjo precisamente en 273,16 K y 0,01 °C. Un efecto de las resoluciones antes mencionadas fue que el punto de fusión del agua, aunque muy cercano a 273,15 K y 0 °C, no era un valor definitorio y estaba sujeto a refinamiento con mediciones más precisas.
El estándar BIPM de 1954 hizo un buen trabajo al establecer, dentro de las incertidumbres debidas a las variaciones isotópicas entre muestras de agua, temperaturas alrededor de los puntos triple y de congelación del agua, pero requirió valores intermedios entre el punto triple y el cero absoluto, así como valores extrapolados. desde temperatura ambiente y más allá, para ser determinado experimentalmente mediante aparatos y procedimientos en laboratorios individuales. Esta deficiencia fue abordada por la Escala Internacional de Temperatura de 1990 , o ITS-90, que definió 13 puntos adicionales, desde 13,8033 K hasta 1.357,77 K. Si bien es una definición, la ITS-90 tuvo, y todavía tiene, algunos desafíos, en parte porque ocho de sus valores extrapolados dependen de los puntos de fusión o congelación de las muestras de metal, que deben permanecer extremadamente puras para que sus puntos de fusión o congelación se vean afectados (generalmente reducidos).
La redefinición de las unidades básicas del SI en 2019 tuvo principalmente como objetivo desacoplar gran parte de los fundamentos definitorios del sistema SI del kilogramo , que fue el último artefacto físico que definió una unidad base del SI (un cilindro de platino/iridio almacenado bajo tres campanas de cristal anidadas en una caja fuerte situada en Francia) y cuya estabilidad era muy cuestionable. La solución requería que cuatro constantes físicas, incluida la constante de Boltzmann, fueran definidas fijamente.
Asignar a la constante de Boltzmann un valor definido con precisión no tuvo ningún efecto práctico en la termometría moderna, excepto en las mediciones más exquisitamente precisas. Antes de la redefinición, el punto triple del agua era exactamente 273,16 K y 0,01 °C y se determinó experimentalmente que la constante de Boltzmann era1,380 649 03 (51) × 10 −23 J/K , donde "(51)" denota la incertidumbre en los dos dígitos menos significativos (el 03) y equivale a una incertidumbre estándar relativa de 0,37 ppm. [7] Posteriormente, al definir la constante de Boltzmann como exactamente1,380 649 × 10 −23 J/K , la incertidumbre de 0,37 ppm se transfirió al punto triple del agua, que se convirtió en un valor determinado experimentalmente de273,1600 ± 0,0001 K (0,0100 ± 0,0001 °C ). Que el punto triple del agua acabara estando extremadamente cerca de 273,16 K después de la redefinición del SI no fue casualidad; El valor final de la constante de Boltzmann se determinó, en parte, mediante experimentos inteligentes con argón y helio que utilizaron el punto triple del agua como temperatura de referencia clave. [8] [9]
A pesar de la redefinición de 2019, las celdas de punto triple de agua continúan sirviendo en la termometría moderna como referencias de calibración extremadamente precisas a 273,16 K y 0,01 °C. Además, el punto triple del agua sigue siendo uno de los 14 puntos de calibración que componen el ITS-90, que se extiende desde el punto triple del hidrógeno (13,8033 K) hasta el punto de congelación del cobre (1.357,77 K), que es un rango termodinámico casi cien veces mayor. temperatura.
La temperatura termodinámica de cualquier cantidad total de una sustancia (una cantidad estadísticamente significativa de partículas) es directamente proporcional a la energía cinética promedio de un tipo específico de movimiento de partículas conocido como movimiento de traslación . Estos movimientos simples en las tres dimensiones del espacio de los ejes X, Y y Z significan que las partículas se mueven en los tres grados espaciales de libertad . Esta forma particular de energía cinética a veces se denomina temperatura cinética . El movimiento de traslación no es más que una forma de energía térmica y es lo que da a los gases no sólo su temperatura, sino también su presión y la gran mayoría de su volumen. Esta relación entre la temperatura, la presión y el volumen de los gases se establece mediante la fórmula de la ley de los gases ideales pV = nRT y está incorporada en las leyes de los gases .
Aunque la energía cinética transmitida exclusivamente en los tres grados de libertad de traslación comprende la temperatura termodinámica de una sustancia, las moléculas, como se puede ver en la figura 3, pueden tener otros grados de libertad, todos los cuales se clasifican en tres categorías: longitud del enlace, ángulo de enlace y rotación. Las tres categorías adicionales no están necesariamente disponibles para todas las moléculas, e incluso para las moléculas que pueden experimentar las tres, algunas pueden "congelarse" por debajo de cierta temperatura. No obstante, todos esos grados de libertad que están disponibles para las moléculas bajo un conjunto particular de condiciones contribuyen a la capacidad calorífica específica de una sustancia; es decir, aumentan la cantidad de calor (energía cinética) necesaria para elevar una determinada cantidad de sustancia en un kelvin o un grado Celsius.
La relación entre energía cinética, masa y velocidad viene dada por la fórmula E k = 1/2mv2 . [10] En consecuencia, las partículas con una unidad de masa que se mueven a una unidad de velocidad tienen precisamente la misma energía cinética y precisamente la misma temperatura que aquellas con cuatro veces la masa pero la mitad de la velocidad.
El grado en que la energía cinética del movimiento de traslación en un conjunto estadísticamente significativo de átomos o moléculas en un gas contribuye a la presión y el volumen de ese gas es una función proporcional de la temperatura termodinámica establecida por la constante de Boltzmann (símbolo: k B ). . La constante de Boltzmann también relaciona la temperatura termodinámica de un gas con la energía cinética media del movimiento de traslación de una partícula individual de la siguiente manera:
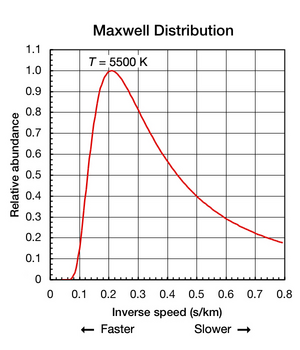
Si bien la constante de Boltzmann es útil para encontrar la energía cinética media en una muestra de partículas, es importante señalar que incluso cuando una sustancia está aislada y en equilibrio termodinámico (todas las partes están a una temperatura uniforme y no entra ni sale calor). de él), los movimientos de traslación de átomos y moléculas individuales ocurren en una amplia gama de velocidades (ver animación en la Fig. 1 arriba). En cualquier instante, la proporción de partículas que se mueven a una velocidad determinada dentro de este rango está determinada por la probabilidad como se describe en la distribución de Maxwell-Boltzmann . El gráfico que se muestra aquí en la Fig. 2 muestra la distribución de velocidades de los átomos de helio de 5500 K. Tienen una velocidad más probable de 4,780 km/s (0,2092 s/km). Sin embargo, una cierta proporción de átomos en un instante dado se mueve más rápido mientras que otros se mueven relativamente lentamente; algunos están momentáneamente prácticamente detenidos (fuera del eje x hacia la derecha). Este gráfico utiliza velocidad inversa para su eje x , por lo que la forma de la curva se puede comparar fácilmente con las curvas de la Fig. 5 a continuación. En ambos gráficos, el cero en el eje x representa una temperatura infinita. Además, los ejes xey en ambos gráficos se escalan proporcionalmente.
Aunque se requiere equipo de laboratorio muy especializado para detectar directamente movimientos de traslación, las colisiones resultantes de átomos o moléculas con pequeñas partículas suspendidas en un fluido producen un movimiento browniano que puede observarse con un microscopio común. Los movimientos de traslación de las partículas elementales son muy rápidos [11] y se requieren temperaturas cercanas al cero absoluto para observarlos directamente. Por ejemplo, cuando los científicos del NIST alcanzaron una temperatura fría récord de 700 nK (billonésimas de kelvin) en 1994, utilizaron equipos láser de red óptica para enfriar adiabáticamente átomos de cesio . Luego apagaron los láseres de atrapamiento y midieron directamente las velocidades de los átomos de 7 mm por segundo para calcular su temperatura. [12] Las fórmulas para calcular la velocidad y la rapidez del movimiento de traslación se dan en la siguiente nota al pie. [13]
No es difícil imaginar movimientos atómicos debidos a la temperatura cinética, ni distinguir entre tales movimientos y aquellos debidos a energía de punto cero. Considere el siguiente experimento mental hipotético, como se ilustra en la figura 2.5 a la izquierda, con un átomo que está extremadamente cerca del cero absoluto. Imagínese mirar a través de un microscopio óptico común configurado con una potencia de 400, que es aproximadamente el aumento práctico máximo para los microscopios ópticos. Estos microscopios generalmente proporcionan campos de visión de poco más de 0,4 mm de diámetro. En el centro del campo de visión hay un único átomo de argón levitado (el argón comprende aproximadamente el 0,93% del aire) que está iluminado y brilla contra un fondo oscuro. Si este átomo de argón estuviera a una billonésima parte de un kelvin por encima del cero absoluto, [14] y se moviera perpendicular al campo de visión hacia la derecha, necesitaría 13,9 segundos para moverse desde el centro del imagen hasta la marca de 200 micrones; esta distancia recorrida es aproximadamente la misma que el ancho del punto al final de esta oración en los monitores de computadora modernos. A medida que el átomo de argón se movía lentamente, la fluctuación posicional debida a la energía del punto cero sería mucho menor que la resolución de 200 nanómetros (0,0002 mm) de un microscopio óptico. Es importante destacar que la velocidad de traslación del átomo de 14,43 micrones por segundo constituye toda su energía cinética retenida debido a que no está precisamente en el cero absoluto. Si el átomo estuviera precisamente en el cero absoluto, los empujones imperceptibles debido a la energía del punto cero harían que se desviara muy ligeramente, pero el átomo estaría perpetuamente ubicado, en promedio, en el mismo punto dentro del campo de visión. Esto es análogo a un barco al que se le ha apagado el motor y ahora se balancea ligeramente en aguas oceánicas relativamente tranquilas y sin viento; Aunque el barco se mueve aleatoriamente de un lado a otro, a largo plazo permanece en el mismo lugar y no avanza en el agua. En consecuencia, un átomo que estuviera precisamente en el cero absoluto no estaría "inmóvil" y, sin embargo, un conjunto estadísticamente significativo de tales átomos tendría energía cinética neta cero disponible para transferir a cualquier otro conjunto de átomos. Esto se debe a que, independientemente de la temperatura cinética del segundo grupo de átomos, ellos también experimentan los efectos de la energía del punto cero. Tales son las consecuencias de la mecánica estadística y de la naturaleza de la termodinámica.

Como se mencionó anteriormente, hay otras formas en que las moléculas pueden moverse además de los tres grados de libertad de traslación que confieren a las sustancias su temperatura cinética. Como se puede ver en la animación de la derecha, las moléculas son objetos complejos; son una población de átomos y la agitación térmica puede tensar sus enlaces químicos internos de tres maneras diferentes: mediante rotación, longitud del enlace y movimientos del ángulo del enlace; Todos estos son tipos de grados de libertad internos . Esto hace que las moléculas se distingan de las sustancias monoatómicas (que constan de átomos individuales) como los gases nobles helio y argón , que tienen sólo tres grados de libertad de traslación (los ejes X, Y y Z). La energía cinética se almacena en los grados de libertad internos de las moléculas, lo que les da una temperatura interna . Aunque estos movimientos se denominan "internos", las porciones externas de las moléculas aún se mueven, algo así como el movimiento de un globo de agua estacionario . Esto permite el intercambio bidireccional de energía cinética entre movimientos internos y movimientos de traslación con cada colisión molecular. En consecuencia, a medida que se elimina energía interna de las moléculas, tanto su temperatura cinética (la energía cinética del movimiento de traslación) como su temperatura interna disminuyen simultáneamente en proporciones iguales. Este fenómeno se describe mediante el teorema de equipartición , que establece que para cualquier cantidad total de una sustancia en equilibrio, la energía cinética del movimiento de las partículas se distribuye uniformemente entre todos los grados de libertad activos disponibles para las partículas. Dado que la temperatura interna de las moléculas suele ser igual a su temperatura cinética, la distinción suele ser de interés sólo en el estudio detallado de fenómenos de equilibrio termodinámico no local (LTE), como la combustión , la sublimación de sólidos y la difusión de gases calientes. en un vacío parcial.
La energía cinética almacenada internamente en las moléculas hace que las sustancias contengan más energía térmica a cualquier temperatura determinada y absorban energía interna adicional para un aumento de temperatura determinado. Esto se debe a que cualquier energía cinética que, en un instante dado, esté ligada a movimientos internos, no contribuye a los movimientos de traslación de las moléculas en ese mismo instante. [15] Esta energía cinética adicional simplemente aumenta la cantidad de energía interna que la sustancia absorbe para un aumento de temperatura determinado. Esta propiedad se conoce como capacidad calorífica específica de una sustancia .
Diferentes moléculas absorben diferentes cantidades de energía interna por cada aumento incremental de temperatura; es decir, tienen diferentes capacidades caloríficas específicas. La alta capacidad calorífica específica surge, en parte, porque las moléculas de ciertas sustancias poseen más grados de libertad internos que otras. Por ejemplo, el nitrógeno a temperatura ambiente , que es una molécula diatómica , tiene cinco grados de libertad activos: los tres comprenden movimiento de traslación más dos grados de libertad de rotación interna. No es sorprendente que, de acuerdo con el teorema de equipartición, el nitrógeno tenga cinco tercios de la capacidad calorífica específica por mol (un número específico de moléculas) que los gases monoatómicos. [16] Otro ejemplo es la gasolina (ver tabla que muestra su capacidad calorífica específica). La gasolina puede absorber una gran cantidad de energía térmica por mol con sólo un modesto cambio de temperatura porque cada molécula comprende un promedio de 21 átomos y, por lo tanto, tiene muchos grados de libertad internos. Moléculas incluso más grandes y complejas pueden tener docenas de grados de libertad internos.
La conducción de calor es la difusión de energía térmica desde las partes calientes de un sistema hacia las partes frías. Un sistema puede ser una única entidad masiva o una pluralidad de entidades masivas discretas. El término volumen en este contexto significa una cantidad estadísticamente significativa de partículas (que puede ser una cantidad microscópica). Siempre que la energía térmica se difunde dentro de un sistema aislado, las diferencias de temperatura dentro del sistema disminuyen (y la entropía aumenta).
Un mecanismo particular de conducción de calor ocurre cuando el movimiento de traslación, el movimiento de las partículas subyacente a la temperatura, transfiere impulso de una partícula a otra en colisiones. En los gases, estos movimientos de traslación son de la naturaleza que se muestra arriba en la Fig. 1 . Como se puede ver en esa animación, no sólo el impulso (calor) se difunde por todo el volumen del gas a través de colisiones en serie, sino que moléculas o átomos enteros pueden avanzar hacia nuevos territorios, trayendo consigo su energía cinética. En consecuencia, las diferencias de temperatura se igualan muy rápidamente en todos los gases, especialmente en los átomos o moléculas ligeros; la convección acelera este proceso aún más. [17]
Sin embargo, el movimiento de traslación en los sólidos toma la forma de fonones (ver Fig. 4 a la derecha). Los fonones son paquetes de ondas cuantificados y restringidos que viajan a la velocidad del sonido de una sustancia determinada. La forma en que los fonones interactúan dentro de un sólido determina diversas propiedades, incluida su conductividad térmica. En los sólidos eléctricamente aislantes, la conducción de calor basada en fonones suele ser ineficiente [ 18] y dichos sólidos se consideran aislantes térmicos (como el vidrio, el plástico, el caucho, la cerámica y la roca). Esto se debe a que en los sólidos, los átomos y las moléculas están encerrados en un lugar con respecto a sus vecinos y no pueden deambular libremente.
Sin embargo, los metales no se limitan únicamente a la conducción de calor basada en fonones. La energía térmica se conduce a través de los metales extraordinariamente rápido porque, en lugar de colisiones directas entre moléculas, la gran mayoría de la energía térmica está mediada por electrones de conducción móviles y muy ligeros . Por eso existe una correlación casi perfecta entre la conductividad térmica de los metales y su conductividad eléctrica . [19] Los electrones de conducción confieren a los metales su extraordinaria conductividad porque están deslocalizados (es decir, no ligados a un átomo específico) y se comportan más bien como una especie de gas cuántico debido a los efectos de la energía del punto cero (para más información sobre ZPE, consulte Nota 1 a continuación). Además, los electrones son relativamente livianos y tienen una masa en reposo de sólo 1 ⁄ 1836 de la de un protón . Esta es aproximadamente la misma proporción que una bala corta .22 (29 granos o 1,88 g ) en comparación con el rifle que la dispara. Como escribió Isaac Newton con su tercera ley del movimiento ,
Ley #3: Todas las fuerzas ocurren en pares, y estas dos fuerzas son iguales en magnitud y opuestas en dirección.
Sin embargo, una bala acelera más rápido que un rifle si se le aplica la misma fuerza. Dado que la energía cinética aumenta con el cuadrado de la velocidad, casi toda la energía cinética va a la bala, no al rifle, aunque ambos experimentan la misma fuerza de los gases propulsores en expansión. De la misma manera, debido a que son mucho menos masivos, los electrones de conducción móviles transportan fácilmente la energía térmica. Además, debido a que están deslocalizados y son muy rápidos, la energía térmica cinética se conduce extremadamente rápido a través de metales con abundantes electrones de conducción.

La radiación térmica es un subproducto de las colisiones que surgen de diversos movimientos vibratorios de los átomos. Estas colisiones hacen que los electrones de los átomos emitan fotones térmicos (conocido como radiación de cuerpo negro ). Los fotones se emiten cada vez que se acelera una carga eléctrica (como sucede cuando las nubes de electrones de dos átomos chocan). Incluso las moléculas individuales con temperaturas internas superiores al cero absoluto también emiten radiación de cuerpo negro desde sus átomos. En cualquier cantidad masiva de una sustancia en equilibrio, los fotones del cuerpo negro se emiten en un rango de longitudes de onda en un espectro que tiene una forma de campana llamada curva de Planck (ver gráfico en la Fig. 5 a la derecha). La parte superior de una curva de Planck ( la longitud de onda máxima de emitancia ) se encuentra en una parte particular del espectro electromagnético dependiendo de la temperatura del cuerpo negro. Las sustancias a temperaturas criogénicas extremas emiten longitudes de onda de radio largas, mientras que las temperaturas extremadamente altas producen rayos gamma cortos (consulte la Tabla de temperaturas comunes ).
La radiación del cuerpo negro difunde energía térmica por toda una sustancia a medida que los fotones son absorbidos por los átomos vecinos, transfiriendo impulso en el proceso. Los fotones del cuerpo negro también escapan fácilmente de una sustancia y pueden ser absorbidos por el entorno; En el proceso se pierde energía cinética.
Según lo establecido por la ley de Stefan-Boltzmann , la intensidad de la radiación del cuerpo negro aumenta como la cuarta potencia de la temperatura absoluta. Por lo tanto, un cuerpo negro a 824 K (justo antes de brillar en rojo opaco) emite 60 veces la potencia radiante que a 296 K (temperatura ambiente). Por eso es tan fácil sentir el calor radiante de los objetos calientes a distancia. A temperaturas más altas, como las que se encuentran en una lámpara incandescente , la radiación de cuerpo negro puede ser el mecanismo principal por el cual la energía térmica escapa de un sistema.
La siguiente tabla muestra varios puntos en la escala termodinámica, en orden de temperatura creciente.

La energía cinética del movimiento de las partículas es sólo uno de los factores que contribuyen a la energía térmica total de una sustancia; otra son las transiciones de fase , que son la energía potencial de los enlaces moleculares que se pueden formar en una sustancia a medida que se enfría (como durante la condensación y la congelación ). La energía térmica necesaria para una transición de fase se llama calor latente . Este fenómeno puede entenderse más fácilmente considerándolo en la dirección inversa: el calor latente es la energía necesaria para romper los enlaces químicos (como durante la evaporación y la fusión ). Casi todo el mundo está familiarizado con los efectos de las transiciones de fase; por ejemplo, el vapor a 100 °C puede causar quemaduras graves mucho más rápido que el aire a 100 °C de un secador de pelo . Esto ocurre porque se libera una gran cantidad de calor latente cuando el vapor se condensa en agua líquida sobre la piel.
Aunque la energía térmica se libera o absorbe durante las transiciones de fase, los elementos químicos puros , los compuestos y las aleaciones eutécticas no muestran ningún cambio de temperatura mientras los sufren (ver Fig. 7 , abajo a la derecha). Consideremos un tipo particular de transición de fase: la fusión. Cuando un sólido se funde, los enlaces químicos de la red cristalina se rompen; la sustancia está pasando de lo que se conoce como un estado más ordenado a un estado menos ordenado . En la Fig. 7 , el derretimiento del hielo se muestra dentro del cuadro inferior izquierdo, de azul a verde.

En un punto termodinámico específico, el punto de fusión (que es 0 °C en un amplio rango de presión en el caso del agua), todos los átomos o moléculas se encuentran, en promedio, en el umbral máximo de energía que sus enlaces químicos pueden soportar sin romperse. de la celosía. Los enlaces químicos son fuerzas de todo o nada: o se mantienen firmes o se rompen; no hay ningún estado intermedio. En consecuencia, cuando una sustancia está en su punto de fusión, cada julio de energía térmica añadido sólo rompe los enlaces de una cantidad específica de sus átomos o moléculas, [33] convirtiéndolos en un líquido de exactamente la misma temperatura; no se agrega energía cinética al movimiento de traslación (que es lo que da temperatura a las sustancias). El efecto es parecido al de las palomitas de maíz : a una determinada temperatura, la energía térmica adicional no puede calentar los granos hasta que se completa la transición (explotar). Si el proceso se invierte (como en la congelación de un líquido), se debe eliminar energía térmica de una sustancia.
Como se indicó anteriormente, la energía térmica necesaria para una transición de fase se llama calor latente . En los casos específicos de fusión y congelación, se llama entalpía de fusión o calor de fusión . Si los enlaces moleculares en una red cristalina son fuertes, el calor de fusión puede ser relativamente grande, típicamente en el rango de 6 a 30 kJ por mol para el agua y la mayoría de los elementos metálicos. [34] Si la sustancia es uno de los gases monoatómicos (que tienen poca tendencia a formar enlaces moleculares) el calor de fusión es más modesto, oscilando entre 0,021 y 2,3 kJ por mol. [35] Relativamente hablando, las transiciones de fase pueden ser eventos verdaderamente energéticos. Para derretir completamente el hielo a 0 °C en agua a 0 °C, se deben agregar aproximadamente 80 veces la energía térmica necesaria para aumentar la temperatura de la misma masa de agua líquida en un grado Celsius. Las proporciones de los metales son aún mayores, normalmente en el rango de 400 a 1200 veces. [36] Y la transición de fase de ebullición es mucho más energética que la de congelación. Por ejemplo, la energía necesaria para hervir o vaporizar completamente el agua (lo que se conoce como entalpía de vaporización ) es aproximadamente 540 veces la necesaria para un aumento de un grado. [37]
La considerable entalpía de vaporización del agua es la razón por la que la piel puede quemarse tan rápidamente cuando el vapor se condensa en ella (de rojo a verde en la Fig. 7 arriba); Los vapores de agua (fase gaseosa) se licuan en la piel y liberan una gran cantidad de energía (entalpía) al medio ambiente, incluida la piel, lo que provoca daños en la piel. En la dirección opuesta, esta es la razón por la que la piel se siente fría cuando el agua líquida se evapora (un proceso que ocurre a una temperatura de bulbo húmedo subambiente que depende de la humedad relativa ); La evaporación del agua en la piel toma una gran cantidad de energía del medio ambiente, incluida la piel, lo que reduce la temperatura de la piel. La entalpía de vaporización altamente energética del agua también es un factor importante que explica por qué las cubiertas solares para piscinas (mantas aislantes flotantes que cubren las piscinas cuando no están en uso) son tan efectivas para reducir los costos de calefacción: evitan la evaporación. (En otras palabras, la energía que se obtiene del agua cuando se evapora es limitada). Por ejemplo, la evaporación de sólo 20 mm de agua de una piscina de 1,29 metros de profundidad enfría el agua 8,4 grados Celsius (15,1 °F).
La energía total de todos los movimientos internos y de traslación de las partículas, incluido el de los electrones de conducción, más la energía potencial de los cambios de fase, más la energía del punto cero [5] de una sustancia, comprenden la energía interna de la misma.

A medida que una sustancia se enfría, diferentes formas de energía interna y sus efectos relacionados disminuyen simultáneamente en magnitud: el calor latente de las transiciones de fase disponibles se libera a medida que una sustancia cambia de un estado menos ordenado a un estado más ordenado; los movimientos de traslación de átomos y moléculas disminuyen (su energía cinética o temperatura disminuye); los movimientos internos de las moléculas disminuyen (su energía interna o temperatura disminuye); los electrones de conducción (si la sustancia es conductora eléctrica) viajan algo más lento; [38] y la longitud de onda de emisión máxima de la radiación del cuerpo negro aumenta (la energía de los fotones disminuye). Cuando las partículas de una sustancia están lo más cerca posible del reposo completo y retienen solo el movimiento mecánico cuántico inducido por ZPE (energía de punto cero), la sustancia está a la temperatura del cero absoluto ( T = 0).

Tenga en cuenta que mientras que el cero absoluto es el punto de temperatura termodinámica cero y también es el punto en el que las partículas constituyentes de la materia tienen un movimiento mínimo, el cero absoluto no es necesariamente el punto en el que una sustancia contiene energía interna cero; Hay que ser muy preciso con lo que se entiende por energía interna . A menudo, todos los cambios de fase que pueden ocurrir en una sustancia se habrán producido cuando alcance el cero absoluto. Sin embargo, este no es siempre el caso. En particular, el helio T = 0 permanece líquido a presión ambiente ( Fig. 9 a la derecha) y debe estar bajo una presión de al menos 25 bar (2,5 MPa ) para cristalizar. Esto se debe a que el calor de fusión del helio (la energía necesaria para derretir el hielo de helio) es tan bajo (sólo 21 julios por mol) que el efecto inductor de movimiento de la energía del punto cero es suficiente para evitar que se congele a presiones más bajas.
Una complicación adicional es que muchos sólidos cambian su estructura cristalina a disposiciones más compactas a presiones extremadamente altas (hasta millones de bares o cientos de gigapascales). Estas se conocen como transiciones de fase sólido-sólido en las que se libera calor latente a medida que una red cristalina cambia a una más compacta y termodinámicamente favorable.
Las complejidades anteriores dan lugar a declaraciones generales bastante engorrosas sobre la energía interna en sustancias T = 0. Sin embargo, independientemente de la presión, lo que se puede decir es que en el cero absoluto, todos los sólidos con una red cristalina de menor energía, como aquellos con una disposición más compacta (ver Fig. 8 , arriba a la izquierda), contienen una energía interna mínima, reteniendo solo la debida. al fondo siempre presente de la energía del punto cero. [5] [39] También se puede decir que para una sustancia dada a presión constante, el cero absoluto es el punto de entalpía más baja (una medida del potencial de trabajo que toma en consideración la energía interna, la presión y el volumen). [40] Por último, siempre es cierto decir que todas las sustancias T = 0 contienen energía térmica cinética cero. [5] [13]
La temperatura termodinámica es útil no sólo para los científicos, sino que también puede ser útil para los legos en muchas disciplinas relacionadas con los gases. Al expresar las variables en términos absolutos y aplicar la ley de proporcionalidad temperatura/presión de Gay-Lussac , las soluciones a los problemas cotidianos son sencillas; por ejemplo, calcular cómo un cambio de temperatura afecta la presión dentro de un neumático de automóvil. Si el neumático tiene una presión manométrica en frío [41] de 200 kPa , entonces su presión absoluta es 300 kPa. [42] [43] La temperatura ambiente ("fría" en términos de neumáticos) es 296 K. Si la temperatura del neumático es 20 °C más alta (20 kelvin), la solución se calcula como316 mil/296 mil = 6,8% mayor temperatura termodinámica y presión absoluta; es decir, una presión absoluta de 320 kPa, que es una presión manométrica de 220 kPa.
La temperatura termodinámica está estrechamente ligada a la ley de los gases ideales y sus consecuencias. También se puede vincular a la segunda ley de la termodinámica. Se puede demostrar que la temperatura termodinámica tiene propiedades especiales y, en particular, se puede ver que está definida de manera única (hasta algún factor multiplicativo constante) al considerar la eficiencia de las máquinas térmicas idealizadas . Así, la relación T 2 / T 1 de dos temperaturas T 1 y T 2 es la misma en todas las escalas absolutas.
En sentido estricto, la temperatura de un sistema está bien definida sólo si se encuentra en equilibrio térmico . Desde un punto de vista microscópico, un material está en equilibrio térmico si la cantidad de calor entre sus partículas individuales se anula. Hay muchas escalas de temperatura posibles, derivadas de una variedad de observaciones de fenómenos físicos.
En términos generales, las diferencias de temperatura dictan la dirección del calor entre dos sistemas de modo que su energía combinada se distribuya al máximo entre sus estados más bajos posibles. A esta distribución la llamamos " entropía ". Para comprender mejor la relación entre temperatura y entropía, considere la relación entre calor, trabajo y temperatura ilustrada en la máquina térmica de Carnot . El motor convierte el calor en trabajo dirigiendo un gradiente de temperatura entre una fuente de calor de mayor temperatura, T H , y un disipador de calor de menor temperatura, T C , a través de un pistón lleno de gas. El trabajo realizado por ciclo es igual en magnitud al calor neto absorbido, que es la suma del calor q H absorbido por el motor de la fuente de alta temperatura, más el calor residual emitido por el motor, q C < 0. [44] La eficiencia del motor es el trabajo dividido por el calor puesto en el sistema o
El teorema de Carnot establece que todos los motores reversibles que funcionan entre los mismos depósitos de calor son igualmente eficientes. Por lo tanto, cualquier motor térmico reversible que funcione entre las temperaturas T 1 y T 2 debe tener la misma eficiencia, es decir, la eficiencia es función únicamente de las temperaturas.
Además, un motor térmico reversible que funcione entre un par de depósitos térmicos a temperaturas T 1 y T 3 debe tener la misma eficiencia que uno que consta de dos ciclos, uno entre T 1 y otro a temperatura (intermedia) T 2 , y el segundo entre T2 y T3 . Si este no fuera el caso, entonces se desperdiciará o ganará energía (en la forma de q ), lo que dará como resultado diferentes eficiencias generales cada vez que un ciclo se divide en ciclos componentes; Claramente, un ciclo puede estar compuesto por cualquier número de ciclos más pequeños como opción de diseño del motor, y cualquier motor reversible entre el mismo depósito en T 1 y T 3 debe ser igualmente eficiente independientemente del diseño del motor.
Si elegimos motores en los que el trabajo realizado por el motor de un ciclo y el motor de dos ciclos es el mismo, entonces la eficiencia de cada motor térmico se escribe como se muestra a continuación.
Aquí, el motor 1 es el motor de un ciclo, y los motores 2 y 3 forman el motor de dos ciclos donde está el depósito intermedio en T 2 . También hemos aprovechado el hecho de que el calor pasa a través del depósito térmico intermedio sin perder su energía. (Es decir, no se pierde durante su paso a través del depósito en .) Este hecho se puede probar mediante lo siguiente.
Para tener coherencia en la última ecuación, el calor que fluye desde el motor 2 al depósito intermedio debe ser igual al calor que sale del depósito al motor 3.
Con esta comprensión de q 1 , q 2 y q 3 , matemáticamente,
Pero como la primera función NO es una función de T 2 , el producto de las dos funciones finales DEBE dar como resultado la eliminación de T 2 como variable. Por tanto, la única forma es definir la función f de la siguiente manera:
Es decir, la relación de calor intercambiado es función de las temperaturas respectivas a las que se producen. Podemos elegir cualquier función monótona para nuestro ; [45] es una cuestión de conveniencia y convención que elijamos . Eligiendo entonces una temperatura de referencia fija (es decir, el punto triple del agua), establecemos la escala de temperatura termodinámica.
Tal definición coincide con la de la derivación del gas ideal; También es esta definición de temperatura termodinámica la que nos permite representar la eficiencia de Carnot en términos de T H y T C y, por tanto, derivar que el ciclo de Carnot (completo) es isentrópico:
Sustituyendo esto nuevamente en nuestra primera fórmula de eficiencia se obtiene una relación en términos de temperatura:
Tenga en cuenta que para T C = 0 la eficiencia es del 100 % y que la eficiencia llega a ser mayor que el 100 % para T C < 0 , lo cual no es realista. Restando 1 del lado derecho de la ecuación (4) y la porción media se obtiene y por lo tanto [46] [44]
La generalización de esta ecuación es el teorema de Clausius , que propone la existencia de una función de estado (es decir, una función que depende sólo del estado del sistema, no de cómo alcanzó ese estado) definida (hasta una constante aditiva) por
donde el subíndice rev indica transferencia de calor en un proceso reversible. La función es la entropía del sistema, mencionada anteriormente, y el cambio alrededor de cualquier ciclo es cero (como es necesario para cualquier función de estado). La Ecuación 5 se puede reorganizar para obtener una definición alternativa de temperatura en términos de entropía y calor (para evitar un bucle lógico, primero debemos definir la entropía mediante mecánica estadística):
Para un sistema de volumen constante (por lo tanto, sin trabajo mecánico ) en el que la entropía es función de su energía interna y , por lo tanto , la temperatura termodinámica está dada por

1702-1703: Guillaume Amontons (1663-1705) publicó dos artículos que pueden usarse para acreditarlo como el primer investigador en deducir la existencia de una escala de temperatura fundamental (termodinámica) con un cero absoluto. Hizo el descubrimiento mientras se esforzaba por mejorar los termómetros de aire que se utilizaban en ese momento. Sus termómetros de tubo en J comprendían una columna de mercurio sostenida por una masa fija de aire atrapada dentro de la parte sensora del termómetro. En términos termodinámicos, sus termómetros se basaban en la relación volumen/temperatura del gas bajo presión constante. Sus mediciones del punto de ebullición del agua y el punto de fusión del hielo mostraron que, independientemente de la masa de aire atrapada dentro de sus termómetros o del peso de mercurio que soportaba el aire, la reducción del volumen de aire en el punto del hielo era siempre la misma proporción. . Esta observación lo llevó a postular que una reducción suficiente de la temperatura reduciría el volumen de aire a cero. De hecho, sus cálculos proyectaron que el cero absoluto equivalía a -240 °C, sólo 33,15 grados menos que el valor real de -273,15 °C. El descubrimiento de Amonton de una relación uno a uno entre la temperatura absoluta y la presión absoluta fue redescubierto un siglo después y popularizado dentro de la comunidad científica por Joseph Louis Gay-Lussac . Hoy en día, este principio de la termodinámica se conoce comúnmente como ley de Gay-Lussac pero también se conoce como ley de Amonton .

1742: Anders Celsius (1701-1744) creó una versión "al revés" de la escala de temperatura Celsius moderna. En la escala Celsius original, cero representaba el punto de ebullición del agua y 100 representaba el punto de fusión del hielo. En su artículo Observaciones de dos grados persistentes en un termómetro , relató sus experimentos que mostraban que el punto de fusión del hielo no se veía afectado por la presión. También determinó con notable precisión cómo variaba el punto de ebullición del agua en función de la presión atmosférica. Propuso que el cero en su escala de temperatura (el punto de ebullición del agua) se calibraría a la presión barométrica media al nivel medio del mar.

1744: Coincidiendo con la muerte de Anders Celsius, el famoso botánico Carl Linnaeus (1707-1778) invirtió efectivamente [47] la escala Celsius al recibir su primer termómetro con una escala en la que cero representaba el punto de fusión del hielo y 100 representaba el punto de ebullición del agua. . El termómetro de Linneo , hecho a medida para su uso en sus invernaderos, fue fabricado por Daniel Ekström, el principal fabricante sueco de instrumentos científicos en aquel momento. Durante los siguientes 204 años, las comunidades científica y termométrica de todo el mundo se refirieron a esta escala como escala centígrada . Las temperaturas en la escala centígrada a menudo se informaban simplemente como grados o, cuando se deseaba una mayor especificidad, en grados centígrados . El símbolo para los valores de temperatura en esta escala era °C (en varios formatos a lo largo de los años). Debido a que el término centígrado era también el nombre en francés para una unidad de medida angular (una centésima parte de un ángulo recto) y tenía una connotación similar en otros idiomas, el término " grado centesimal " se usaba cuando se hablaba de un lenguaje muy preciso e inequívoco. requerido por organismos de normalización internacionales como la Oficina Internacional de Pesas y Medidas ( Bureau international des poids et mesures ) (BIPM). La 9ª CGPM ( Conferencia General de Pesas y Medidas ( Conférence générale des poids et mesures ) y el CIPM ( Comité Internacional de Pesas y Medidas ( Comité international des poids et mesures ) adoptaron formalmente [48] grados Celsius (símbolo: °C) en 1948.

1777: En su libro Pyrometrie (Berlín: Haude & Spener, 1779), completado cuatro meses antes de su muerte, Johann Heinrich Lambert (1728-1777), a veces denominado incorrectamente Joseph Lambert, propuso una escala de temperatura absoluta basada en la presión/temperatura. relación de un volumen fijo de gas. Esto es distinto de la relación volumen/temperatura del gas bajo presión constante que Guillaume Amontons descubrió 75 años antes. Lambert afirmó que el cero absoluto era el punto en el que una simple extrapolación en línea recta alcanzaba la presión del gas cero y era igual a -270 °C.

Alrededor de 1787: a pesar del trabajo de Guillaume Amontons 85 años antes, a Jacques Alexandre César Charles (1746-1823) a menudo se le atribuye el descubrimiento, aunque no lo publicó, de que el volumen de un gas bajo presión constante es proporcional a su temperatura absoluta. La fórmula que creó fue V 1 / T 1 = V 2 / T 2 .

1802: Joseph Louis Gay-Lussac (1778-1850) publica un trabajo (reconociendo las notas de laboratorio inéditas de Jacques Charles quince años antes) que describe cómo el volumen de gas bajo presión constante cambia linealmente con su temperatura absoluta (termodinámica). Este comportamiento se llama Ley de Charles y es una de las leyes de los gases . Las suyas son las primeras fórmulas conocidas que utilizan el número 273 para el coeficiente de expansión del gas en relación con el punto de fusión del hielo (lo que indica que el cero absoluto equivalía a -273 °C).

1848: William Thomson , (1824-1907), también conocido como Lord Kelvin, escribió en su artículo On an Absolute Thermometric Scale (En una escala termométrica absoluta ) , sobre la necesidad de una escala en la que el frío infinito (cero absoluto) fuera el punto cero de la escala, y que utilizara el grado Celsius para su incremento unitario.
Al igual que Gay-Lussac, Thomson calculó que el cero absoluto equivalía a -273 °C en los termómetros de aire de la época. Esta escala absoluta se conoce hoy como escala de temperatura termodinámica Kelvin. Es digno de mención que el valor de Thomson de −273 en realidad se derivó de 0,00366, que era el coeficiente de expansión aceptado del gas por grado Celsius en relación con el punto de hielo. El inverso de −0,00366 expresado con cinco dígitos significativos es −273,22 °C, que está notablemente cerca del valor real de −273,15 °C.
En el artículo propuso definir la temperatura utilizando motores térmicos idealizados. En detalle, propuso que, dados tres depósitos de calor a temperaturas , si dos máquinas térmicas reversibles ( máquina de Carnot ), una trabajando entre , y otra entre , pueden producir la misma cantidad de trabajo mecánico al dejar pasar la misma cantidad de calor, entonces definir .
Tenga en cuenta que, al igual que Carnot, Kelvin trabajó bajo el supuesto de que el calor se conserva ("la conversión de calor (o calórico) en efecto mecánico es probablemente imposible"), y si el calor entra en el motor térmico, entonces debe salir calor. [49]
1851: William Thomson, al darse cuenta después de los experimentos de Joule de que el calor no es una cantidad conservada, sino que es convertible con trabajo mecánico, modificó su escala en An Account of Carnot's Theory of the Motive Power of Heat . En este trabajo, definió lo siguiente: [50]
Dados dos depósitos de calor y un motor térmico reversible trabajando entre ellos, de modo que si durante un ciclo del motor, el calor ingresa al motor y el calor sale del motor, entonces .
La definición anterior fija las proporciones entre temperaturas absolutas, pero no fija una escala para la temperatura absoluta. Para la escala, Thomson propuso utilizar el grado Celsius, es decir, el intervalo entre el punto de congelación y el de ebullición del agua.

1859: Macquorn Rankine (1820-1872) propuso una escala de temperatura termodinámica similar a la de William Thomson pero que utilizaba el grado Fahrenheit para su incremento unitario, es decir, el intervalo entre el punto de congelación y el de ebullición del agua. Esta escala absoluta se conoce hoy como escala de temperatura termodinámica de Rankine .

1877–1884: Ludwig Boltzmann (1844–1906) hizo importantes contribuciones a la termodinámica al comprender el papel que desempeñaban la cinética de partículas y la radiación del cuerpo negro. Su nombre ahora se adjunta a varias de las fórmulas utilizadas hoy en termodinámica.
Alrededor de la década de 1930: experimentos de termometría de gases cuidadosamente calibrados según el punto de fusión del hielo y el punto de ebullición del agua mostraron que el cero absoluto equivalía a -273,15 °C.
1948: La Resolución 3 de la 9ª CGPM (Conférence Générale des Poids et Mesures, también conocida como Conferencia General de Pesos y Medidas ) fijó el punto triple del agua exactamente en 0,01 °C. En ese momento, el punto triple aún no tenía una definición formal de su valor kelvin equivalente, que según la resolución "se fijará en una fecha posterior". La implicación es que si el valor del cero absoluto medido en la década de 1930 fue realmente −273,15 °C, entonces el punto triple del agua (0,01 °C) equivalía a 273,16 K. Además, tanto el CIPM (Comité internacional de poids et medidas , también conocido como Comité Internacional de Pesas y Medidas) y la CGPM adoptaron formalmente el nombre Celsius para el grado Celsius y la escala de temperatura Celsius . [51]
1954: La Resolución 3 de la 10ª CGPM dio a la escala kelvin su definición moderna eligiendo el punto triple del agua como su punto definitorio superior (sin cambio al cero absoluto siendo el punto nulo) y asignándole una temperatura de precisamente 273,16 kelvin (lo que en realidad estaba escrito 273,16 grados Kelvin en ese momento). Esto, en combinación con la Resolución 3 de la 9ª CGPM, tuvo el efecto de definir el cero absoluto como exactamente cero kelvin y −273,15 °C.
1967/1968: La Resolución 3 de la 13.ª CGPM renombra la unidad de incremento de temperatura termodinámica kelvin , símbolo K, reemplazando el grado absoluto , símbolo °K. Además, al considerar útil definir más explícitamente la magnitud del incremento unitario, la 13ª CGPM también decidió en la Resolución 4 que "El kelvin, unidad de temperatura termodinámica, es la fracción 1/273,16 de la temperatura termodinámica del punto triple del agua". ".
2005: El CIPM (Comité International des Poids et Mesures, también conocido como Comité Internacional de Pesas y Medidas ) afirmó que a los efectos de delimitar la temperatura del punto triple del agua, la definición de la escala de temperatura termodinámica kelvin se referiría a agua que tiene una composición isotópica definida como exactamente igual a la especificación nominal del agua de océano media estándar de Viena .
2019: En noviembre de 2018, la 26ª Conferencia General de Pesos y Medidas (CGPM) cambió la definición de Kelvin fijando la constante de Boltzmann en1,380 649 × 10 −23 cuando se expresa en la unidad J/K. Este cambio (y otros cambios en la definición de unidades SI) entró en vigor en el 144.º aniversario de la Convención del Metro, el 20 de mayo de 2019.

Aunque el cero absoluto ( T = 0 ) no es un estado de movimiento molecular cero, es el punto de temperatura cero y, de acuerdo con la constante de Boltzmann, también es el punto de energía cinética de partícula cero y velocidad cinética cero.Para entender cómo los átomos pueden tener velocidad cinética cero y simultáneamente estar vibrando debido a ZPE, considere el siguiente experimento mental: dos átomos de helio T = 0 en gravedad cero se colocan cuidadosamente y se observa que tienen una separación promedio de 620 pm entre ellos (un espacio de diez diámetros atómicos). Es una separación "media" porque la ZPE les hace empujarse en sus posiciones fijas. Entonces un átomo recibe un impulso cinético de exactamente 83 yoctokelvins (1 yK =1 × 10 −24 K ). Esto se hace de manera que dirija el vector de velocidad de este átomo hacia el otro átomo. Con 83 yK de energía cinética entre ellos, la brecha de 620 pm a través de su baricentro común se cerraría a una velocidad de 719 pm/s y colisionarían después de 0,862 segundos. Esta es la misma velocidad que se muestra en la animación de la Fig. 1 anterior. Antes de recibir el impulso cinético, ambos átomos T = 0 tenían energía cinética y velocidad cinética cero porque podían persistir indefinidamente en ese estado y orientación relativa incluso aunque ambos estuvieran siendo empujados por ZPE. En T = 0 , no hay energía cinética disponible para transferir a otros sistemas.
Tenga en cuenta también que el cero absoluto sirve como base sobre la cual se fundamentan la termodinámica y sus ecuaciones porque tratan del intercambio de energía térmica entre " sistemas " (una pluralidad de partículas y campos modelados como un promedio). En consecuencia, se puede examinar el movimiento de partículas inducido por ZPE dentro de un sistema que está en cero absoluto, pero nunca puede haber una salida neta de energía térmica de dicho sistema. Además, la longitud de onda de emisión máxima de la radiación del cuerpo negro se desplaza hacia el infinito en el cero absoluto; de hecho, ya no existe un pico y los fotones del cuerpo negro ya no pueden escapar. Sin embargo, debido a ZPE, los fotones virtuales todavía se emiten en T = 0 . Estos fotones se denominan "virtuales" porque no pueden ser interceptados ni observados. Además, esta radiación de punto cero tiene un espectro de punto cero único . Sin embargo, aunque un sistema T = 0 emite radiación de punto cero, no puede ocurrir ningún flujo de calor neto Q fuera de dicho sistema porque si el ambiente circundante está a una temperatura mayor que T = 0 , el calor fluirá hacia adentro, y si el Si el entorno circundante está en ' T = 0 , habrá un flujo igual de radiación ZP tanto hacia el interior como hacia el exterior. Existe un equilibrio Q similar en T = 0 con la emisión espontánea de fotones inducida por ZPE (que en este contexto se denomina más propiamente emisión estimulada ). El gráfico de la parte superior derecha ilustra la relación entre el cero absoluto y la energía del punto cero. El gráfico también ayuda a comprender cómo la energía del punto cero obtuvo su nombre: es la energía vibratoria que la materia retiene en el punto kelvin cero . Derivación del espectro de radiación electromagnética clásica de punto cero mediante una operación termodinámica clásica que involucra fuerzas de van der Waals, Daniel C. Cole, Physical Review A, 42 (1990) 1847.
ecuaciones
(39), (40) y (65).
ecuación (64).
{{cite book}}: CS1 maint: location missing publisher (link){{cite book}}: CS1 maint: location missing publisher (link)