


Un carbocatión es un ion con un átomo de carbono cargado positivamente . Entre los ejemplos más simples se encuentran el metenio CH. +
3, metanio CH+
5y vinilo C
2h+
3cationes. Ocasionalmente, también se encuentran carbocationes que llevan más de un átomo de carbono cargado positivamente (p. ej., etilendicatión C
2h2+
4). [1]
Hasta principios de la década de 1970, todos los carbocationes se denominaban iones carbonio . [2] En la definición actual dada por la IUPAC, un carbocatión es cualquier catión de electrones pares con una carga positiva parcial significativa en un átomo de carbono. Además, se clasifican en dos categorías principales según el número de coordinación del carbono cargado: tres en los iones carbenio y cinco en los iones carbonio . Esta nomenclatura fue propuesta por GA Olah . [3] Los iones de carbonio, tal como los definió originalmente Olah, se caracterizan por un esquema de enlace deslocalizado de tres centros y dos electrones y son esencialmente sinónimos de los llamados " carbocationes no clásicos ", que son carbocationes que contienen puentes C-C o Enlaces C – H σ. Sin embargo, otros han definido de manera más estricta el término "ion carbonio" como alcanos formalmente protonados o alquilados ( CR+
5, donde R es H o alquilo), con exclusión de carbocationes no clásicos como el catión 2-norbornilo . [4]
Según la IUPAC , un carbocatión es cualquier catión que contiene un número par de electrones en el que una parte importante de la carga positiva reside en un átomo de carbono. [5] Antes de la observación de carbocationes de cinco coordenadas por Olah y sus compañeros de trabajo, el carbocatión y el ion carbonio se usaban indistintamente. Olah propuso una redefinición del ion carbonio como un carbocatión que presenta cualquier tipo de enlace de dos electrones de tres centros, mientras que un ion carbenio fue acuñado recientemente para referirse a un carbocatión que contiene solo enlaces de dos electrones de dos centros con un carbono positivo de tres coordenadas. . Posteriormente, otros han utilizado el término ion carbonio de forma más estricta para referirse a especies que se derivan (al menos formalmente) del ataque electrofílico de H + o R + sobre un alcano, en analogía con otras especies del grupo principal onio , mientras que un carbocatión que contiene cualquier tipo de enlace de tres centros se denomina carbocatión no clásico . En este uso, el catión 2-norbornilo no es un ion carbonio, porque formalmente se deriva de la protonación de un alqueno (norborneno) en lugar de un alcano, aunque es un carbocatión no clásico debido a su estructura de puente. La IUPAC reconoce las tres definiciones divergentes de ion carbonio e insta a tener cuidado en el uso de este término. Durante el resto de este artículo, el término ion carbonio se utilizará en este último sentido restringido, mientras que el carbocatión no clásico se utilizará para referirse a cualquier carbocatión con enlaces σ C – C y/o C – H deslocalizados mediante puentes.
Desde finales de la década de 1990, la mayoría de los libros de texto han dejado de utilizar el término ion carbonio para el carbocatión clásico de tres coordenadas. Sin embargo, algunos libros de texto de nivel universitario continúan usando el término carbocatión como si fuera sinónimo de ion carbenio, [6] [7] o discuten carbocationes con solo una referencia fugaz a la terminología más antigua de iones carbonio [8] o carbenio y carbonio. iones. [9] Un libro de texto conserva el nombre antiguo de ion carbonio para ion carbenio hasta el día de hoy, y usa la frase ion carbonio hipervalente para CH+
5. [10]
Un carbocatión con un carbono positivo de dos coordenadas derivado de la eliminación formal de un ion hidruro (H − ) de un alqueno se conoce como catión vinilo . En ausencia de restricciones geométricas, la mayoría de los cationes vinílicos sustituidos llevan la carga formal positiva en un átomo de carbono sp-hidridado de geometría lineal. Un catión con hibridación aproximadamente sp 2 de dos coordenadas resultante de la eliminación formal de un ion hidruro de un areno se denomina catión arilo . Estos carbocationes son relativamente inestables (especialmente los cationes arilo) y se encuentran con poca frecuencia. Por lo tanto, con frecuencia se omiten en los libros de texto de nivel introductorio e intermedio. La definición de la IUPAC estipula que los carbocationes son especies de electrones pares; por lo tanto, cationes radicales como CH•+
4que se encuentran frecuentemente en espectrometría de masas no se consideran carbocationes.
La historia de los carbocationes se remonta a 1891, cuando G. Merling [11] informó que añadió bromo al tropilideno ( cicloheptatrieno ) y luego calentó el producto para obtener un material cristalino soluble en agua, C.
7h
7Hno . No sugirió una estructura para ello; sin embargo, Doering y Knox [12] demostraron de manera convincente que se trataba de bromuro de tropilio (cicloheptatrienilio). Se predice que este ion será aromático según la regla de Hückel .
En 1902, Norris y Kehrman descubrieron de forma independiente que el trifenilmetanol incoloro produce soluciones de color amarillo intenso en ácido sulfúrico concentrado . El cloruro de trifenilmetilo formó de manera similar complejos anaranjados con cloruros de aluminio y estaño. En 1902, Adolf von Baeyer reconoció el carácter salino de los compuestos formados. El carbocatión de tritilo (que se muestra a continuación) es un sistema carbocatiónico estable que se ha utilizado como organocatalizador homogéneo en síntesis orgánica, [13] por ejemplo en forma de hexafluorofosfato de tritilo . [14]

Denominó halocromía a la relación entre el color y la formación de sales , de la cual el verde malaquita es un excelente ejemplo.
Los carbocationes son intermediarios reactivos en muchas reacciones orgánicas. Esta idea, propuesta por primera vez por Julius Stieglitz en 1899, [15] fue desarrollada aún más por Hans Meerwein en su estudio de 1922 [16] [17] sobre la reordenación de Wagner-Meerwein . También se encontró que los carbocationes estaban involucrados en la reacción S N 1 , la reacción E1 y en reacciones de reordenamiento como el desplazamiento Whitmore 1,2 . El establishment químico se mostró reacio a aceptar la noción de carbocatión y durante mucho tiempo el Journal of the American Chemical Society rechazó los artículos que los mencionaran.
El primer espectro de RMN de un carbocatión estable en solución fue publicado por Doering et al. [18] en 1958. Era el ion heptametil bencenio , obtenido tratando hexametilbenceno con cloruro de metilo y cloruro de aluminio . El catión estable 7-norbornadienilo fue preparado por Story et al. en 1960 [19] haciendo reaccionar cloruro de norbornadienilo con tetrafluoroborato de plata en dióxido de azufre a -80 °C. El espectro de RMN estableció que tenía un puente no clásico (el primer ion no clásico estable observado).
En 1962, Olah observó directamente el carbocatión de terc -butilo mediante resonancia magnética nuclear como una especie estable al disolver fluoruro de terc -butilo en ácido mágico . La RMN del catión norbornilo fue reportada por primera vez por Schleyer et al. [20] y Saunders et al. demostraron que sufre una codificación de protones sobre una barrera. [21]
Los iones de carbonio pueden considerarse como alcanos protonados. Aunque los alcanos generalmente se consideran inertes, en condiciones superácidas (p. ej., HF · SbF 5 ), el enlace sigma CH puede actuar como donante de H + . Esto da como resultado una especie que contiene un enlace 3c-2e entre un átomo de carbono y dos átomos de hidrógeno, un tipo de enlace común en la química del boro, aunque relativamente poco común para el carbono. Como punto de vista alternativo, el enlace 3c-2e de los iones carbonio podría considerarse como una molécula de H2 coordinada con un ion carbenio ( ver más abajo ). De hecho, los iones carbonio frecuentemente se descomponen por pérdida de hidrógeno molecular para formar el ion carbenio correspondiente. Estructuralmente, el ion metanio CH +5Se calcula que tiene una estructura de energía mínima de simetría C s . Sin embargo, las diversas estructuras posibles del ion tienen energías cercanas y están separadas por barreras poco profundas. De ahí que la estructura del ion se describa a menudo como fluxional . Aunque parece haber cinco enlaces con el carbono en los iones carbonio, no son hipervalentes , ya que el número de electrones alrededor del carbono central es sólo ocho, debido al enlace 3c-2e.
Por el contrario, al menos en un sentido formal, los iones carbenio se derivan de la protonación (adición de H + ) o alquilación (adición de R + ) de un carbeno o alqueno . Así, en al menos una de sus representaciones de resonancia , poseen un átomo de carbono con una carga positiva formal que está rodeado por un sexteto de electrones (seis electrones de valencia ) en lugar del octeto habitual necesario para llenar la capa de valencia del carbono ( regla del octeto). ). Por lo tanto, los iones carbenio (y los carbocationes en general) suelen ser reactivos, buscando llenar el octeto de electrones de valencia así como recuperar una carga neutra . De acuerdo con VSEPR y la regla de Bent , a menos que estén geométricamente restringidos a ser piramidales (p. ej., catión 1-adamantilo), los iones carbenio de 3 coordenadas suelen ser planos trigonales, con un orbital vacío de carácter p puro como su orbital molecular desocupado más bajo (LUMO) y Enlaces CH/CC formados a partir de orbitales C(sp 2 ). Un ejemplo prototípico es el catión metilo, CH+3. Por las mismas razones, los carbocationes que tienen 2 coordenadas (cationes vinilo) generalmente tienen una geometría lineal, con enlaces CH/CC formados a partir de orbitales C(sp).

Los carbocationes sustituidos con alquilo siguen el orden 3° > 2° > 1° > metilo en estabilidad, como se puede inferir de los valores de afinidad del ion hidruro (231, 246, 273 y 312 kcal/mol para (CH 3 ) 3 C + , (CH 3 ) 2 CH + , CH 3 CH+2y CH+3). [22] El efecto de la sustitución de alquilo es fuerte: los cationes terciarios son estables y muchos son directamente observables en medios superácidos, pero los cationes secundarios suelen ser transitorios y sólo se han observado en solución los cationes isopropilo, s -butilo y ciclopentilo. [23] Rara vez hay apoyo experimental para los carbocationes primarios en la fase de solución, incluso como intermedios transitorios (el catión etilo se ha propuesto para reacciones en ácido sulfúrico al 99,9% y en FSO 2 OH · SbF 5 ), [24] y metilo. El catión sólo se ha identificado de forma inequívoca en la fase gaseosa. En la mayoría de los casos, si no en todos, el estado fundamental de los supuestos carbocationes primarios consiste en estructuras puenteadas en las que dos o más átomos de carbono comparten la carga positiva y se describen mejor como alquenos con protonaciones laterales, ciclopropanos con protonaciones en los bordes o protonados en las esquinas. ciclopropanos en lugar de verdaderos cationes primarios. [25] [26] Incluso el catión etilo simple, C 2 H+5, se ha demostrado experimental y computacionalmente que tiene un puente [27] y puede considerarse como una molécula de etileno protonada simétricamente. Lo mismo ocurre con los homólogos superiores como los cationes 1-propilo y 1-butilo. [28] Se cree que los derivados de neopentilo se ionizan con la migración concomitante de un grupo metilo ( asistencia anquimérica ); por lo tanto, en la mayoría de los casos, si no en todos, no se cree que esté involucrado un catión neopentilo discreto. [29]
La estabilización por grupos alquilo se explica por hiperconjugación . [30] La donación de densidad electrónica de un enlace β CH o CC al orbital p desocupado del carbocatión (una interacción σ CH/CC → p) permite que la carga positiva se deslocalice.
Según la afinidad del ion hidruro, el catión vinilo original es menos estable que incluso un carbocatión primario con hibridación sp 2 , mientras que un catión vinílico sustituido con alquilo α tiene una estabilidad comparable a la de este último. Por tanto, los cationes vinílicos son intermediarios relativamente poco comunes. Pueden generarse mediante la ionización de un electrófilo vinílico, siempre que el grupo saliente sea suficientemente bueno (p. ej., TfO − , IPh o N 2 ). Se les ha implicado como intermediarios en algunas reacciones de sustitución de vinilo (designadas como S N 1 (vinilo)) y como intermediarios en las reacciones de adición electrofílica de arilalquinos. Con la excepción del catión vinílico original, que se cree que es una especie puenteada, y los cationes vinílicos cíclicos geométricamente restringidos, la mayoría de los cationes vinílicos adoptan una hibridación sp y son lineales.
Los cationes arilo son más inestables que los cationes vinilo, debido a la distorsión impuesta por el anillo a una geometría no lineal y aproximadamente al carácter sp 2 del orbital desocupado. Sólo el N 2 en las sales de arildiazonio es un grupo saliente suficientemente bueno para la generación química de cationes arilo. [31]
Los cationes alquinilo son extremadamente inestables, mucho menos estables que incluso el CH+
3(afinidad del ion hidruro 386 kcal/mol versus 312 kcal/mol para CH+
3) y no puede generarse por medios puramente químicos. Sin embargo, pueden generarse radioquímicamente mediante la desintegración beta del tritio : [32]

En términos de reactividad, los carbocationes son susceptibles al ataque de nucleófilos , como agua, alcoholes, carboxilatos, azidas y iones haluro, para formar el producto de adición. Los nucleófilos fuertemente básicos, especialmente los impedidos, favorecen la eliminación sobre la adición. Debido a que incluso los nucleófilos débiles reaccionarán con los carbocationes, la mayoría solo pueden observarse o aislarse directamente en medios no nucleofílicos como los superácidos . [33]

Los carbocationes suelen sufrir reacciones de reordenamiento desde estructuras menos estables a otras igualmente estables o más estables mediante la migración de un grupo alquilo o hidrógeno al centro catiónico para formar un nuevo centro carbocatiónico. [34] Esto ocurre a menudo con constantes de velocidad superiores a 10 10 s −1 a temperatura ambiente y todavía ocurre rápidamente (en comparación con la escala de tiempo de RMN) a temperaturas tan bajas como −120 °C ( ver desplazamiento de Wagner-Meerwein ). En casos especialmente favorables, como el catión 2-norbornilo, los cambios de hidrógeno aún pueden tener lugar a velocidades lo suficientemente rápidas como para interferir con la cristalografía de rayos X a 86 K (-187 °C). [35] Normalmente, los carbocationes se reorganizarán para dar un isómero terciario. Por ejemplo, todos los isómeros de C 6 H+11se reorganizan rápidamente para dar el catión 1-metil-1-ciclopentilo. Este hecho complica a menudo las vías sintéticas. Por ejemplo, cuando se calienta 3-pentanol con HCl acuoso, el carbocatión de 3-pentilo formado inicialmente se reorganiza en una mezcla estadística de 3-pentilo y 2-pentilo. Estos cationes reaccionan con el ion cloruro para producir aproximadamente un tercio de 3-cloropentano y dos tercios de 2-cloropentano. La alquilación de Friedel-Crafts adolece de esta limitación; por esta razón, la acilación (seguida de la reducción de Wolff-Kishner o Clemmensen para dar el producto alquilado) se aplica con mayor frecuencia.

Un carbocatión puede estabilizarse mediante resonancia mediante un doble enlace carbono-carbono o mediante el par solitario de un heteroátomo adyacente al carbono ionizado. Para que un carbocatión esté estabilizado por resonancia, el orbital molecular del grupo donante debe tener la simetría, orientación y nivel de energía adecuados para interactuar con el orbital 2p vacío del carbocatión. Cationes como el catión alilo CH 2 =CH−CH+2y catión bencilo C 6 H 5 −CH+2son más estables que la mayoría de los otros carbocationes debido a la donación de densidad electrónica de los sistemas π al centro catiónico. [36] Además, los carbocationes presentes en las moléculas aromáticas están especialmente estabilizados, en gran parte debido a los electrones π deslocalizados característicos de los anillos aromáticos. [37] Las moléculas que pueden formar carbocationes alilo o bencilo son especialmente reactivas. Estos carbocationes donde el C + es adyacente a otro átomo de carbono que tiene un enlace doble o triple tienen estabilidad extra debido al solapamiento del orbital p vacío del carbocatión con los orbitales p del enlace π. Esta superposición de los orbitales permite que la carga positiva se disperse y la densidad de electrones del sistema π se comparta con el centro deficiente en electrones, lo que resulta en una estabilización. Los carbocationes doble y triplemente bencílicos, catión difenilcarbenio y trifenilcarbenio (tritilo), son particularmente estables. Por las mismas razones, el carácter p parcial de los enlaces C-C tensos en los grupos ciclopropilo también permite la donación de densidad electrónica [38] y estabiliza el catión ciclopropilmetilo (ciclopropilcarbinilo).
El orden de estabilidad de los carbocationes, del más estable al menos estable según lo reflejan los valores de afinidad del ion hidruro (HIA), es el siguiente (valores HIA en kcal/mol entre paréntesis):
Como se señaló en la sección de historia, el catión tropilio ( C 7 H+7) fue uno de los primeros carbocationes descubiertos, debido a su estabilidad aromática . Este carbocatión está tan estabilizado que la molécula puede aislarse y venderse como sal. Por otro lado, el catión ciclopentadienilo antiaromático ( C 5 H+5) se desestabiliza en unas 40 kcal/mol. El catión ciclopropenio ( C 3 H+3), aunque algo desestabilizado por la tensión angular, todavía está claramente estabilizado por la aromaticidad en comparación con su análogo de cadena abierta, el catión alilo. Estas diferentes estabilidades de los cationes, dependiendo del número de electrones π en el sistema de anillos, pueden además ser factores cruciales en la cinética de reacción. La formación de un carbocatión aromático es mucho más rápida que la formación de un carbocatión antiaromático o de cadena abierta. Dado el papel de los carbocationes en muchos esquemas de reacción, como S N 1 por ejemplo, elegir la conjugación de los materiales de partida puede ser un método poderoso para conferir favorabilidad o desfavorabilidad cinética , ya que la constante de velocidad para cualquier paso determinado depende de la activación del paso. energía según la ecuación de Arrhenius .

El efecto de la hiperconjugación es fuertemente estabilizador para los carbocationes: la hiperconjugación con sustituyentes alquilo es a menudo tan estabilizadora o incluso más que la conjugación con un sistema π. Aunque la conjugación con grupos insaturados produce una estabilización significativa por el efecto mesomérico (resonancia), el beneficio se ve parcialmente compensado por la presencia de un carbono sp 2 o sp más electronegativo junto al centro carbocatiónico. Por lo tanto, como lo reflejan las afinidades del ion hidruro, un carbocatión secundario está más estabilizado que el catión alilo, mientras que un carbocatión terciario está más estabilizado que el catión bencilo, resultados que pueden parecer contradictorios a primera vista.
Los iones oxocarbenio e iminio tienen importantes formas canónicas secundarias (estructuras de resonancia) en las que el carbono tiene una carga positiva. Como tales, son carbocationes según la definición de la IUPAC, aunque algunos químicos no los consideran carbocationes "verdaderos", ya que sus contribuyentes de resonancia más importantes llevan la carga positiva formal en un átomo de oxígeno o nitrógeno, respectivamente.
Algunos carbocationes, como el catión 2-norbornilo, exhiben enlaces de dos electrones de tres centros más o menos simétricos. Tales estructuras, denominadas carbocationes no clásicos , implican la deslocalización de los enlaces involucrados en la estructura σ de la molécula, lo que da como resultado enlaces C – C y C – H de orden de enlace fraccionario. [39] [40] Esta deslocalización da como resultado una estabilización adicional del catión. Por ejemplo, representado como un ion carbenio clásico, el catión 2-norbornilo parece ser un carbocatión secundario. Sin embargo, es más estable que un carbocatión "secundario" típico, siendo aproximadamente tan estable como un carbocatión terciario como el catión t -butilo, según la afinidad del ion hidruro.
La existencia de carbocationes no clásicos alguna vez fue objeto de gran controversia. En lados opuestos estaba Herbert C. Brown , quien creía que lo que parecía ser un carbocatión no clásico representa el promedio de dos especies clásicas que se equilibran rápidamente (o posiblemente dos estructuras que exhiben algún grado de puenteo o inclinación pero que, sin embargo, no son simétricas) y que la verdadera estructura no clásica es un estado de transición entre los dos mínimos de energía potencial, y Saul Winstein , quien creía que una estructura no clásica que poseía un plano de simetría era el único mínimo de energía potencial y que las estructuras clásicas eran simplemente dos que contribuyen a la resonancia. formas de esta especie no clásica. El descubrimiento de George Olah de medios superácidos que permiten observar directamente los carbocationes, junto con una técnica de RMN muy sensible desarrollada por Martin Saunders para distinguir entre los dos escenarios, desempeñaron un papel importante en la resolución de esta controversia. [41] [42] Al menos para el catión 2-norbornilo en sí, la controversia se ha resuelto abrumadoramente a favor de Winstein, sin signos de la supuesta especie clásica interconvertida, incluso a temperaturas tan bajas como 6 K, y una estructura cristalina de 2013. mostrando una estructura claramente no clásica. [43] [35] Actualmente se cree que una variedad de carbocationes (p. ej., catión etilo, ver arriba ) adoptan estructuras no clásicas. Sin embargo, en muchos casos, la diferencia de energía entre las dos posibles estructuras "clásicas" y la "no clásica" es muy pequeña, y puede resultar difícil distinguir entre las dos posibilidades experimentalmente.
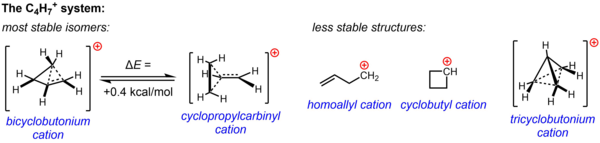
Una estructura no clásica para C
4h+
7está respaldado por evidencia experimental sustancial de experimentos de solvólisis y estudios de RMN realizados en medios no nucleofílicos. Se invocó una o ambas estructuras, el catión ciclopropilcarbinilo y el catión biciclobutonio, para explicar la reactividad observada en varios experimentos, mientras que los datos de RMN apuntan a un sistema altamente fluxional que sufre una rápida reordenación para dar un espectro promedio que consta de sólo dos Señales de RMN de 13 C, incluso a temperaturas tan bajas como -132 °C. Computacionalmente, se confirmó que el paisaje energético del C
4h+
7El sistema es muy plano, y que los dos isómeros postulados basándose en datos experimentales tienen energías muy parecidas, calculándose que la estructura del biciclobutonio es sólo 0,4 kcal/mol más estable que la estructura del ciclopropilcarbinilo. En la fase de solución (SbF 5 ·SO 2 ClF·SO 2 F 2 , con SbF–
6como contraión), la estructura de biciclobutonio predomina sobre la estructura de ciclopropilcarbinilo en una proporción de 84:16 a -61 °C.
Ahora se sabe que otras tres estructuras posibles, dos estructuras clásicas (el catión homoalilo y el catión ciclobutilo) y una estructura no clásica más deslocalizada (el ion triciclobutonio), son isómeros menos estables (o simplemente un estado de transición en lugar de un mínimo de energía). en el caso del catión ciclobutilo). [44]
Los cationes ciclopropilcarbinilo sustituidos también se han estudiado mediante RMN: [45] [46]
En el espectro de RMN de un derivado dimetilo, se encuentran dos señales no equivalentes para los dos grupos metilo, lo que indica que la conformación molecular de este catión no es perpendicular (como en A), que posee un plano especular, sino que está bisecado (como en B ) con el orbital p vacío paralelo al sistema de anillos de ciclopropilo:
En términos de la teoría del enlace doblado , esta preferencia se explica asumiendo una superposición orbital favorable entre los enlaces doblados de ciclopropano llenos y el orbital p vacío. [47]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )