La transposición del vinilciclopropano o transposición del vinilciclopropano-ciclopenteno es una reacción de expansión de anillo que convierte un anillo de ciclopropano sustituido con vinilo en un anillo de ciclopenteno . [1] [2] [3]
Los grupos ciclopropilo adyacentes a los grupos vinilo pueden experimentar reacciones de expansión de anillo . Esta reactividad se puede aprovechar para generar compuestos cíclicos inusuales , como los ciclobutenos [4] o especies bicíclicas como el ciclohepteno que se muestra a continuación [5] .

Las investigaciones experimentales y computacionales muestran que, desde el punto de vista mecanístico, la transposición del vinilciclopropano puede considerarse un proceso pericíclico de dos pasos mediado por dirradical y/o controlado por simetría orbital. La medida en que cada uno de los dos mecanismos es operativo depende en gran medida del sustrato.
Debido a su capacidad para formar anillos de ciclopenteno, la transposición del vinilciclopropano ha servido varias veces como reacción clave en la síntesis de productos naturales complejos.
En 1959, un joven químico investigador de Humble Oil and Refining ( Esso , ahora Exxon ) llamado Norman P. Neureiter recibió instrucciones de encontrar nuevos usos para el exceso de butadieno producido en uno de los procesos de refinería. Las discusiones sobre la química del carbeno con uno de los consultores más respetables de la empresa en ese momento, William von Eggers Doering , entonces profesor en Yale , llevaron al joven graduado de doctorado de la Universidad Northwestern a seguir un procedimiento reciente que combinaba ambos, carbenos y butadieno. [6] En particular, el procedimiento describía la reacción del 1,3-butadieno con carbenos generados a partir de la acción de la base sobre cloroformo o bromoformo , que había sido estudiado previamente por Doering. [7] Luego, Neureiter tomó el 1,1-dicloro-2,2-dimetilciclopropano resultante y, en condiciones de pirólisis (por encima de 400 °C), descubrió un reordenamiento a 4,4-diclorociclopenteno que hoy se considera el primer reordenamiento térmico de vinilciclopropano-ciclopenteno de la historia. [8]

La versión correspondiente de la reacción completamente de carbono fue reportada independientemente por Emanuel Vogel [9] y Overberger & Borchert justo un año después de que apareciera la publicación de Neureiter. [10] [11] Doering, aunque interactuaba con Humble Oil and Refining -y por lo tanto también con Neureiter- como consultor, en una publicación de 1963 afirmó lo siguiente: "El crédito por el descubrimiento de que el vinilciclopropano se reordena a ciclopenteno se debe a Overberger y Borchert, y Vogel et al., quienes parecen haber desarrollado varios ejemplos del reordenamiento de forma independiente". [12] El desarrollo de más variantes de reordenamiento del vinilciclopropano no tomó mucho tiempo como lo demostraron Atkinson & Rees en 1967, [13] Lwowski en 1968. [14] y Paladini & Chuche en 1971. [15]
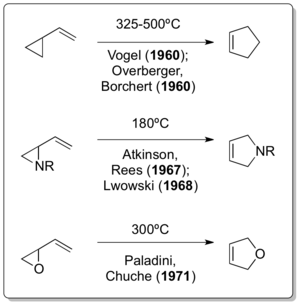
El reordenamiento clásico del vinilciclopropano se descubrió mucho después de que ya se hubieran descrito dos de sus variantes heteroatómicas. Aunque se cree que el reordenamiento del vinilciclopropano debe haber ocurrido durante la preparación del vinilciclopropano por eliminación de Hofmann a temperaturas elevadas por parte de Nikolay Demyanov en 1922, [16] el reordenamiento de ciclopropilimina-pirrolina por parte de Cloke en 1929 [17] y el reordenamiento de ciclopropilcarbaldehído-2,3-dihidrofurano por parte de Wilson en 1947 [18] son realmente los únicos ejemplos de reordenamientos similares al vinilciclopropano.
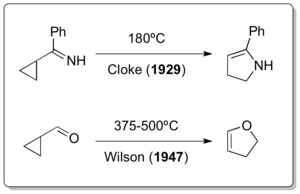
Este último tipo de reacción también se conoce como reordenamiento de Cloke-Wilson [19].
La discusión mecanicista sobre si el reordenamiento del vinilciclopropano se produce a través de un mecanismo de dos pasos mediado por dirradical o un mecanismo totalmente concertado controlado por simetría orbital ha estado en curso durante más de medio siglo. Los datos cinéticos junto con los efectos isotópicos cinéticos secundarios observados en el extremo vinílico del vinilciclopropano sugieren un mecanismo concertado, mientras que la distribución del producto indica un mecanismo dirradical escalonado. [20] En la década de 1960, poco después de que se descubriera el reordenamiento, se estableció que la energía de activación para el reordenamiento del vinilciclopropano es de alrededor de 50 kcal/mol. [21] Los datos cinéticos obtenidos para este reordenamiento fueron consistentes con un mecanismo concertado donde la escisión del enlace carbono-carbono del ciclopropilo era limitante de la velocidad. Aunque parecía probable un mecanismo concertado, pronto se reconoció que la energía de activación para romper el enlace carbono-carbono en el ciclopropano no sustituido era, con 63 kcal/mol [22], exactamente 13 kcal/mol más alta que la energía de activación original, una diferencia notablemente similar a la energía de resonancia del radical alilo. [23] Inmediatamente la gente comenzó a apreciar la posibilidad de que surgiera un intermediario dirradical de la escisión homolítica del enlace débil C1-C2-ciclopropano en condiciones térmicas.

La discusión sobre si el reordenamiento del vinilciclopropano se produce a través de un mecanismo totalmente concertado o de dos pasos, no concertado, recibió una consideración más cuidadosa cuando Woodward y Hoffmann utilizaron el reordenamiento del vinilciclopropano para ejemplificar los desplazamientos de alquilo concertados [1,3]-sigmatrópicos en 1969. [24] Plantearon la hipótesis de que si un mecanismo concertado fuera operativo, las consecuencias de los factores controlados por la simetría orbital solo permitirían la formación de ciertos productos. Según su análisis de un vinilciclopropano sustituido con tres grupos R, el desplazamiento antarafacial [1,3] del enlace 1,2 a C-5, con retención en C-2, que conduce al ciclopenteno ar , y el desplazamiento suprafacial [1,3] del enlace 1,2 a C-5, con inversión en C-2, que conduce al ciclopenteno si son simetría permitida, mientras que el desplazamiento suprafacial [1,3] del enlace 1,2 a C-5, con retención en C-2, que conduce al ciclopenteno sr , y el desplazamiento antarafacial [1,3] del enlace 1,2 a C-5, con inversión en C-2, que conduce al ciclopenteno ai están simetría prohibida.
Woodward y Hoffmann basaron su análisis únicamente en los principios de la teoría de conservación de la simetría orbital, sin hacer ninguna predicción mecanicista o estereoquímica.

La atención dirigida hacia el reordenamiento del vinilciclopropano por Woodward y Hoffmann como un ejemplo representativo de los desplazamientos del carbono [1,3] claramente aumentó el interés en esta reacción. Además, su análisis reveló experimentos potenciales que permitirían distinguir entre un mecanismo concertado o por pasos. Las consecuencias estereoquímicas de una vía de reacción concertada en el resultado de la reacción sugirieron un experimento en el que se correlacionaría la estereoquímica de la reacción obtenida con la estereoquímica de la reacción predicha para un sustrato modelo. Observar la formación de productos de ai - y sr -ciclopenteno apoyaría la noción de que un mecanismo por pasos, no concertado, está operativo, mientras que su ausencia apuntaría hacia un mecanismo completamente concertado. Resultó que encontrar un sustrato modelo sustituido apropiado para estudiar el resultado estereoquímico del reordenamiento del vinilciclopropano fue mucho más desafiante de lo que se pensó inicialmente, ya que las reacciones secundarias, como los desplazamientos del hidrógeno [1,5] en el homodienilo y, más aún, las estereomutaciones térmicas, tienden a alterar las distinciones estereoquímicas mucho más rápido de lo que los reordenamientos conducen a los productos de ciclopenteno.

Aunque la deconvolución de los escenarios cinéticos complejos subyacentes a estos reordenamientos fue difícil, se han informado varios estudios en los que fue posible realizar deconvoluciones exactas y explícitas de datos cinéticos y estereoquímicos brutos para tener en cuenta las contribuciones estereoquímicas que surgen de las estereomutaciones competitivas. [20] [25] [26] [27]
De este modo se pudieron determinar las constantes de velocidad para las cuatro vías estereoquímicamente distintas del reordenamiento del vinilciclopropano.

Los datos indicaron claramente que las preferencias mecanicistas de los reordenamientos dependen del sistema. Mientras que los trans -vinilciclopropanos tienden a formar más de los ar- y si -ciclopentenos con simetría permitida, lo que apoya un mecanismo concertado, los cis -vinilciclopropanos producen preferentemente los productos ai- y sr- con simetría prohibida, lo que sugiere un mecanismo dirradical más escalonado. La influencia de los efectos de los sustituyentes en la estereoquímica de la reacción también se hace evidente a partir de los datos. Los sustituyentes con mayor capacidad de estabilización de radicales no solo reducen la energía de activación de los reordenamientos, sino que también el recierre de las especies dirradicales formadas inicialmente se vuelve más lento en relación con la velocidad de formación del ciclopenteno, lo que resulta en un mecanismo general más concertado con menos estereomutación (por ejemplo, entradas 6 y 7). Sin embargo, en todos los casos se formaron los cuatro productos, lo que indica que tanto el pericíclico controlado por simetría orbital como los mecanismos de dos pasos mediados por dirradicales son operativos en ambos sentidos. Los datos son consistentes con la formación de especies birradicales en una superficie de energía potencial relativamente plana que permite una flexibilidad conformacional restringida antes de que se formen los productos. La cantidad de flexibilidad conformacional y, por lo tanto, la evolución conformacional accesible a las especies dirradical antes de formar el producto depende de la constitución de la superficie de energía potencial. Esta noción también está respaldada por trabajo computacional. [28] Se encontró un estado de transición con un alto carácter dirradicaloide. Siguiendo la superficie de energía potencial de la ruta de energía más baja de la reacción, se encontró que un régimen muy superficial permite que las especies dirradical experimenten cambios conformacionales y reacciones de estereoisomerización con consecuencias energéticas menores. Además, se demostró que los sustituyentes pueden favorecer las rutas estereoselectivas al desestabilizar las especies que permiten la mezcla estereoquímica.
Se podría decir que el mayor inconveniente de la transposición del vinilciclopropano como método sintético es su barrera de activación intrínsecamente alta, lo que da como resultado temperaturas de reacción muy altas (500-600 °C). Estas altas temperaturas no solo permiten que se produzcan reacciones secundarias con energías de activación similares, como desplazamientos de homodienil-[1,5]-hidrógeno, sino que también limitan significativamente los grupos funcionales tolerados en los sustratos. La comunidad química reconoció que para que esta reacción se convirtiera en un método sintético útil, con suerte aplicable en entornos de productos naturales complejos en algún momento, se debía realizar algún desarrollo de la reacción. Se descubrió que la temperatura de reacción se podía reducir drásticamente cuando el anillo de ciclopropano contenía un grupo ditiano . Aunque los sustratos de vinilciclopropano sustituidos con ditiano requerían dos pasos sintéticos a partir de los 1,3-dienos correspondientes, el método demostró ser exitoso para la síntesis de una variedad de ciclopentenos sustituidos. Los productos de transposición inmediatos se podían convertir fácilmente en las ciclopentenonas correspondientes. [29]

Los vinilciclopropanos metoxi-sustituidos muestran velocidades de reacción significativamente más rápidas, lo que permite que la reorganización tenga lugar a 220 °C. [30]

Se descubrió que los siloxivinilciclopropanos [31], así como los sulfinilvinilciclopropanos análogos [32], podían usarse como sustratos para construir estructuras de ciclopenteno anuladas . Si bien estas reacciones aún requerían temperaturas de reacción superiores a los 300 °C, pudieron generar productos útiles derivados de la anulación del ciclopenteno a un sistema de anillo actual.

Los reordenamientos del vinilciclopropano también pueden mediarse fotoquímicamente. [33] [34] En un ejemplo particularmente intrigante, pudo demostrar que los vinilciclopropanos incrustados dentro de un núcleo de ciclooctano pueden convertirse en los correspondientes sistemas de anillos fusionados [5-5].

Los reordenamientos del vinilciclopropano se pueden llevar a cabo con catalizadores de metales de transición . El acetato de dirodio cataliza los reordenamientos desde temperatura ambiente hasta 80 °Cy [35] [36]

De manera análoga a la aceleración de la velocidad observada en el reordenamiento aniónico-oxi-Cope, Danheiser informó un efecto muy similar para los sustratos de vinilciclopropano que contienen sustituyentes [alcoxi]. [37]

Larsen informó otro resultado interesante en 1988. [38] Pudo promover reordenamientos de vinilciclopropano con sustratos como el que se muestra en la reacción a continuación a temperaturas tan bajas como -78 °C. Los sustratos se generaron in situ mediante la contracción del anillo de aductos de Diels-Alder de tiocarbonilo en condiciones básicas. Esta metodología permitió la formación de numerosos ciclopentenos altamente funcionalizados de manera estereoselectiva .

La metodología permite la formación de varios andamios de carbono [5-5] así como de carbono [5-6]. [39]

Los anillos de carbono de cinco miembros son motivos estructurales omnipresentes en los productos naturales. A diferencia del armazón de ciclohexano , más grande y completamente "consonante", los ciclopentanos y sus derivados son " disonantes " según el modelo de polaridades alternas de Lapworth-Evans. La disonancia en la polaridad limita claramente las formas en que se pueden desconectar los ciclopentanos, lo que se hace evidente en la menor cantidad de métodos generales disponibles para hacer anillos de cinco miembros en comparación con los anillos de seis miembros correspondientes. Especialmente el hecho de que no haya un equivalente de Diels-Alder para la síntesis de anillos de cinco miembros ha estado preocupando a los químicos sintéticos durante muchas décadas. En consecuencia, después de que se descubriera el reordenamiento del vinilciclopropano alrededor de 1960, la comunidad sintética no tardó mucho en darse cuenta del potencial inherente para formar ciclopentenos por medio del reordenamiento del vinilciclopropano. A medida que la transposición del vinilciclopropano progresó como metodología y las condiciones de reacción mejoraron durante la década de 1970, las primeras síntesis totales que utilizaban la transposición del vinilciclopropano comenzaron a aparecer alrededor de 1980. Las figuras clave para aplicar esta reacción en la síntesis total fueron Barry M. Trost , Elias J. Corey , Thomas Hudlicky, Leo A. Paquette ,
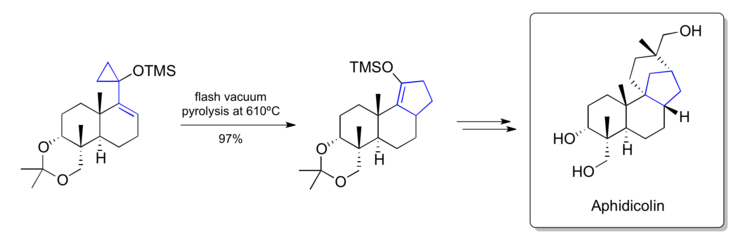
Una síntesis de la metodología de uso de Aphidicolin en torno al reordenamiento del vinilciclopropano desarrollada en su propio laboratorio. [40] Un paso clave convierte un siloxivinilciclopropano de etapa tardía en un ciclopenteno que contiene el esqueleto de carbono fusionado con [6-6-5] que se encuentra dentro del producto natural. El producto reordenado en el producto natural mediante manipulaciones adicionales.
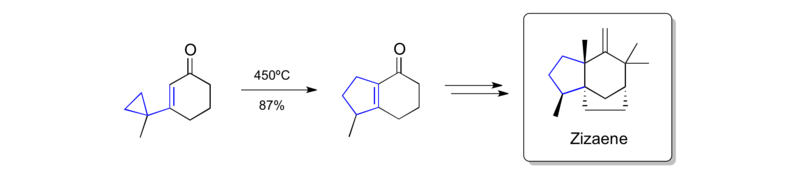
La síntesis de zizaeno es otro ejemplo temprano de la aplicación de un reordenamiento de vinilciclopropano como una desconexión clave. [41]
La metodología también se ha aplicado a la síntesis de hirsuteno [42] e isocomeno [43].

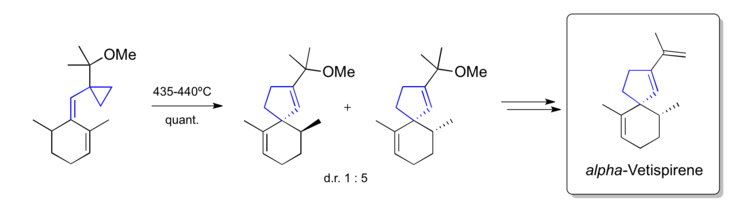
La transposición del cinilciclopropano se ha utilizado para construir el producto natural espirocíclico alfa-Vetispireno en 1982. [44]
El anteridiogen -An se preparó utilizando un reordenamiento de vinilciclopropano de etapa tardía mediado por ácido de Lewis. [45]

Se utilizó el reordenamiento de heteroátomo-vinilciclopropano catalizado por cobre para formar el núcleo de tetrahidrotiofeno de la biotina y la unidad de tiofeno de Plavix respectivamente. [46]

Se utilizó un reordenamiento de vinilciclopropano mediado por ácido para sintetizar el producto natural salviasperanol. [47]
