El sistema de recompensa (el circuito mesocorticolímbico) es un grupo de estructuras neuronales responsables de la prominencia de incentivos (es decir, "querer"; deseo o anhelo de una recompensa y motivación), el aprendizaje asociativo (principalmente refuerzo positivo y condicionamiento clásico ) y valencia positiva. emociones , particularmente aquellas que involucran el placer como componente central (p. ej., alegría , euforia y éxtasis ). [1] [2] La recompensa es la propiedad atractiva y motivadora de un estímulo que induce una conducta apetitiva, también conocida como conducta de acercamiento y conducta consumatoria. [1] Un estímulo gratificante ha sido descrito como "cualquier estímulo, objeto, evento, actividad o situación que tenga el potencial de hacernos acercarnos y consumirlo es, por definición, una recompensa". [1] En el condicionamiento operante , los estímulos gratificantes funcionan como reforzadores positivos ; [3] sin embargo, la afirmación inversa también es cierta: los reforzadores positivos son gratificantes. [3] [4]
El sistema de recompensa motiva a los animales a acercarse a estímulos o a adoptar comportamientos que aumentan su aptitud física (sexo, alimentos ricos en energía, etc.). La supervivencia de la mayoría de las especies animales depende de maximizar el contacto con estímulos beneficiosos y minimizar el contacto con estímulos dañinos. La cognición de recompensa sirve para aumentar la probabilidad de supervivencia y reproducción al provocar un aprendizaje asociativo, provocar un acercamiento y una conducta consumatoria y desencadenar emociones de valencia positiva . [3] Por lo tanto, la recompensa es un mecanismo que evolucionó para ayudar a aumentar la aptitud adaptativa de los animales. [5] En la adicción a las drogas , ciertas sustancias sobreactivan el circuito de recompensa, lo que lleva a un comportamiento compulsivo de búsqueda de sustancias como resultado de la plasticidad sináptica en el circuito. [6]
Las recompensas primarias son una clase de estímulos gratificantes que facilitan la supervivencia de uno mismo y de la descendencia , e incluyen recompensas homeostáticas (p. ej., comida sabrosa ) y reproductivas (p. ej., contacto sexual e inversión de los padres ). [1] [7] Las recompensas intrínsecas son recompensas incondicionadas que son atractivas y motivan el comportamiento porque son inherentemente placenteras. [1] Las recompensas extrínsecas (por ejemplo, dinero o ver al equipo deportivo favorito ganar un juego) son recompensas condicionadas que son atractivas y motivan el comportamiento, pero no son inherentemente placenteras. [1] [8] Las recompensas extrínsecas obtienen su valor motivacional como resultado de una asociación aprendida (es decir, condicionamiento) con recompensas intrínsecas. [1] Las recompensas extrínsecas también pueden provocar placer (por ejemplo, euforia por ganar una gran cantidad de dinero en la lotería) después de haber sido condicionadas clásicamente con recompensas intrínsecas. [1]
En neurociencia, el sistema de recompensa es un conjunto de estructuras cerebrales y vías neuronales que son responsables de la cognición relacionada con la recompensa, incluido el aprendizaje asociativo (principalmente condicionamiento clásico y refuerzo operante ), prominencia de incentivos (es decir, motivación y "deseo", deseo o anhelo de una recompensa), y emociones con valencia positiva , particularmente emociones que implican placer (es decir, "agrado" hedónico). [3] [2]
Los términos que se usan comúnmente para describir el comportamiento relacionado con el componente "querer" o deseo de la recompensa incluyen comportamiento apetitivo, comportamiento de acercamiento, comportamiento preparatorio, comportamiento instrumental, comportamiento anticipatorio y búsqueda. [9] Los términos que se usan comúnmente para describir el comportamiento relacionado con el componente de "gusto" o placer de la recompensa incluyen comportamiento consumatorio y comportamiento de toma. [9]
Las tres funciones principales de las recompensas son su capacidad para:
Las estructuras cerebrales que componen el sistema de recompensa se ubican principalmente dentro del bucle cortico-ganglio basal-tálamo-cortical ; [10] la porción de los ganglios basales del bucle impulsa la actividad dentro del sistema de recompensa. [10] La mayoría de las vías que conectan las estructuras dentro del sistema de recompensa son interneuronas glutamatérgicas , neuronas espinosas medias (MSN) GABAérgicas y neuronas de proyección dopaminérgicas , [10] [11] aunque otros tipos de neuronas de proyección contribuyen (p. ej., neuronas de proyección orexinérgicas ). ). El sistema de recompensa incluye el área tegmental ventral , el cuerpo estriado ventral (es decir, el núcleo accumbens y el tubérculo olfatorio ), el cuerpo estriado dorsal (es decir, el núcleo caudado y el putamen ), la sustancia negra (es decir, la pars compacta y la pars reticulata ), la corteza prefrontal , corteza cingulada anterior , corteza insular , hipocampo , hipotálamo (particularmente, el núcleo orexinérgico en el hipotálamo lateral ), tálamo (múltiples núcleos), núcleo subtalámico , globo pálido (tanto externo como interno ), pálido ventral , núcleo parabraquial , amígdala y resto de la amígdala extendida . [2] [10] [12] [13] [14] El núcleo dorsal del rafe y el cerebelo parecen modular algunas formas de cognición relacionada con la recompensa (es decir, aprendizaje asociativo , prominencia motivacional y emociones positivas ) y también comportamientos. [15] [16] [17] El núcleo tegmental laterodorsal (LDT) , el núcleo pedunculopontino (PPTg) y la habénula lateral (LHb) (tanto directa como indirectamente a través del núcleo tegmental rostromedial (RMTg) ) también son capaces de inducir prominencia aversiva. y prominencia de incentivos a través de sus proyecciones al área tegmental ventral (ATV). [18] Tanto el LDT como el PPTg envían proyecciones glutaminérgicas al VTA que hacen sinapsis con neuronas dopaminérgicas, las cuales pueden producir prominencia incentivadora. La LHb envía proyecciones glutaminérgicas, la mayoría de las cuales hacen sinapsis con neuronas RMTg GABAérgicas que a su vez impulsan la inhibición de las neuronas VTA dopaminérgicas, aunque algunas proyecciones de LHb terminan en interneuronas VTA. Estas proyecciones de LHb se activan tanto por estímulos aversivos como por la ausencia de una recompensa esperada, y la excitación de la LHb puede inducir aversión. [19] [20] [21]
La mayoría de las vías de la dopamina (es decir, neuronas que utilizan el neurotransmisor dopamina para comunicarse con otras neuronas) que se proyectan fuera del área tegmental ventral son parte del sistema de recompensa; [10] en estas vías, la dopamina actúa sobre los receptores tipo D1 o tipo D2 para estimular (tipo D1) o inhibir (tipo D2) la producción de AMPc . [22] Las neuronas espinosas medias GABAérgicas del cuerpo estriado también son componentes del sistema de recompensa. [10] Los núcleos de proyección glutamatérgicos en el núcleo subtalámico, la corteza prefrontal, el hipocampo, el tálamo y la amígdala se conectan con otras partes del sistema de recompensa a través de las vías del glutamato. [10] El paquete del prosencéfalo medial , que es un conjunto de muchas vías neuronales que median la recompensa por estimulación cerebral (es decir, la recompensa derivada de la estimulación electroquímica directa del hipotálamo lateral ), también es un componente del sistema de recompensa. [23]
Existen dos teorías con respecto a la actividad del núcleo accumbens y el gusto y el deseo de la generación. La hipótesis de la inhibición (o hiperpolarización) propone que el núcleo accumbens ejerce efectos inhibidores tónicos sobre estructuras aguas abajo como el pálido ventral, el hipotálamo o el área tegmental ventral, y que al inhibir los MSN en el núcleo accumbens (NAcc), estas estructuras se excitan ". "Liberar" conductas relacionadas con la recompensa. Si bien los agonistas del receptor GABA son capaces de provocar reacciones tanto de "gusto" como de "deseo" en el núcleo accumbens, las entradas glutaminérgicas de la amígdala basolateral , el hipocampo ventral y la corteza prefrontal medial pueden impulsar la prominencia de los incentivos. Además, si bien la mayoría de los estudios encuentran que las neuronas NAcc reducen la activación en respuesta a la recompensa, varios estudios encuentran la respuesta opuesta. Esto llevó a la propuesta de la hipótesis de la desinhibición (o despolarización), que propone que la excitación o las neuronas NAcc, o al menos ciertos subconjuntos, impulsan el comportamiento relacionado con la recompensa. [2] [24] [25]
Después de casi 50 años de investigación sobre la recompensa por estimulación cerebral, los expertos han certificado que docenas de sitios del cerebro mantendrán la autoestimulación intracraneal . Las regiones incluyen el hipotálamo lateral y los haces del prosencéfalo medial, que son especialmente eficaces. La estimulación allí activa las fibras que forman las vías ascendentes; las vías ascendentes incluyen la vía mesolímbica de la dopamina , que se proyecta desde el área tegmental ventral hasta el núcleo accumbens . Hay varias explicaciones de por qué la vía mesolímbica de la dopamina es fundamental para los circuitos que median la recompensa. En primer lugar, hay un marcado aumento en la liberación de dopamina desde la vía mesolímbica cuando los animales realizan una autoestimulación intracraneal. [5] En segundo lugar, los experimentos indican consistentemente que la recompensa por estimulación cerebral estimula el refuerzo de vías que normalmente se activan mediante recompensas naturales , y la recompensa por drogas o la autoestimulación intracraneal pueden ejercer una activación más poderosa de los mecanismos centrales de recompensa porque activan el centro de recompensa directamente. en lugar de a través de los nervios periféricos . [5] [26] [27] En tercer lugar, cuando a los animales se les administran drogas adictivas o participan en comportamientos naturalmente gratificantes, como la alimentación o la actividad sexual, hay una marcada liberación de dopamina dentro del núcleo accumbens. [5] Sin embargo, la dopamina no es el único compuesto de recompensa en el cerebro.

Área tegmental ventral
Estriado (Núcleo Accumbens)
Corteza prefrontal
Hipocampo
Amígdala
El placer es un componente de la recompensa, pero no todas las recompensas son placenteras (por ejemplo, el dinero no provoca placer a menos que esta respuesta esté condicionada). [1] Los estímulos que son naturalmente placenteros y, por lo tanto, atractivos, se conocen como recompensas intrínsecas , mientras que los estímulos que son atractivos y motivan el comportamiento de aproximación, pero que no son inherentemente placenteros, se denominan recompensas extrínsecas . [1] Las recompensas extrínsecas (por ejemplo, dinero) son gratificantes como resultado de una asociación aprendida con una recompensa intrínseca. [1] En otras palabras, las recompensas extrínsecas funcionan como imanes motivacionales que provocan reacciones de "deseo", pero no de "gusto", una vez que se han adquirido. [1]
El sistema de recompensa contiene centros de placer o puntos de acceso hedónicos , es decir, estructuras cerebrales que median las reacciones de placer o "agrado" de las recompensas intrínsecas. En octubre de 2017, [actualizar]se han identificado puntos de acceso hedónicos en subcompartimentos dentro de la capa del núcleo accumbens , el pálido ventral , el núcleo parabraquial , la corteza orbitofrontal (OFC) y la corteza insular . [2] [14] [36] El punto de acceso dentro de la capa del núcleo accumbens se encuentra en el cuadrante rostrodorsal de la capa medial, mientras que el punto frío hedónico se encuentra en una región más posterior. El pálido ventral posterior también contiene un punto de acceso hedónico, mientras que el pálido ventral anterior contiene un punto frío hedónico. En ratas, las microinyecciones de opioides , endocannabinoides y orexina son capaces de mejorar las reacciones de agrado en estos puntos críticos. [2] Se ha demostrado que los puntos calientes hedónicos ubicados en la OFC anterior y la ínsula posterior responden a la orexina y los opioides en ratas, al igual que el punto frío hedónico superpuesto en la ínsula anterior y la OFC posterior. [36] Por otro lado, solo se ha demostrado que el punto de acceso del núcleo parabraquial responde a los agonistas del receptor de benzodiazepinas. [2]
Los puntos de acceso hedónicos están vinculados funcionalmente, en el sentido de que la activación de un punto de acceso da como resultado el reclutamiento de los demás, como lo indica la expresión inducida de c-Fos , un gen temprano inmediato . Además, la inhibición de un punto de acceso da como resultado la atenuación de los efectos de la activación de otro punto de acceso. [2] [36] Por lo tanto, se cree que la activación simultánea de cada punto hedónico dentro del sistema de recompensa es necesaria para generar la sensación de euforia intensa . [37]

La prominencia del incentivo es el atributo de "querer" o "deseo", que incluye un componente motivacional, que es asignado a un estímulo gratificante por la capa del núcleo accumbens (capa NAcc). [1] [38] [39] El grado de neurotransmisión de dopamina en la capa NAcc desde la vía mesolímbica está altamente correlacionado con la magnitud de la prominencia del incentivo para los estímulos gratificantes. [38]
La activación de la región dorsorostral del núcleo accumbens se correlaciona con aumentos en el deseo sin aumentos concurrentes en el gusto. [40] Sin embargo, la neurotransmisión dopaminérgica en la capa del núcleo accumbens es responsable no sólo de la prominencia motivacional apetitiva (es decir, prominencia de incentivos) hacia estímulos gratificantes, sino también de la prominencia motivacional aversiva, que dirige el comportamiento lejos de estímulos indeseables. [9] [41] [42] En el cuerpo estriado dorsal, la activación de D1 que expresa MSN produce prominencia de incentivo apetitivo, mientras que la activación de D2 que expresa MSN produce aversión. En la NAcc, dicha dicotomía no es tan clara, y la activación de los MSN D1 y D2 es suficiente para mejorar la motivación, [43] [44] probablemente mediante la desinhibición del VTA mediante la inhibición del pálido ventral. [45] [46]
La teoría de la sensibilización al incentivo de Robinson y Berridge de 1993 propuso que la recompensa contiene componentes psicológicos separables: deseo (incentivo) y agrado (placer). Para explicar el creciente contacto con un determinado estímulo como el chocolate, hay dos factores independientes en juego: nuestro deseo de tener el chocolate (deseo) y el efecto de placer del chocolate (gusto). Según Robinson y Berridge, querer y agradar son dos aspectos del mismo proceso, por lo que las recompensas suelen ser deseadas y agradadas en el mismo grado. Sin embargo, el querer y el agradar también cambian de forma independiente en determinadas circunstancias. Por ejemplo, las ratas que no comen después de recibir dopamina (experimentan una pérdida del deseo de comer) actúan como si todavía les gustara la comida. En otro ejemplo, los electrodos de autoestimulación activados en el hipotálamo lateral de ratas aumentan el apetito, pero también provocan más reacciones adversas a sabores como el azúcar y la sal; aparentemente, la estimulación aumenta el deseo pero no el agrado. Estos resultados demuestran que el sistema de recompensa de las ratas incluye procesos independientes de deseo y agrado. Se cree que el componente de deseo está controlado por vías dopaminérgicas , mientras que se cree que el componente de agrado está controlado por sistemas de opiáceos-GABA-endocannabinoides. [5]
Koobs y Le Moal propusieron que existe un circuito separado responsable de la atenuación del comportamiento de búsqueda de recompensa, al que denominaron circuito anti-recompensa. Este componente actúa como freno en el circuito de recompensa, evitando así la búsqueda excesiva de comida, sexo, etc. Este circuito involucra múltiples partes de la amígdala (el núcleo del lecho de la estría terminal, el núcleo central), el núcleo Accumbens y la señal. moléculas que incluyen norepinefrina, factor liberador de corticotropina y dinorfina. [47] También se supone que este circuito media los componentes desagradables del estrés y, por lo tanto, se cree que está involucrado en la adicción y la abstinencia. Si bien el circuito de recompensa media el refuerzo positivo inicial involucrado en el desarrollo de la adicción, es el circuito anti-recompensa que luego domina a través del refuerzo negativo el que motiva la búsqueda de estímulos gratificantes. [48]
Los estímulos gratificantes pueden impulsar el aprendizaje tanto en la forma de condicionamiento clásico (condicionamiento pavloviano) como en forma de condicionamiento operante (condicionamiento instrumental) . En el condicionamiento clásico, una recompensa puede actuar como un estímulo incondicionado que, cuando se asocia con el estímulo condicionado, hace que el estímulo condicionado provoque respuestas tanto musculoesqueléticas (en forma de conductas simples de aproximación y evitación) como vegetativas. En el condicionamiento operante, una recompensa puede actuar como reforzador en el sentido de que aumenta o apoya acciones que conducen a sí misma. [3] Los comportamientos aprendidos pueden o no ser sensibles al valor de los resultados a los que conducen; Los comportamientos que son sensibles a la contingencia de un resultado sobre la realización de una acción, así como al valor del resultado, están dirigidos a objetivos , mientras que las acciones provocadas que son insensibles a la contingencia o al valor se denominan hábitos . [49] Se cree que esta distinción refleja dos formas de aprendizaje, sin modelos y basado en modelos. El aprendizaje gratuito de modelos implica el simple almacenamiento en caché y la actualización de valores. Por el contrario, el aprendizaje basado en modelos implica el almacenamiento y la construcción de un modelo interno de eventos que permite la inferencia y la predicción flexible. Aunque generalmente se supone que el condicionamiento pavloviano no tiene modelos, la prominencia del incentivo asignada a un estímulo condicionado es flexible con respecto a los cambios en los estados motivacionales internos. [50]
Los distintos sistemas neuronales son responsables de aprender asociaciones entre estímulos y resultados, acciones y resultados, y estímulos y respuestas. Aunque el condicionamiento clásico no se limita al sistema de recompensa, la mejora del rendimiento instrumental mediante estímulos (es decir, la transferencia pavloviana-instrumental ) requiere el núcleo accumbens. El aprendizaje instrumental habitual y el dirigido a objetivos dependen del cuerpo estriado lateral y del cuerpo estriado medial, respectivamente. [49]
Durante el aprendizaje instrumental, se producen cambios opuestos en la proporción de receptores AMPA a NMDA y ERK fosforilada en los MSN de tipo D 1 y D 2 que constituyen las vías directa e indirecta , respectivamente. [51] [52] Estos cambios en la plasticidad sináptica y el aprendizaje que los acompaña dependen de la activación de los receptores estriatales D1 y NMDA. La cascada intracelular activada por los receptores D1 implica el reclutamiento de la proteína quinasa A y, mediante la fosforilación resultante de DARPP-32 , la inhibición de las fosfatasas que desactivan ERK. "Los receptores NMDA activan ERK a través de una vía Ras-Raf-MEK-ERK diferente pero interrelacionada" . La activación de ERK mediada por NMDA por sí sola es autolimitada, ya que la activación de NMDA también inhibe la inhibición mediada por PKA de ERK que desactiva las fosfatasas. Sin embargo, cuando las cascadas D1 y NMDA se coactivan, funcionan sinérgicamente y la activación resultante de ERK regula la plasticidad sináptica en forma de reestructuración de la columna, transporte de receptores AMPA, regulación de CREB y aumento de la excitabilidad celular mediante la inhibición de Kv4.2. [53] [54] [55]
ΔFosB (DeltaFosB) – un factor de transcripción genética – la sobreexpresión en las neuronas espinosas medias de tipo D1 del núcleo accumbens es el factor común crucial entre prácticamente todas las formas de adicción (es decir, adicciones conductuales y adicciones a las drogas ) que induce conductas relacionadas con la adicción y plasticidad neuronal . [56] [57] [58] [59] En particular, ΔFosB promueve la autoadministración , la sensibilización de recompensa y los efectos de sensibilización cruzada de recompensa entre drogas y comportamientos adictivos específicos. [56] [57] [58] [60] [61] También se sabe que ciertas modificaciones epigenéticas de las colas de las proteínas histonas (es decir, modificaciones de histonas) en regiones específicas del cerebro desempeñan un papel crucial en la base molecular de las adicciones . [59] [62] [63] [64]
Las drogas y los comportamientos adictivos son gratificantes y reforzadores (es decir, son adictivos ) debido a sus efectos sobre la vía de recompensa de la dopamina . [13] [65]
El hipotálamo lateral y el haz del prosencéfalo medial han sido el sitio de recompensa de estimulación cerebral más estudiado, particularmente en estudios de los efectos de las drogas sobre la recompensa de estimulación cerebral. [66] El sistema de neurotransmisores que se ha identificado más claramente con las acciones adictivas de las drogas de abuso es el sistema de dopamina mesolímbico, con sus objetivos eferentes en el núcleo accumbens y sus aferentes GABAérgicos locales. Las acciones de recompensa relevantes de la anfetamina y la cocaína se encuentran en las sinapsis dopaminérgicas del núcleo accumbens y quizás en la corteza prefrontal medial . Las ratas también aprenden a presionar una palanca para inyectarse cocaína en la corteza prefrontal medial, que funciona aumentando el recambio de dopamina en el núcleo accumbens. [67] [68] La nicotina infundida directamente en el núcleo accumbens también mejora la liberación local de dopamina, presumiblemente por una acción presináptica sobre las terminales dopaminérgicas de esta región. Los receptores nicotínicos se localizan en los cuerpos celulares dopaminérgicos y las inyecciones locales de nicotina aumentan la activación de las células dopaminérgicas, que es fundamental para la recompensa nicotínico. [69] [70] Como consecuencia, también es probable que algunos fármacos adictivos adicionales disminuyan la producción de las neuronas espinosas medias , a pesar de activar las proyecciones dopaminérgicas. Para los opiáceos, el sitio de umbral más bajo para los efectos de recompensa implica acciones sobre las neuronas GABAérgicas en el área tegmental ventral , un sitio secundario de acciones gratificantes de los opiáceos sobre las neuronas de salida espinosas medias del núcleo accumbens. Así, lo siguiente forma el núcleo de los circuitos de recompensa de drogas actualmente caracterizados; Aferentes GABAérgicos a las neuronas dopaminérgicas mesolímbicas (sustrato primario de la recompensa de los opiáceos), las propias neuronas dopaminérgicas mesolímbicas (sustrato principal de la recompensa de los estimulantes psicomotores) y eferentes GABAérgicos a las neuronas dopaminérgicas mesolímbicas (un sitio secundario de la recompensa de los opiáceos). [66]
La prominencia motivacional disfuncional aparece en una serie de síntomas y trastornos psiquiátricos. La anhedonia , tradicionalmente definida como una capacidad reducida para sentir placer, ha sido reexaminada como reflejo de una prominencia de incentivos embotada, ya que la mayoría de las poblaciones anhedónicas exhiben un "gusto" intacto. [71] [72] En el otro extremo del espectro, una mayor prominencia de incentivos que se reduce a estímulos específicos es característica de las adicciones conductuales y a las drogas. En el caso del miedo o la paranoia, la disfunción puede residir en una elevada prominencia aversiva . [73] En la literatura moderna, la anhedonia se asocia con las dos formas de placer propuestas, "anticipatoria" y "consumadora".
Los estudios de neuroimagen en diagnósticos asociados con anhedonia han informado una actividad reducida en la OFC y el cuerpo estriado ventral. [74] Un metaanálisis informó que la anhedonia se asoció con una respuesta neuronal reducida para recompensar la anticipación en el núcleo caudado, putamen, núcleo accumbens y corteza prefrontal medial (mPFC). [75]
Ciertos tipos de depresión se asocian con una motivación reducida, según lo evaluado por la disposición a esforzarse para obtener una recompensa. Estas anomalías se han relacionado tentativamente con una actividad reducida en áreas del cuerpo estriado y, si bien se supone que las anomalías dopaminérgicas desempeñan un papel, la mayoría de los estudios que investigan la función de la dopamina en la depresión han informado resultados inconsistentes. [76] [77] Aunque los estudios post mortem y de neuroimagen han encontrado anomalías en numerosas regiones del sistema de recompensa, pocos hallazgos se replican de manera consistente. Algunos estudios han informado una actividad reducida de la NAcc, el hipocampo, la corteza prefrontal medial (mPFC) y la corteza orbitofrontal (OFC), así como una actividad elevada de la amígdala basolateral y la corteza cingulada subgenual (sgACC) durante tareas relacionadas con la recompensa o estímulos positivos. Estas anomalías de la neuroimagen se complementan con poca investigación post mortem, pero la poca investigación que se ha realizado sugiere una reducción de las sinapsis excitadoras en el mPFC. [78] La actividad reducida en el mPFC durante las tareas relacionadas con la recompensa parece estar localizada en regiones más dorsales (es decir, la corteza cingulada pregenual ), mientras que el sgACC más ventral es hiperactivo en la depresión. [79]
Los intentos de investigar los circuitos neuronales subyacentes en modelos animales también han arrojado resultados contradictorios. Se utilizan comúnmente dos paradigmas para simular la depresión, la derrota social crónica (CSDS) y el estrés leve crónico (CMS), aunque existen muchos. CSDS produce una preferencia reducida por la sacarosa, interacciones sociales reducidas y una mayor inmovilidad en la prueba de natación forzada. De manera similar, CMS reduce la preferencia por sacarosa y la desesperación conductual según lo evaluado mediante pruebas de suspensión de la cola y natación forzada. Los animales susceptibles a CSDS exhiben una mayor activación fásica de VTA y la inhibición de las proyecciones de VTA-NAcc atenúa los déficits de comportamiento inducidos por CSDS. [80] Sin embargo, la inhibición de las proyecciones VTA- mPFC exacerba el retraimiento social. Por otro lado, las reducciones asociadas con la CMS en la preferencia de sacarosa y la inmovilidad fueron atenuadas y exacerbadas por la excitación e inhibición del VTA, respectivamente. [81] [82] Aunque estas diferencias pueden ser atribuibles a diferentes protocolos de estimulación o paradigmas de traducción deficientes, los resultados variables también pueden residir en la funcionalidad heterogénea de las regiones relacionadas con la recompensa. [83]
La estimulación optogenética del mPFC en su conjunto produce efectos antidepresivos. Este efecto parece localizado en el homólogo de roedor de la pgACC (la corteza prelímbica), ya que la estimulación del homólogo de roedor de la sgACC (la corteza infralímbica) no produce efectos de comportamiento. Además, la estimulación cerebral profunda en la corteza infralímbica, que se cree que tiene un efecto inhibidor, también produce un efecto antidepresivo. Este hallazgo es congruente con la observación de que la inhibición farmacológica de la corteza infralímbica atenúa las conductas depresivas. [83]
La esquizofrenia se asocia con déficits de motivación, comúnmente agrupados bajo otros síntomas negativos como la reducción del habla espontánea . Con frecuencia se informa que la experiencia de "gustar" está intacta, [84] tanto desde el punto de vista conductual como neuronal, aunque los resultados pueden ser específicos de ciertos estímulos, como las recompensas monetarias. [85] Además, el aprendizaje implícito y las tareas simples relacionadas con la recompensa también están intactos en la esquizofrenia. [86] Más bien, los déficits en el sistema de recompensa son evidentes durante las tareas relacionadas con la recompensa que son cognitivamente complejas. Estos déficits están asociados con una actividad anormal del cuerpo estriado y de la OFC, así como con anomalías en regiones asociadas con funciones cognitivas como la corteza prefrontal dorsolateral (DLPFC). [87]
En las personas con TDAH , los aspectos centrales del sistema de recompensa están poco activos, lo que dificulta obtener recompensas de las actividades habituales. Quienes padecen este trastorno experimentan un aumento de motivación después de que un comportamiento de alta estimulación desencadena la liberación de dopamina. Como consecuencia de ese impulso y recompensa, el regreso a los niveles iniciales da como resultado una caída inmediata de la motivación. [88]
Se dice que las alteraciones de la función dopaminérgica y serotoninérgica son factores clave en el TDAH. [89] Estas deficiencias pueden conducir a una disfunción ejecutiva , como la desregulación del procesamiento de la recompensa y la disfunción motivacional, incluida la anhedonia. [90]
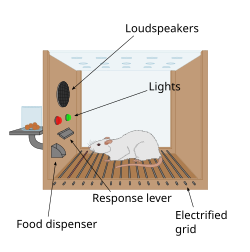
La primera pista de la presencia de un sistema de recompensa en el cerebro llegó con un descubrimiento accidental realizado por James Olds y Peter Milner en 1954. Descubrieron que las ratas realizaban comportamientos como presionar una barra para administrar una breve ráfaga de estimulación eléctrica a zonas específicas. sitios en sus cerebros. Este fenómeno se denomina autoestimulación intracraneal o estimulación cerebral de recompensa . Por lo general, las ratas presionarán una palanca cientos o miles de veces por hora para obtener esta estimulación cerebral, y solo se detendrán cuando estén agotadas. Mientras intentaba enseñar a las ratas cómo resolver problemas y recorrer laberintos, la estimulación de ciertas regiones del cerebro donde se encontraba la estimulación parecía dar placer a los animales. Intentaron lo mismo con humanos y los resultados fueron similares. La explicación de por qué los animales adoptan un comportamiento que no tiene valor para la supervivencia ni de ellos mismos ni de su especie es que la estimulación cerebral activa el sistema de recompensa subyacente. [91]
En un descubrimiento fundamental realizado en 1954, los investigadores James Olds y Peter Milner descubrieron que la estimulación eléctrica de bajo voltaje de ciertas regiones del cerebro de la rata actuaba como una recompensa al enseñar a los animales a recorrer laberintos y resolver problemas. [92] [ verificación fallida ] [93] Parecía que la estimulación de esas partes del cerebro daba placer a los animales, [92] y en trabajos posteriores los humanos informaron sensaciones placenteras de dicha estimulación. [ cita necesaria ] Cuando se probaron ratas en cajas Skinner donde podían estimular el sistema de recompensa presionando una palanca, las ratas presionaron durante horas. [93] Las investigaciones realizadas en las siguientes dos décadas establecieron que la dopamina es una de las principales sustancias químicas que ayudan a la señalización neuronal en estas regiones, y se sugirió que la dopamina era la "química del placer" del cerebro. [94]
Ivan Pavlov fue un psicólogo que utilizó el sistema de recompensa para estudiar el condicionamiento clásico . Pavlov utilizó el sistema de recompensa recompensando a los perros con comida después de haber escuchado una campana u otro estímulo. Pavlov recompensaba a los perros para que asociaran la comida, la recompensa, con la campana, el estímulo. [95] Edward L. Thorndike utilizó el sistema de recompensa para estudiar el condicionamiento operante. Comenzó poniendo gatos en una caja de rompecabezas y colocando comida fuera de la caja para que el gato quisiera escapar. Los gatos trabajaron para salir de la caja del rompecabezas y llegar a la comida. Aunque los gatos comieron la comida después de escapar de la caja, Thorndike descubrió que los gatos intentaron escapar de la caja sin la recompensa de la comida. Thorndike utilizó las recompensas de la comida y la libertad para estimular el sistema de recompensa de los gatos. Thorndike usó esto para ver cómo los gatos aprendían a escapar de la caja. [96] Más recientemente, Ivan De Araujo y sus colegas utilizaron nutrientes dentro del intestino para estimular el sistema de recompensa a través del nervio vago. [97]
Los animales aprenden rápidamente a presionar una barra para obtener una inyección de opiáceos directamente en el tegmento del mesencéfalo o en el núcleo accumbens . Los mismos animales no trabajan para obtener los opiáceos si las neuronas dopaminérgicas de la vía mesolímbica están inactivadas. Desde esta perspectiva, los animales, al igual que los humanos, adoptan comportamientos que aumentan la liberación de dopamina.
Kent Berridge , investigador en neurociencia afectiva , descubrió que los sabores dulces ( que les gustaban ) y amargos ( que no les gustaban ) producían distintas expresiones orofaciales , y estas expresiones eran mostradas de manera similar por los recién nacidos humanos, los orangutanes y las ratas. Esto era evidencia de que el placer (específicamente, el agrado ) tiene características objetivas y era esencialmente el mismo en varias especies animales. La mayoría de los estudios de neurociencia han demostrado que cuanta más dopamina libera la recompensa, más efectiva es la recompensa. A esto se le llama impacto hedónico, que puede modificarse mediante el esfuerzo por la recompensa y la recompensa misma. Berridge descubrió que bloquear los sistemas de dopamina no parecía cambiar la reacción positiva a algo dulce (medida por la expresión facial). En otras palabras, el impacto hedónico no cambió según la cantidad de azúcar. Esto descartó la suposición convencional de que la dopamina media el placer. Incluso con alteraciones de la dopamina más intensas, los datos parecieron permanecer constantes. [98] Sin embargo, un estudio clínico de enero de 2019 que evaluó el efecto de un precursor de dopamina ( levodopa ), un antagonista ( risperidona ) y un placebo en las respuestas de recompensa a la música, incluido el grado de placer experimentado durante los escalofríos musicales , medido por cambios en la actividad electrodérmica , así como calificaciones subjetivas, descubrieron que la manipulación de la neurotransmisión de dopamina regula bidireccionalmente la cognición del placer (específicamente, el impacto hedónico de la música ) en sujetos humanos. [99] [100] Esta investigación demostró que el aumento de la neurotransmisión de dopamina actúa como una condición sine qua non para reacciones hedónicas placenteras a la música en humanos. [99] [100]
Berridge desarrolló la hipótesis de la prominencia de los incentivos para abordar el aspecto de deseo de las recompensas. Explica el uso compulsivo de drogas por parte de los drogadictos incluso cuando la droga ya no produce euforia, y los antojos experimentados incluso después de que el individuo ha terminado la abstinencia. Algunos adictos responden a ciertos estímulos que implican cambios neuronales provocados por las drogas. Esta sensibilización en el cerebro es similar al efecto de la dopamina porque se producen reacciones de deseo y agrado . Los cerebros y comportamientos humanos y animales experimentan cambios similares con respecto a los sistemas de recompensa porque estos sistemas son muy prominentes. [98]
En la corteza prefrontal, la evidencia reciente indica que la OFC [corteza orbitofrontal] y la corteza de la ínsula pueden contener cada una sus propios puntos calientes adicionales (DC Castro et al., Soc. Neurosci., resumen). En subregiones específicas de cada área, las microinyecciones estimulantes de opioides u orexina parecen aumentar el número de reacciones
de agrado
provocadas por el dulzor, similar a los puntos calientes [nucleus accumbens] NAc y [ventral pallidum] VP. La confirmación exitosa de puntos calientes hedónicos en la OFC o la ínsula sería importante y posiblemente relevante para el sitio orbitofrontal medio anterior mencionado anteriormente que rastrea especialmente el placer subjetivo de los alimentos en humanos (Georgiadis et al., 2012; Kringelbach, 2005; Kringelbach et Veldhuizen et al., 2010; Finalmente, en el tronco del encéfalo, un sitio del rombencéfalo cerca del núcleo parabraquial de la protuberancia dorsal también parece capaz de contribuir a las ganancias hedónicas de función (Söderpalm y Berridge, 2000). Un mecanismo del tronco encefálico para el placer puede parecer más sorprendente que los puntos calientes del prosencéfalo para cualquiera que considere el tronco encefálico como meramente reflejo, pero el núcleo parabraquial pontino contribuye al gusto, el dolor y muchas sensaciones viscerales del cuerpo y también se ha sugerido que desempeña un papel importante. papel en la motivación (Wu et al., 2012) y en la emoción humana (especialmente relacionada con la hipótesis del marcador somático) (Damasio, 2010).
Las recompensas en el condicionamiento operante son reforzadores positivos. ... El comportamiento operante da una buena definición de recompensa. Cualquier cosa que haga que un individuo regrese por más es un reforzador positivo y, por tanto, una recompensa. Aunque proporciona una buena definición, el refuerzo positivo es sólo una de varias funciones de recompensa. ... Las recompensas son atractivas. Son motivadores y nos hacen esforzarnos. ... Las recompensas inducen una conducta de aproximación, también llamada conducta apetitiva o preparatoria, conducta sexual y conducta consumatoria. ... Así, cualquier estímulo, objeto, evento, actividad o situación que tenga el potencial de hacernos acercarnos a él y consumirlo es, por definición, una recompensa. ... Los estímulos, objetos, eventos, situaciones y actividades gratificantes constan de varios componentes principales. En primer lugar, las recompensas tienen componentes sensoriales básicos (visual, auditivo, somatosensorial, gustativo y olfativo)... En segundo lugar, las recompensas son destacadas y, por tanto, provocan atención, que se manifiesta como respuestas de orientación. La prominencia de las recompensas se deriva de tres factores principales, a saber, su intensidad e impacto físicos (prominencia física), su novedad y sorpresa (prominencia novedad/sorpresa) y su impacto motivacional general compartido con los castigadores (prominencia motivacional). Una forma separada no incluida en este esquema, la prominencia del incentivo, aborda principalmente la función de la dopamina en la adicción y se refiere sólo al comportamiento de aproximación (en contraposición al aprendizaje)... En tercer lugar, las recompensas tienen un componente de valor que determina los efectos motivadores positivos de las recompensas y es no está contenido ni explicado por los componentes sensoriales y atencionales. Este componente refleja preferencias de comportamiento y, por lo tanto, es subjetivo y está determinado sólo parcialmente por parámetros físicos. Sólo este componente constituye lo que entendemos como recompensa. Media el refuerzo conductual específico, la generación de enfoque y los efectos emocionales de las recompensas que son cruciales para la supervivencia y reproducción del organismo, mientras que todos los demás componentes solo apoyan estas funciones. ... Las recompensas también pueden ser intrínsecas al comportamiento. Contrastan con las recompensas extrínsecas que motivan la conducta y constituyen la esencia de la conducta operante en las pruebas de laboratorio. Las recompensas intrínsecas son actividades que son placenteras en sí mismas y se realizan por sí mismas, sin ser el medio para obtener recompensas extrínsecas. ... Las recompensas intrínsecas son recompensas genuinas por derecho propio, ya que inducen el aprendizaje, el acercamiento y el placer, como perfeccionar, tocar y disfrutar el piano. Aunque pueden servir para condicionar recompensas de orden superior, no son recompensas condicionadas de orden superior, ya que para alcanzar sus propiedades de recompensa no es necesario combinarlas con una recompensa incondicionada. ... Estas emociones también se denominan agrado (por placer) y querer (por deseo) en la investigación sobre adicciones y apoyan firmemente el aprendizaje y el enfoque generando funciones de recompensa.
[El cuerpo estriado] recibe aportes dopaminérgicos del área tegmental ventral (VTA) y la sustancia negra (SNr) y aportes glutamatérgicos de varias áreas, incluida la corteza, el hipocampo, la amígdala y el tálamo (Swanson, 1982; Phillipson y Griffiths , 1985; Finch, 1996; Groenewegen et al., 1999; Estas entradas glutamatérgicas hacen contacto en las cabezas de las espinas dendríticas de las neuronas de proyección espinosa media (MSN) GABAérgicas del estriado, mientras que las entradas dopaminérgicas hacen sinapsis en el cuello de la columna, lo que permite una interacción importante y compleja entre estas dos entradas en la modulación de la actividad de MSN. También cabe señalar que existe una pequeña población de neuronas en el [núcleo accumbens] NAc que coexpresan los receptores D1 y D2, aunque esto se limita en gran medida a la capa de NAc (Bertran-Gonzalez et al., 2008). ... Las neuronas en las subdivisiones del núcleo de NAc y de la capa de NAc también difieren funcionalmente. El núcleo de NAc participa en el procesamiento de estímulos condicionados, mientras que la capa de NAc es más importante en el procesamiento de estímulos incondicionados; Clásicamente, se cree que estas dos poblaciones de MSN estriatales tienen efectos opuestos sobre la producción de los ganglios basales. La activación de los dMSN provoca una excitación neta del tálamo que da como resultado un circuito de retroalimentación cortical positiva; actuando así como una señal de "adelante" para iniciar el comportamiento. Sin embargo, la activación de los iMSN causa una inhibición neta de la actividad talámica, lo que resulta en un circuito de retroalimentación cortical negativa y, por lo tanto, sirve como un "freno" para inhibir el comportamiento... También hay cada vez más evidencia de que los iMSN desempeñan un papel en la motivación y la adicción ( Lobo y Nestler, 2011; Grueter et al., 2013). Por ejemplo, la activación optogenética de los iMSN de núcleo y cubierta de NAc suprimió el desarrollo de un CPP de cocaína, mientras que la ablación selectiva de los iMSN de núcleo y cubierta de NAc... mejoró el desarrollo y la persistencia de un CPP de anfetamina (Durieux et al., 2009; Lobo et otros, 2010). Estos hallazgos sugieren que los iMSN pueden modular bidireccionalmente la recompensa de las drogas. ... En conjunto, estos datos sugieren que los iMSN normalmente actúan para restringir el comportamiento de consumo de drogas y el reclutamiento de estas neuronas puede, de hecho, proteger contra el desarrollo del uso compulsivo de drogas.
Las regiones de los ganglios basales, que incluyen el cuerpo estriado dorsal y ventral, los segmentos internos y externos del globo pálido, el núcleo subtalámico y los cuerpos celulares dopaminérgicos de la sustancia negra, están muy implicados no solo en el control motor fino sino también en [corteza prefrontal] función PFC.43 De estas regiones, el [núcleo accumbens] NAc (descrita anteriormente) y el [dorsal striatum] DS (descrito más adelante) se examinan con mayor frecuencia con respecto a la adicción. Por lo tanto, aquí sólo se mencionará una breve descripción del papel modulador de los ganglios basales en los circuitos relevantes para la adicción. La salida general de los ganglios basales se produce predominantemente a través del tálamo, que luego se proyecta de regreso al PFC para formar bucles cortico-estriatal-tálamo-corticales (CSTC). Se proponen tres bucles CSTC para modular la función ejecutiva, la selección de acciones y la inhibición del comportamiento. En el circuito prefrontal dorsolateral, los ganglios basales modulan principalmente la identificación y selección de objetivos, incluidas las recompensas.44 El circuito OFC [corteza orbitofrontal] modula la toma de decisiones y la impulsividad, y el circuito cingulado anterior modula la evaluación de las consecuencias.44 Estos circuitos están modulados por aportes dopaminérgicos del VTA [área tegmental ventral] para, en última instancia, guiar las conductas relevantes para la adicción, incluida la persistencia y la reducción del repertorio conductual hacia la búsqueda de drogas y el uso continuo de drogas a pesar de las consecuencias negativas.43–45
Los estudios han demostrado que los antojos se sustentan en la activación de los circuitos de recompensa y motivación (McBride et al., 2006, Wang et al., 2007, Wing et al., 2012, Goldman et al., 2013, Jansen et al. ., 2013 y Volkow et al., 2013). Según estos autores, las principales estructuras neurales implicadas son: el núcleo accumbens, el estriado dorsal, la corteza orbitofrontal, la corteza cingulada anterior, la corteza prefrontal dorsolateral (DLPFC), la amígdala, el hipocampo y la ínsula.
Los sustratos neuronales que subyacen a la percepción de recompensa y al fenómeno del refuerzo positivo son un conjunto de estructuras del prosencéfalo interconectadas llamadas vías de recompensa cerebral; estos incluyen el núcleo accumbens (NAc; el componente principal del cuerpo estriado ventral), el prosencéfalo basal (cuyos componentes se denominan amígdala extendida, como se analiza más adelante en este capítulo), el hipocampo, el hipotálamo y las regiones frontales de la corteza cerebral. Estas estructuras reciben una rica inervación dopaminérgica del área tegmental ventral (VTA) del mesencéfalo. Las drogas adictivas son gratificantes y reforzadoras porque actúan en las vías de recompensa del cerebro para mejorar la liberación de dopamina o los efectos de la dopamina en la NAc o estructuras relacionadas, o porque producen efectos similares a la dopamina. ... Algunos investigadores describen una macroestructura que se postula para integrar muchas de las funciones de este circuito como amígdala extendida. Se dice que la amígdala extendida comprende varias estructuras basales del prosencéfalo que comparten morfología, características inmunocitoquímicas y conectividad similares y que son muy adecuadas para mediar aspectos de la función de recompensa; estos incluyen el núcleo del lecho de la estría terminal, la amígdala medial central, la capa de la NAc y la sustancia innominada sublenticular.
Aquí, mostramos que las estimulaciones de opioides u orexinas en la corteza orbitofrontal y la ínsula mejoran causalmente las reacciones de "gusto" hedónico al dulzor y encontramos un tercer sitio cortical donde las mismas estimulaciones neuroquímicas reducen el impacto hedónico positivo.
Por lo tanto, tiene sentido que los verdaderos centros de placer en el cerebro (los directamente responsables de generar sensaciones placenteras) resulten estar dentro de algunas de las estructuras previamente identificadas como parte del circuito de recompensa. Uno de estos llamados puntos calientes hedónicos se encuentra en una subregión del núcleo accumbens llamada capa medial. Un segundo se encuentra dentro del pálido ventral, una estructura profundamente arraigada cerca de la base del prosencéfalo que recibe la mayoría de sus señales del núcleo accumbens. ...
Por otro lado, la euforia intensa es más difícil de conseguir que los placeres cotidianos. La razón puede ser que un fuerte aumento del placer –como el aumento de placer inducido químicamente que producimos en animales de laboratorio– parece requerir la activación de toda la red a la vez. La deserción de cualquier componente amortigua el efecto.
No está claro si el circuito del placer, y en particular el pálido ventral, funciona de la misma manera en los humanos.
Aquí analizo cómo los mecanismos mesocorticolímbicos generan el componente de motivación de la prominencia del incentivo. La prominencia de los incentivos toma el aprendizaje y la memoria pavlovianos como un insumo y, como insumo igualmente importante, toma los factores del estado neurobiológico (por ejemplo, estados de drogas, estados de apetito, estados de saciedad) que pueden variar independientemente del aprendizaje. Los cambios en el estado neurobiológico pueden producir fluctuaciones no aprendidas o incluso reversiones en la capacidad de una señal de recompensa previamente aprendida para desencadenar la motivación. Tales fluctuaciones en la motivación desencadenada por señales pueden apartarse dramáticamente de todos los valores previamente aprendidos sobre el resultado de recompensa asociado. ... El aprendizaje asociativo y la predicción contribuyen de manera importante a la motivación para obtener recompensas. El aprendizaje otorga valor de incentivo a señales arbitrarias, como un estímulo condicionado pavloviano (EC) que está asociado con una recompensa (estímulo incondicionado o UCS). Las señales aprendidas de recompensa suelen ser potentes desencadenantes de deseos. Por ejemplo, las señales aprendidas pueden desencadenar apetitos normales en todas las personas y, en ocasiones, pueden desencadenar impulsos compulsivos y recaídas en los adictos.
'Deseo' desencadenado por una señal para el UCS
Un breve encuentro con el CS (o un breve encuentro con el UCS) a menudo genera un pulso de motivación elevada para obtener y consumir más UCS de recompensa. Ésta es una característica distintiva de la prominencia de los incentivos.
Señales como atractivos imanes motivacionales
Cuando a un CS+ pavloviano se le atribuye prominencia de incentivos, no sólo desencadena el "deseo" de su UCS, sino que a menudo la señal en sí misma se vuelve muy atractiva, incluso en un grado irracional. Esta atracción de señales es otra característica distintiva de la prominencia de incentivos... A menudo son visibles dos características reconocibles de la prominencia de incentivos que pueden usarse en experimentos de neurociencia: (i) "deseo" dirigido por UCS: pulsos de "deseo" intensificado desencadenados por CS la recompensa UCS; y (ii) 'deseo' dirigido por la CS: atracción motivada hacia la señal pavloviana, que convierte el estímulo arbitrario de la CS en un imán motivacional.
Las neuronas VTA DA desempeñan un papel fundamental en la motivación, el comportamiento relacionado con la recompensa (Capítulo 15), la atención y múltiples formas de memoria. Esta organización del sistema DA, con una amplia proyección desde un número limitado de cuerpos celulares, permite respuestas coordinadas a nuevas y potentes recompensas. Así, actuando en diversos campos terminales, la dopamina confiere prominencia motivacional ("deseo") a la recompensa misma o a las señales asociadas (región de la capa del núcleo accumbens), actualiza el valor otorgado a diferentes objetivos a la luz de esta nueva experiencia (corteza prefrontal orbital), ayuda a consolidar múltiples formas de memoria (amígdala e hipocampo), y codifica nuevos programas motores que facilitarán la obtención de esta recompensa en el futuro (núcleo accumbens, región central y estriado dorsal). En este ejemplo, la dopamina modula el procesamiento de información sensoriomotora en diversos circuitos neuronales para maximizar la capacidad del organismo para obtener recompensas futuras. ...
El circuito de recompensa cerebral al que se dirigen las drogas adictivas normalmente media el placer y el fortalecimiento de las conductas asociadas con los reforzadores naturales, como la comida, el agua y el contacto sexual. Las neuronas de dopamina en el VTA se activan con la comida y el agua, y la liberación de dopamina en la NAc se estimula con la presencia de reforzadores naturales, como la comida, el agua o una pareja sexual. ...
NAc y VTA son componentes centrales del circuito subyacente a la recompensa y la memoria de la recompensa. Como se mencionó anteriormente, la actividad de las neuronas dopaminérgicas en el VTA parece estar relacionada con la predicción de la recompensa. La NAc participa en el aprendizaje asociado al refuerzo y la modulación de respuestas motoras ante estímulos que satisfacen necesidades homeostáticas internas. La capa de NAc parece ser particularmente importante para las acciones iniciales de los fármacos dentro del circuito de recompensa; Las drogas adictivas parecen tener un mayor efecto sobre la liberación de dopamina en la cáscara que en el núcleo de la NAc.
Por ejemplo, la dopamina mesolímbica, probablemente el candidato a neurotransmisor cerebral más popular para el placer hace dos décadas, resulta no causar placer ni agrado en absoluto. Más bien, la dopamina media de manera más selectiva un proceso motivacional de prominencia de incentivos, que es un mecanismo para desear recompensas pero no para que nos gusten... Más bien, la estimulación con opioides tiene la capacidad especial de aumentar el gusto sólo si la estimulación ocurre dentro de un punto anatómico crítico.
Es importante destacar que encontramos evidencia de una mayor actividad en la vía directa; Tanto los cambios intracelulares en la expresión del marcador de plasticidad pERK como las proporciones AMPA/NMDA evocados por la estimulación de aferentes corticales aumentaron en las neuronas de la vía directa D1. Por el contrario, las neuronas D2 mostraron un cambio opuesto en la plasticidad; la estimulación de las aferencias corticales redujo las proporciones AMPA/NMDA en esas neuronas (Shan et al., 2014).
La fuerte correlación entre la exposición crónica a las drogas y ΔFosB brinda nuevas oportunidades para terapias dirigidas en adicciones (118) y sugiere métodos para analizar su eficacia (119). Durante las últimas dos décadas, la investigación ha avanzado desde la identificación de la inducción de ΔFosB hasta la investigación de su acción posterior (38). Es probable que la investigación sobre ΔFosB avance hacia una nueva era: el uso de ΔFosB como biomarcador. ...
Conclusiones
ΔFosB es un factor de transcripción esencial implicado en las vías moleculares y conductuales de la adicción tras la exposición repetida a drogas. Se comprende bien la formación de ΔFosB en múltiples regiones del cerebro y la vía molecular que conduce a la formación de complejos AP-1. El establecimiento de un propósito funcional para ΔFosB ha permitido una mayor determinación de algunos de los aspectos clave de sus cascadas moleculares, que involucran efectores como GluR2 (87,88), Cdk5 (93) y NFkB (100). Además, muchos de estos cambios moleculares identificados ahora están directamente relacionados con los cambios estructurales, fisiológicos y de comportamiento observados después de la exposición crónica a las drogas (60,95,97,102). Los estudios epigenéticos han abierto nuevas fronteras en la investigación de las funciones moleculares de ΔFosB, y los avances recientes han ilustrado el papel de ΔFosB que actúa sobre el ADN y las histonas, verdaderamente como un
interruptor molecular
(34). Como consecuencia de nuestra mejor comprensión de ΔFosB en la adicción, es posible evaluar el potencial adictivo de los medicamentos actuales (119), así como utilizarlo como biomarcador para evaluar la eficacia de las intervenciones terapéuticas (121,122,124). Algunas de estas intervenciones propuestas tienen limitaciones (125) o están en su infancia (75). Sin embargo, se espera que algunos de estos hallazgos preliminares puedan conducir a tratamientos innovadores, muy necesarios en la adicción.
Los estudios de neuroimagen funcional en humanos han demostrado que el juego (Breiter et al, 2001), las compras (Knutson et al, 2007), el orgasmo (
Komisaruk
et al, 2004), los videojuegos (Koepp et al, 1998; Hoeft et al, 2008) y la vista de comida apetitosa (Wang et al, 2004a) activan muchas de las mismas regiones del cerebro (es decir, el sistema mesocorticolímbico y la amígdala extendida) que las drogas de abuso (Volkow et al, 2004). ... La sensibilización cruzada también es bidireccional, ya que un historial de administración de anfetaminas facilita el comportamiento sexual y mejora el aumento asociado de NAc DA ... Como se describe para la recompensa alimentaria, la experiencia sexual también puede conducir a la activación de cascadas de señalización relacionadas con la plasticidad. El factor de transcripción delta FosB aumenta en NAc, PFC, estriado dorsal y VTA después de un comportamiento sexual repetido (Wallace et al., 2008; Pitchers et al., 2010b). Este aumento natural en delta FosB o sobreexpresión viral de delta FosB dentro de NAc modula el desempeño sexual, y el bloqueo de NAc de delta FosB atenúa este comportamiento (Hedges et al, 2009; Pitchers et al., 2010b). Además, la sobreexpresión viral de delta FosB mejora la preferencia de lugar condicionada por un entorno combinado con la experiencia sexual (Hedges et al., 2009). ... En algunas personas, hay una transición de lo "normal" a la participación compulsiva en recompensas naturales (como la comida o el sexo), una condición que algunos han denominado adicciones conductuales o no adictivas (Holden, 2001; Grant et al. , 2006a). ... En los seres humanos, el papel de la señalización de la dopamina en los procesos de sensibilización a incentivos se ha puesto de relieve recientemente mediante la observación de un síndrome de desregulación de la dopamina en algunos pacientes que toman fármacos dopaminérgicos. Este síndrome se caracteriza por un aumento inducido por la medicación (o compulsivo) en la participación en recompensas no relacionadas con las drogas, como el juego, las compras o el sexo (Evans et al, 2006; Aiken, 2007; Lader, 2008)."
Por estos motivos, ΔFosB se considera un factor de transcripción primario y causante en la creación de nuevas conexiones neuronales en el centro de recompensa, la corteza prefrontal y otras regiones del sistema límbico. Esto se refleja en el nivel aumentado, estable y duradero de sensibilidad a la cocaína y otras drogas, y en la tendencia a recaer incluso después de largos períodos de abstinencia. Estas redes recién construidas funcionan de manera muy eficiente a través de nuevas vías tan pronto como se siguen consumiendo drogas... De esta manera, la inducción de la expresión del gen CDK5 ocurre junto con la supresión del gen G9A que codifica la dimetiltransferasa que actúa sobre la histona H3. Se puede observar un mecanismo de retroalimentación en la regulación de estos 2 factores cruciales que determinan la respuesta epigenética adaptativa a la cocaína. Esto depende de que ΔFosB inhiba la expresión del gen G9a, es decir, la síntesis de H3K9me2, que a su vez inhibe los factores de transcripción de ΔFosB. Por este motivo, la hiperexpresión observada de G9a, que asegura niveles elevados de la forma dimetilada de la histona H3, elimina los efectos estructurales y de plasticidad neuronal provocados por la cocaína mediante esta retroalimentación que bloquea la transcripción de ΔFosB.
Las drogas de abuso inducen neuroplasticidad en la vía de recompensa natural, específicamente en el núcleo accumbens (NAc), lo que provoca el desarrollo y la expresión de conductas adictivas. ... En conjunto, estos hallazgos demuestran que las drogas de abuso y las conductas de recompensa natural actúan sobre mecanismos moleculares y celulares comunes de plasticidad que controlan la vulnerabilidad a la adicción a las drogas, y que esta mayor vulnerabilidad está mediada por ΔFosB y sus objetivos transcripcionales posteriores. ... El comportamiento sexual es muy gratificante (Tenk et al., 2009), y la experiencia sexual provoca comportamientos sensibilizados relacionados con las drogas, incluida la sensibilización cruzada a la actividad locomotora inducida por anfetamina (Amph) (Bradley y Meisel, 2001; Pitchers et al. ., 2010a) y recompensa Amph mejorada (Pitchers et al., 2010a). Además, la experiencia sexual induce una plasticidad neuronal en la NAc similar a la inducida por la exposición a psicoestimulantes, incluido un aumento de la densidad de la columna dendrítica (Meisel y Mullins, 2006; Pitchers et al., 2010a), un tráfico alterado del receptor de glutamato y una disminución de la fuerza sináptica en la corteza prefrontal. -Neuronas de capa de NAc que responden (Pitchers et al., 2012). Finalmente, se descubrió que los períodos de abstinencia de la experiencia sexual eran críticos para mejorar la recompensa de Amph, la espinogénesis de NAc (Pitchers et al., 2010a) y el tráfico de receptores de glutamato (Pitchers et al., 2012). Estos hallazgos sugieren que las experiencias de recompensa naturales y farmacológicas comparten mecanismos comunes de plasticidad neuronal.
ΔFosB sirve como una de las proteínas de control maestro que gobiernan esta plasticidad estructural. ... ΔFosB también reprime la expresión de G9a, lo que lleva a una reducción de la metilación represiva de histonas en el gen cdk5. El resultado neto es la activación genética y el aumento de la expresión de CDK5. ... Por el contrario, ΔFosB se une al gen
c-fos
y recluta varios correpresores, incluidos HDAC1 (histona desacetilasa 1) y SIRT 1 (sirtuina 1). ... El resultado neto es la represión del gen
c-fos
.
{{cite book}}: |journal=ignorado ( ayuda )En una literatura relativamente reciente, los estudios sobre motivación y refuerzo en la depresión han sido en gran medida consistentes en la detección de diferencias en comparación con controles sanos (Whitton et al. 2015). En varios estudios que utilizaron la tarea de gasto de esfuerzo para recompensa (EEfRT), los pacientes con TDM dedicaron menos esfuerzo para obtener recompensas en comparación con los controles (Treadway et al. 2012; Yang et al. 2014).
{{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )También proporcionan una evaluación separada de la anhedonia consumatoria (experiencia reducida de placer derivada de actividades placenteras en curso) y la anhedonia anticipatoria (capacidad reducida para anticipar placer futuro). De hecho, el primero parece estar relativamente intacto en la esquizofrenia, mientras que el segundo parece estar deteriorado [32 – 34]. Sin embargo, también se han informado datos discrepantes [35].
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ) Escuchar música placentera suele ir acompañado de reacciones corporales mensurables, como piel de gallina o escalofríos que bajan por la columna, comúnmente llamados "escalofríos" o "escalofríos". ... En general, nuestros resultados revelaron claramente que las intervenciones farmacológicas modulaban bidireccionalmente las respuestas de recompensa provocadas por la música. En particular, encontramos que la risperidona perjudicaba la capacidad de los participantes para experimentar placer musical, mientras que la levodopa la mejoraba. ... Aquí, por el contrario, al estudiar las respuestas a recompensas abstractas en sujetos humanos, mostramos que la manipulación de la transmisión dopaminérgica afecta tanto el placer (es decir, la cantidad de tiempo que se pasa informando escalofríos y la excitación emocional medida por EDA) como los componentes motivacionales de la recompensa musical. (dinero dispuesto a gastar). Estos hallazgos sugieren que la señalización dopaminérgica es una condición sine qua non no sólo para las respuestas motivacionales, como se ha demostrado con las recompensas primarias y secundarias, sino también para las reacciones hedónicas a la música. Este resultado respalda hallazgos recientes que muestran que la dopamina también media el placer percibido alcanzado por otros tipos de recompensas abstractas y desafía hallazgos previos en modelos animales sobre recompensas primarias, como la comida.
En un estudio farmacológico publicado en PNAS, Ferreri et al. (1) presentan evidencia de que mejorar o inhibir la señalización de dopamina usando levodopa o risperidona modula el placer experimentado al escuchar música. ... En una salva final para establecer no sólo la implicación correlacional sino también causal de la dopamina en el placer musical, los autores han recurrido a la manipulación directa de la señalización dopaminérgica en el cuerpo estriado, primero aplicando estimulación magnética transcraneal excitadora e inhibidora sobre los participantes. corteza prefrontal dorsolateral izquierda, una región conocida por modular la función estriatal (5), y finalmente, en el presente estudio, mediante la administración de agentes farmacéuticos capaces de alterar la disponibilidad sináptica de dopamina (1), los cuales influyeron en el placer percibido, las medidas fisiológicas de excitación, y el valor monetario asignado a la música en la dirección prevista. ... Si bien la cuestión de la expresión musical de la emoción tiene una larga historia de investigación, incluso en PNAS (6), y la línea de investigación psicofisiológica de la década de 1990 ya había establecido que el placer musical podría activar el sistema nervioso autónomo (7), el La demostración de los autores de la implicación del sistema de recompensa en las emociones musicales se tomó como prueba inaugural de que se trataba de emociones verídicas cuyo estudio tiene plena legitimidad para informar la neurobiología de nuestras funciones cognitivas, sociales y afectivas cotidianas (8). Por cierto, esta línea de trabajo, que culmina con el artículo de Ferreri et al. (1), es plausible que haya hecho más que cualquier otro en esta comunidad para atraer financiación para la investigación en el campo de las ciencias de la música. La evidencia de Ferreri et al. (1) proporciona el último apoyo a un modelo neurobiológico convincente en el que el placer musical surge de la interacción de antiguos sistemas de recompensa/valoración (estriado-límbico-paralímbico) con sistemas de percepción/predicciones filogenéticamente más avanzados (temporofrontal).