
La genética mitocondrial humana es el estudio de la genética del ADN mitocondrial humano (el ADN contenido en las mitocondrias humanas ). El genoma mitocondrial humano es la totalidad de la información hereditaria contenida en las mitocondrias humanas. Las mitocondrias son pequeñas estructuras en las células que generan energía para que la célula la utilice, por lo que se las conoce como las "centrales energéticas" de la célula.
El ADN mitocondrial (ADNmt) no se transmite a través del ADN nuclear (ADNn). En los seres humanos, como en la mayoría de los organismos multicelulares, el ADN mitocondrial se hereda únicamente del óvulo de la madre . Sin embargo, existen teorías de que la transmisión del ADNmt paterno en los seres humanos puede ocurrir en determinadas circunstancias. [3] Por lo tanto, la herencia mitocondrial no es mendeliana , ya que la herencia mendeliana presupone que la mitad del material genético de un óvulo fertilizado ( cigoto ) deriva de cada progenitor.
Esto permitió la creación de haplogrupos de ADN mitocondrial para estudiar la genética de poblaciones .
El ochenta por ciento del ADN mitocondrial codifica el ARN mitocondrial y, por lo tanto, la mayoría de las mutaciones del ADN mitocondrial conducen a problemas funcionales, que pueden manifestarse como trastornos musculares ( miopatías ).
Las mitocondrias son esenciales para todos los organismos superiores, ya que proporcionan 30 moléculas de ATP por molécula de glucosa, en contraste con las 2 moléculas de ATP producidas por la glucólisis . Las enfermedades mitocondriales son trastornos genéticos que se encuentran en el ADN mitocondrial, o ADN nuclear que codifica los componentes mitocondriales. Pequeños problemas con cualquiera de las numerosas enzimas que utilizan las mitocondrias pueden ser devastadores para la célula y, a su vez, para el organismo.
En los seres humanos, el ADN mitocondrial (ADNmt) forma moléculas circulares cerradas que contienen 16.569 [4] [5] pares de bases de ADN , [6] y cada una de estas moléculas contiene normalmente un conjunto completo de genes mitocondriales. Cada mitocondria humana contiene, en promedio, aproximadamente 5 moléculas de ADNmt, con una cantidad que varía entre 1 y 15. [6] Cada célula humana contiene aproximadamente 100 mitocondrias, lo que da un número total de moléculas de ADNmt por célula humana de aproximadamente 500. [6] La cantidad de mitocondrias por célula también varía según el tipo de célula, y algunos ejemplos son:
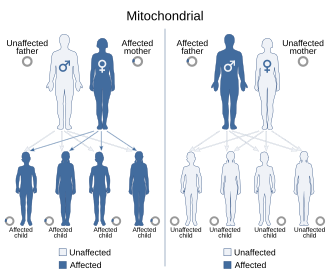

Debido a que las enfermedades mitocondriales (enfermedades debidas al mal funcionamiento de las mitocondrias) pueden heredarse tanto por vía materna como a través de la herencia cromosómica, la forma en que se transmiten de generación en generación puede variar mucho dependiendo de la enfermedad. Las mutaciones genéticas mitocondriales que ocurren en el ADN nuclear pueden ocurrir en cualquiera de los cromosomas (dependiendo de la especie). Las mutaciones heredadas a través de los cromosomas pueden ser autosómicas dominantes o recesivas y también pueden ser dominantes o recesivas ligadas al sexo. La herencia cromosómica sigue las leyes mendelianas normales , a pesar de que el fenotipo de la enfermedad pueda estar enmascarado.
Debido a las complejas formas en que el ADN mitocondrial y nuclear se "comunica" e interactúa, incluso una herencia aparentemente simple es difícil de diagnosticar. Una mutación en el ADN cromosómico puede cambiar una proteína que regula (aumenta o disminuye) la producción de otra proteína determinada en las mitocondrias o el citoplasma; esto puede provocar síntomas leves o notorios. Por otro lado, algunas mutaciones devastadoras del ADNmt son fáciles de diagnosticar debido a su daño generalizado a los tejidos musculares, neuronales y/o hepáticos (entre otros tejidos de alta energía y dependientes del metabolismo) y porque están presentes en la madre y en toda la descendencia.
La cantidad de moléculas de ADNmt afectadas heredadas por una descendencia específica puede variar en gran medida porque
Es posible, incluso en los nacimientos de gemelos, que un bebé reciba más de la mitad de las moléculas de ADNmt mutante mientras que el otro gemelo puede recibir solo una pequeña fracción de las moléculas de ADNmt mutante con respecto al tipo salvaje (dependiendo de cómo se dividan los gemelos entre sí y de cuántas mitocondrias mutantes haya en cada lado de la división). En unos pocos casos, algunas mitocondrias o una mitocondria del espermatozoide ingresan al ovocito, pero las mitocondrias paternas se descomponen activamente.
Los genes del genoma mitocondrial humano son los siguientes.
En un principio se creía erróneamente que el genoma mitocondrial contenía sólo 13 genes codificadores de proteínas, todos ellos codificadores de proteínas de la cadena de transporte de electrones . Sin embargo, en 2001 se descubrió una decimocuarta proteína biológicamente activa, llamada humanina , que se encontró que estaba codificada por el gen mitocondrial MT-RNR2 , que también codifica parte del ribosoma mitocondrial (compuesto de ARN):
A diferencia de las demás proteínas, la humanina no permanece en la mitocondria, sino que interactúa con el resto de la célula y los receptores celulares. La humanina puede proteger las células cerebrales inhibiendo la apoptosis . A pesar de su nombre, también existen versiones de la humanina en otros animales, como la rattina en ratas.
Los siguientes genes codifican ARNr :
Los siguientes genes codifican ARNt :
Tradicionalmente, las dos hebras del ADN mitocondrial se denominaban hebras pesadas y ligeras debido a sus densidades flotantes durante la separación en gradientes de cloruro de cesio, [8] [9] lo que se encontró que estaba relacionado con el contenido relativo de nucleótidos G+T de la hebra. [10] Sin embargo, la confusión en el etiquetado de estas hebras está muy extendida y parece tener su origen en la identificación de la hebra codificante mayoritaria como la pesada en un influyente artículo de 1999. [11] [10] En los seres humanos, la hebra ligera del ADNmt lleva 28 genes y la hebra pesada del ADNmt lleva solo 9 genes. [10] [12] Ocho de los 9 genes de la hebra pesada codifican moléculas de ARNt mitocondrial. El ADNmt humano consta de 16.569 pares de nucleótidos. La molécula entera está regulada por una sola región reguladora que contiene los orígenes de replicación de las hebras pesada y ligera. Se ha mapeado toda la molécula de ADN mitocondrial humano [1] [2] .
El código genético es, en su mayor parte, universal, con pocas excepciones: [13] la genética mitocondrial incluye algunos de ellos. Para la mayoría de los organismos, los " codones de terminación " son "UAA", "UAG" y "UGA". En las mitocondrias de vertebrados, "AGA" y "AGG" también son codones de terminación, pero no "UGA", que codifica para el triptófano . "AUA" codifica para la isoleucina en la mayoría de los organismos, pero para la metionina en el ARNm mitocondrial de vertebrados.
Existen muchas otras variaciones entre los códigos utilizados por otros ARNm/t mitocondriales que no resultaron perjudiciales para sus organismos y que pueden utilizarse como herramienta (junto con otras mutaciones entre el ADNmt/ARN de diferentes especies) para determinar la proximidad relativa de la ascendencia común de especies relacionadas. (Cuanto más relacionadas estén dos especies, más mutaciones del ADNmt/ARN serán iguales en su genoma mitocondrial).
Utilizando estas técnicas, se estima que las primeras mitocondrias surgieron hace unos 1.500 millones de años. Una hipótesis generalmente aceptada es que las mitocondrias se originaron como un procariota aeróbico en una relación simbiótica dentro de un eucariota anaeróbico .
La replicación mitocondrial está controlada por genes nucleares y está específicamente diseñada para producir tantas mitocondrias como esa célula particular necesita en ese momento.
La transcripción mitocondrial en humanos se inicia a partir de tres promotores , H1, H2 y L (promotores de la cadena pesada 1, la cadena pesada 2 y la cadena ligera). El promotor H2 transcribe casi toda la cadena pesada y el promotor L transcribe toda la cadena ligera. El promotor H1 provoca la transcripción de las dos moléculas de ARNr mitocondriales. [14]
Cuando la transcripción tiene lugar en la cadena pesada, se crea un transcrito policistrónico. La cadena ligera produce transcripciones pequeñas, que se pueden utilizar como cebadores , o una transcripción larga. La producción de cebadores se produce mediante el procesamiento de las transcripciones de la cadena ligera con la ARNasa mitocondrial MRP (procesamiento del ARN mitocondrial). El requisito de la transcripción para producir cebadores vincula el proceso de transcripción con la replicación del ADNmt. Las transcripciones de longitud completa se cortan en moléculas funcionales de ARNt, ARNr y ARNm. [ cita requerida ]
El proceso de iniciación de la transcripción en las mitocondrias involucra tres tipos de proteínas: la ARN polimerasa mitocondrial ( POLRMT ), el factor de transcripción mitocondrial A (TFAM) y los factores de transcripción mitocondrial B1 y B2 (TFB1M, TFB2M). POLRMT , TFAM y TFB1M o TFB2M se ensamblan en los promotores mitocondriales y comienzan la transcripción. Los eventos moleculares reales que están involucrados en la iniciación son desconocidos, pero estos factores conforman la maquinaria de transcripción basal y se ha demostrado que funcionan in vitro. [ cita requerida ]
La traducción mitocondrial aún no se comprende muy bien. Las traducciones in vitro aún no han tenido éxito, probablemente debido a la dificultad de aislar suficiente ARNm mt, ARNr mt funcional y posiblemente debido a los cambios complicados que sufre el ARNm antes de ser traducido. [ cita requerida ]
La ADN polimerasa mitocondrial (Pol gamma, codificada por el gen POLG ) se utiliza en la copia del ADNmt durante la replicación. Debido a que las dos hebras ( pesada y ligera ) de la molécula circular de ADNmt tienen diferentes orígenes de replicación , se replica en un modo de bucle D. Una hebra comienza a replicarse primero, desplazando a la otra hebra. Esto continúa hasta que la replicación alcanza el origen de replicación en la otra hebra, momento en el que la otra hebra comienza a replicarse en la dirección opuesta. Esto da como resultado dos nuevas moléculas de ADNmt. Cada mitocondria tiene varias copias de la molécula de ADNmt y el número de moléculas de ADNmt es un factor limitante en la fisión mitocondrial . Una vez que la mitocondria tiene suficiente ADNmt, área de membrana y proteínas de membrana, puede sufrir una fisión (muy similar a la que utilizan las bacterias) para convertirse en dos mitocondrias. La evidencia sugiere que las mitocondrias también pueden fusionarse e intercambiar (en una forma de cruce ) material genético entre sí. Las mitocondrias a veces forman grandes matrices en las que se producen constantemente fusiones , fisiones e intercambios de proteínas. El ADNmt se comparte entre mitocondrias (a pesar de que pueden fusionarse). [ cita requerida ]
El ADN mitocondrial es susceptible a sufrir daños por parte de los radicales libres de oxígeno debido a errores que se producen durante la producción de ATP a través de la cadena de transporte de electrones. Estos errores pueden ser causados por trastornos genéticos, cáncer y variaciones de temperatura. Estos radicales pueden dañar las moléculas de ADNmt o cambiarlas, dificultando que la polimerasa mitocondrial las replique. Ambos casos pueden provocar deleciones, reordenamientos y otras mutaciones. Evidencias recientes han sugerido que las mitocondrias tienen enzimas que corrigen el ADNmt y corrigen las mutaciones que pueden producirse debido a los radicales libres. Se cree que una recombinasa de ADN que se encuentra en las células de los mamíferos también está involucrada en un proceso de recombinación reparadora. Las deleciones y mutaciones debidas a los radicales libres se han asociado con el proceso de envejecimiento. Se cree que los radicales causan mutaciones que conducen a proteínas mutantes, que a su vez conducen a más radicales. Este proceso lleva muchos años y está asociado con algunos procesos de envejecimiento involucrados en tejidos dependientes del oxígeno, como el cerebro, el corazón, los músculos y los riñones. Procesos de automejora como estos son posibles causas de enfermedades degenerativas, incluidas la enfermedad de Parkinson , la enfermedad de Alzheimer y la enfermedad de las arterias coronarias . [ cita requerida ]
Dado que el crecimiento y la fisión mitocondriales están mediados por el ADN nuclear, las mutaciones en el ADN nuclear pueden tener una amplia gama de efectos sobre la replicación del ADNmt. A pesar de que se han encontrado los loci de algunas de estas mutaciones en los cromosomas humanos, aún no se han aislado los genes y las proteínas específicas implicadas. Las mitocondrias necesitan una proteína determinada para experimentar la fisión. Si esta proteína (generada por el núcleo) no está presente, las mitocondrias crecen pero no se dividen. Esto da lugar a mitocondrias gigantes e ineficientes. Los errores en los genes cromosómicos o sus productos también pueden afectar a la replicación mitocondrial de forma más directa al inhibir la polimerasa mitocondrial e incluso pueden causar mutaciones en el ADNmt de forma directa e indirecta. Las mutaciones indirectas suelen estar causadas por radicales creados por proteínas defectuosas fabricadas a partir del ADN nuclear. [ cita requerida ]
En total, la mitocondria alberga alrededor de 3000 tipos diferentes de proteínas, pero solo unas 13 de ellas están codificadas en el ADN mitocondrial. La mayoría de los 3000 tipos de proteínas participan en diversos procesos distintos de la producción de ATP, como la síntesis de porfirinas . Solo alrededor del 3% de ellas codifican proteínas productoras de ATP. Esto significa que la mayor parte de la información genética que codifica la composición proteica de las mitocondrias se encuentra en el ADN cromosómico y participa en procesos distintos de la síntesis de ATP. Esto aumenta las probabilidades de que una mutación que afecte a una mitocondria se produzca en el ADN cromosómico, que se hereda según un patrón mendeliano. Otro resultado es que una mutación cromosómica afectará a un tejido específico debido a sus necesidades específicas, ya sean requisitos de alta energía o una necesidad de catabolismo o anabolismo de un neurotransmisor o ácido nucleico específico. Dado que cada mitocondria lleva varias copias del genoma mitocondrial (2 a 10 en los humanos), las mutaciones mitocondriales pueden heredarse de forma materna a través de mutaciones del ADNmt que están presentes en las mitocondrias dentro del ovocito antes de la fertilización o (como se indicó anteriormente) a través de mutaciones en los cromosomas. [ cita requerida ]
Las enfermedades mitocondriales varían en gravedad desde asintomáticas hasta fatales, y se deben más comúnmente a mutaciones hereditarias en lugar de adquiridas del ADN mitocondrial. Una mutación mitocondrial dada puede causar varias enfermedades dependiendo de la gravedad del problema en las mitocondrias y el tejido en el que se encuentran las mitocondrias afectadas. Por el contrario, varias mutaciones diferentes pueden presentarse como la misma enfermedad. Esta caracterización casi específica del paciente de las enfermedades mitocondriales (ver Medicina personalizada ) hace que sea muy difícil reconocerlas, diagnosticarlas y rastrearlas con precisión. Algunas enfermedades son observables en el nacimiento o incluso antes (muchas causan la muerte), mientras que otras no se manifiestan hasta la adultez tardía (trastornos de aparición tardía). Esto se debe a que el número de mitocondrias mutantes frente a las de tipo salvaje varía entre las células y los tejidos, y cambia continuamente. Debido a que las células tienen múltiples mitocondrias, diferentes mitocondrias en la misma célula pueden tener diferentes variaciones del ADNmt . Esta condición se conoce como heteroplasmia . Cuando un determinado tejido alcanza una determinada proporción de mitocondrias mutantes frente a mitocondrias de tipo salvaje, se presenta una enfermedad. La proporción varía de persona a persona y de tejido a tejido (dependiendo de sus necesidades específicas de energía, oxígeno y metabolismo, y de los efectos de la mutación específica). Las enfermedades mitocondriales son muy numerosas y diferentes. Aparte de las enfermedades causadas por anomalías en el ADN mitocondrial, se sospecha que muchas enfermedades están asociadas en parte a disfunciones mitocondriales, como la diabetes mellitus , [15] formas de cáncer [16] y enfermedades cardiovasculares , acidosis láctica , [17] formas específicas de miopatía , [18] osteoporosis , [19] enfermedad de Alzheimer , [20] enfermedad de Parkinson , [21] accidente cerebrovascular , [22] infertilidad masculina [23] y que también se cree que desempeñan un papel en el proceso de envejecimiento . [24]
El ADNmt humano también se puede utilizar para ayudar a identificar individuos. [25] Los laboratorios forenses ocasionalmente utilizan la comparación de ADNmt para identificar restos humanos, y especialmente para identificar restos óseos más antiguos no identificados. Aunque a diferencia del ADN nuclear, el ADNmt no es específico de un individuo, se puede utilizar en combinación con otra evidencia (evidencia antropológica, evidencia circunstancial y similares) para establecer la identificación. El ADNmt también se utiliza para excluir posibles coincidencias entre personas desaparecidas y restos no identificados. [26] Muchos investigadores creen que el ADNmt es más adecuado para la identificación de restos óseos más antiguos que el ADN nuclear porque el mayor número de copias de ADNmt por célula aumenta la posibilidad de obtener una muestra útil, y porque una coincidencia con un pariente vivo es posible incluso si numerosas generaciones maternas separan a los dos.
Los restos del delincuente estadounidense Jesse James fueron identificados mediante una comparación entre el ADNmt extraído de sus restos y el ADNmt del hijo de la bisnieta de su hermana por línea femenina. [27]
De manera similar, los restos de Alexandra Feodorovna (Alix de Hesse) , última emperatriz de Rusia, y sus hijos fueron identificados mediante la comparación de su ADN mitocondrial con el del príncipe Felipe, duque de Edimburgo , cuya abuela materna era la hermana de Alexandra, Victoria de Hesse . [28]
De manera similar, para identificar los restos del emperador Nicolás II, se comparó su ADN mitocondrial con el de James Carnegie, tercer duque de Fife , cuya bisabuela materna, Alejandra de Dinamarca (reina Alejandra), era hermana de la madre de Nicolás II , Dagmar de Dinamarca (emperatriz María Feodorovna). [28] [29]
Del mismo modo se identificaron los restos del rey Ricardo III . [30]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) {{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) {{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )