La fosfoglucomutasa ( EC 5.4.2.2) es una enzima que transfiere un grupo fosfato en un monómero de α-D- glucosa de la posición 1 a la 6 en dirección hacia adelante o de la posición 6 a 1 en dirección inversa.
Más precisamente, facilita la interconversión de glucosa 1-fosfato y glucosa 6-fosfato .
Después de que la glucógeno fosforilasa cataliza la escisión fosforolítica de un residuo de glucosilo del polímero de glucógeno , la glucosa liberada tiene un grupo fosfato en su carbono 1. Esta molécula de glucosa 1-fosfato no es en sí misma un intermediario metabólico útil, pero la fosfoglucomutasa cataliza la conversión de esta glucosa 1-fosfato en glucosa 6-fosfato (consulte más adelante el mecanismo de esta reacción).
El destino metabólico de la glucosa 6-fosfato depende de las necesidades de la célula en el momento en que se genera. Si la célula tiene poca energía, entonces la glucosa 6-fosfato viajará por la vía glucolítica , produciendo eventualmente dos moléculas de trifosfato de adenosina . Si la célula necesita intermediarios biosintéticos, la glucosa 6-fosfato entrará en la vía de las pentosas fosfato , donde sufrirá una serie de reacciones para producir ribosas y/o NADPH , dependiendo de las condiciones celulares.
Si la glucogenólisis tiene lugar en el hígado, la glucosa 6-fosfato puede convertirse en glucosa mediante la enzima glucosa 6-fosfatasa ; La glucosa producida en el hígado luego se libera al torrente sanguíneo para su uso en otros órganos. Las células musculares, por el contrario, no tienen la enzima glucosa 6-fosfatasa, por lo que no pueden compartir sus reservas de glucógeno con el resto del cuerpo.
La fosfoglucomutasa también actúa de manera opuesta cuando los niveles de glucosa en sangre son altos. En este caso, la fosfoglucomutasa cataliza la conversión de glucosa 6-fosfato (que se genera fácilmente a partir de glucosa por la acción de la hexoquinasa ) en glucosa 1-fosfato.
Esta glucosa-1-fosfato puede luego reaccionar con UTP para producir UDP-glucosa en una reacción catalizada por UDP-glucosa-pirofosforilasa . Si es activada por la insulina , la glucógeno sintasa procederá a recortar la glucosa del complejo UDP-glucosa en un polímero de glucógeno.
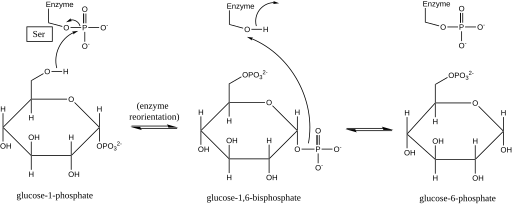
La fosfoglucomutasa afecta un cambio de grupo fosforilo al intercambiar un grupo fosforilo con el sustrato . [1] Los experimentos de etiquetado isotópico han confirmado que esta reacción se produce a través de un intermediario de glucosa 1,6-bisfosfato . [2]
El primer paso en la reacción directa es la transferencia de un grupo fosforilo de la enzima a la glucosa 1-fosfato, formando glucosa 1,6-bifosfato y dejando una forma desfosforilada de la enzima. [2] Luego, la enzima sufre una rápida reorientación por difusión para posicionar adecuadamente el 1-fosfato del intermedio bisfosfato en relación con la enzima desfosforilada. [3] Las relaciones sustrato-velocidad y las pruebas de transporte inducido han revelado que la enzima desfosforilada luego facilita la transferencia de un grupo fosforilo del intermediario glucosa-1,6-bifosfato a la enzima, regenerando la fosfoglucomutasa fosforilada y produciendo glucosa 6-fosfato (en la dirección de avance). [4] [5] Estudios estructurales posteriores confirmaron que el único sitio de la enzima que se fosforila y desfosforila es el oxígeno del residuo de serina del sitio activo (consulte el diagrama a continuación). [6] [7] Para la actividad enzimática se requiere un ion metálico bivalente , generalmente magnesio o cadmio , y se ha demostrado que forma complejo directamente con el grupo fosforilo esterificado con la serina del sitio activo. [8]
Esta formación de un intermedio de glucosa 1,6-bisfosfato es análoga a la interconversión de 2-fosfoglicerato y 3-fosfoglicerato catalizada por fosfoglicerato mutasa , en la que se genera 2,3-bisfosfoglicerato como intermedio. [9]

Si bien la fosfoglucomutasa del músculo de conejo ha servido como prototipo para gran parte del esclarecimiento de la estructura de esta enzima, las estructuras cristalinas derivadas de bacterias más nuevas exhiben muchas de las mismas características definitorias. [10] Cada monómero de fosfoglucomutasa se puede dividir en cuatro dominios de secuencia, I-IV, según la configuración espacial predeterminada de la enzima (ver imagen a la derecha). [11]
Cada monómero comprende cuatro unidades estructurales α/β distintas, cada una de las cuales contiene una de las cuatro hebras en la hoja β de cada monómero y está formada únicamente por los residuos en un dominio de secuencia determinado (ver imagen a la derecha). [11] El entierro del sitio activo (incluido Ser-116, el residuo crítico de la enzima que está fosforilada y desfosforilada) en el interior hidrofóbico de la enzima sirve para excluir que el agua hidrolice de manera contraproducente enlaces fosfoéster críticos y al mismo tiempo permita que el sustrato se acceder al sitio activo. [12]
El músculo humano contiene dos isoenzimas de fosfoglucomutasa con propiedades catalíticas casi idénticas, PGM I y PGM II. [13] Una u otra de estas formas falta congénitamente en algunos seres humanos. [14] La deficiencia de PGM1 se conoce como PGM1-CDG o síndrome CDG tipo 1t (CDG1T), anteriormente conocido como enfermedad de almacenamiento de glucógeno tipo 14 (GSD XIV). [15] [16] La enfermedad es a la vez una glucogenosis y un trastorno congénito de la glicosilación. [17] [18] También es una miopatía metabólica y un error innato del metabolismo de los carbohidratos . [19]
La deficiencia de PGM es una condición extremadamente rara que no presenta un conjunto de síntomas fisiológicos bien caracterizados. Esta condición puede detectarse mediante un estudio in vitro de glucólisis anaeróbica que revela un bloqueo en la vía hacia la producción de ácido láctico después de la glucosa 1-fosfato pero antes de la glucosa 6-fosfato. [20] Hay dos formas de PGM1-CDG: 1.) exclusivamente miogénica y 2.) multisistémica (incluidos los músculos). [dieciséis]
La vía habitual para la formación de glucógeno a partir de la glucosa en sangre está bloqueada, ya que sin fosfoglucomutasa, la glucosa-6-fosfato no puede convertirse en glucosa-1-fosfato. Sin embargo, una vía alternativa a partir de la galactosa puede formar glucógeno al convertir galactosa → galactosa-1-fosfato → glucosa-1-fosfato. Esto permite que se forme glucógeno, pero sin la fosfoglucomutasa, la glucosa-1-fosfato no puede convertirse en glucosa-6-fosfato para la glucólisis. Esto provoca una acumulación anormal de glucógeno en las células musculares, observable en la biopsia muscular. [16] [21]
Aunque el fenotipo y la gravedad de la enfermedad son muy variables, los síntomas comunes incluyen: intolerancia al ejercicio , hiperamonemia inducida por el ejercicio , acumulación anormal de glucógeno en la biopsia muscular, CK sérica elevada, transferrina sérica anormal (pérdida de N-glicanos completos), estatura baja, paladar hendido, úvula bífida y hepatopatía. [16] [21]
En algunos, pero no en todos, se puede observar un fenómeno de " segundo aliento " al medir la frecuencia cardíaca mientras se está en una cinta rodante. [16] [22] En reposo, las células musculares dependen de la glucosa en sangre y los ácidos grasos libres; Durante el esfuerzo, se necesita glucógeno muscular junto con glucosa en sangre y ácidos grasos libres. [23] [24] La dependencia del glucógeno muscular aumenta con el ejercicio aeróbico de mayor intensidad y con todo ejercicio anaeróbico. [23] [24]
Sin poder crear ATP a partir del glucógeno muscular almacenado, durante el ejercicio hay un reservorio bajo de ATP (ADP>ATP). En tales circunstancias, la frecuencia cardíaca y la respiración aumentan de manera inapropiada dada la intensidad del ejercicio, en un intento de maximizar el suministro de oxígeno y combustibles sanguíneos a las células musculares. Los ácidos grasos libres son el sistema bioenergético del cuerpo más lento en producir ATP mediante fosforilación oxidativa , aproximadamente en 10 minutos. [23] El alivio de los síntomas de intolerancia al ejercicio, incluida una caída en la frecuencia cardíaca de al menos 10 BPM mientras se va a la misma velocidad en la cinta, después de aproximadamente 10 minutos de ejercicio aeróbico se denomina " segundo aire ", donde se produce un aumento de ATP. a partir de ácidos grasos libres.
Otra consecuencia de una reserva baja de ATP (ADP>ATP) durante el ejercicio, debido a no poder producir ATP a partir del glucógeno muscular, es un mayor uso de la reacción de la mioquinasa (adenilato quinasa) y del ciclo de los nucleótidos de purina . La reacción de la mioquinasa produce AMP (2 ADP → ATP + AMP), y luego el ciclo de nucleótidos de purina usa AMP y produce más AMP junto con fumarato (el fumarato luego se convierte y produce ATP mediante fosforilación oxidativa). El amoníaco (NH 3 ) es un subproducto en el ciclo de los nucleótidos de purina cuando el AMP se convierte en IMP. Durante una prueba de antebrazo no isquémica, los individuos con PGM1-CDG muestran niveles elevados de amoníaco sérico (hiperamoniemia) inducidos por el ejercicio y un aumento normal del lactato sérico. [16] [18] [19]
Estudios en otras enfermedades que tienen un bloqueo glucolítico han demostrado durante pruebas de ejercicio de antebrazo isquémico y no isquémico, que no solo aumenta el amoníaco, sino que después del ejercicio también aumenta la inosina sérica, la hipoxantina y el ácido úrico. [25] [26] Estos estudios respaldaron que cuando se suspende el ejercicio o se produce suficiente ATP a partir de otros combustibles (como los ácidos grasos libres), entonces el depósito de ATP se normaliza y la acumulación de AMP y otros nucleótidos se convierte en nucleósidos y abandona el célula muscular se convierta en ácido úrico , lo que se conoce como hiperuricemia miógena. AMP → IMP → Inosina → Hipoxantina → Xantina → Ácido úrico. Desafortunadamente, los estudios sobre PGM1-CDG solo analizaron el amoníaco y el lactato en suero, por lo que actualmente se desconoce con certeza si los individuos con PGM1-CDG también experimentan hiperuricemia miógena. [16] [18] [19]