En mecánica estadística , una derivación semiclásica de la entropía que no tiene en cuenta la indistinguibilidad de las partículas produce una expresión para la entropía que no es extensiva (no es proporcional a la cantidad de sustancia en cuestión). Esto conduce a una paradoja conocida como la paradoja de Gibbs , en honor a Josiah Willard Gibbs , quien propuso este experimento mental en 1874-1875. [1] [2] La paradoja permite que la entropía de los sistemas cerrados disminuya, violando la segunda ley de la termodinámica . Una paradoja relacionada es la "paradoja de la mezcla". Si uno toma la perspectiva de que la definición de entropía debe cambiarse para ignorar la permutación de partículas, en el límite termodinámico , se evita la paradoja.
Gibbs consideró la siguiente dificultad que surge si la entropía del gas ideal no es extensiva. [1] Dos contenedores de un gas ideal se encuentran uno al lado del otro. El gas en el contenedor n.° 1 es idéntico en todos los aspectos al gas en el contenedor n.° 2 (es decir, en volumen, masa, temperatura, presión, etc.). En consecuencia, tienen la misma entropía S . Ahora se abre una puerta en la pared del contenedor para permitir que las partículas de gas se mezclen entre los contenedores. No se producen cambios macroscópicos, ya que el sistema está en equilibrio. Pero si la fórmula para la entropía no es extensiva, la entropía del sistema combinado no será 2 S . De hecho, la cantidad de entropía no extensiva particular considerada por Gibbs predice entropía adicional (más de 2 S ). Cerrar la puerta reduce entonces la entropía nuevamente a S por caja, en aparente violación de la segunda ley de la termodinámica .
Como lo entendió Gibbs [2] y lo recalcó más recientemente [3] [4], esto es un uso incorrecto de la cantidad de entropía no extensiva de Gibbs. Si las partículas de gas son distinguibles, cerrar las puertas no devolverá el sistema a su estado original; muchas de las partículas habrán cambiado de contenedor. Hay libertad para definir lo que está "ordenado", y sería un error concluir que la entropía no ha aumentado. En particular, la cantidad de entropía no extensiva de Gibbs para un gas ideal no está pensada para situaciones en las que cambia el número de partículas.
La paradoja se evita suponiendo que las partículas en el volumen son indistinguibles (al menos, que son indistinguibles de manera efectiva). Esto da como resultado la ecuación extensa de Sackur-Tetrode para la entropía, que se deduce a continuación.
En mecánica clásica, el estado de un gas ideal de energía U , volumen V y con N partículas, cada una de las cuales tiene una masa m , se representa especificando el vector de momento p y el vector de posición x para cada partícula. Esto puede considerarse como la especificación de un punto en un espacio de fases de 6 N dimensiones , donde cada uno de los ejes corresponde a una de las coordenadas de momento o posición de una de las partículas. El conjunto de puntos en el espacio de fases que podría ocupar el gas se especifica mediante la restricción de que el gas tendrá una energía particular:
y estar contenido dentro del volumen V (digamos que V es un cubo de lado X tal que V = X 3 ):
para y
La primera restricción define la superficie de una hiperesfera 3N-dimensional de radio (2 mU ) 1/2 y la segunda es un hipercubo 3N- dimensional de volumen V N . Estos se combinan para formar un hipercilindro 6N - dimensional. Así como el área de la pared de un cilindro es la circunferencia de la base por la altura, el área φ de la pared de este hipercilindro es:
La entropía es proporcional al logaritmo del número de estados que podría tener el gas mientras se satisfagan estas restricciones. En la física clásica, el número de estados es infinitamente grande, pero según la mecánica cuántica es finito. Antes de la llegada de la mecánica cuántica, esta infinitud se regularizaba haciendo discreto el espacio de fases. El espacio de fases se dividía en bloques de volumen h 3 N . La constante h apareció así como resultado de un truco matemático y se pensó que no tenía significado físico. Sin embargo, utilizando la mecánica cuántica se recupera el mismo formalismo en el límite semiclásico, pero ahora con h siendo la constante de Planck . Esto se puede ver cualitativamente a partir del principio de incertidumbre de Heisenberg : no se puede especificar un volumen en el espacio de fases N menor que h 3 N ( h es la constante de Planck).
Para calcular el número de estados, debemos calcular el volumen en el espacio de fases en el que se puede encontrar el sistema y dividirlo por h 3 N . Esto nos lleva a otro problema: el volumen parece acercarse a cero, ya que la región en el espacio de fases en la que puede estar el sistema es un área de espesor cero. Este problema es un artefacto de haber especificado la energía U con una precisión infinita. En un sistema genérico sin simetrías, un tratamiento cuántico completo produciría un conjunto discreto no degenerado de estados propios de energía. Una especificación exacta de la energía fijaría entonces el estado preciso en el que se encuentra el sistema, por lo que el número de estados disponibles para el sistema sería uno, la entropía sería, por tanto, cero.
Cuando especificamos que la energía interna es U , lo que realmente queremos decir es que la energía total del gas se encuentra en algún lugar en un intervalo de longitud alrededor de U . Aquí se considera que es muy pequeña, resulta que la entropía no depende en gran medida de la elección de para N grande . Esto significa que el "área" anterior φ debe extenderse a una capa de un espesor igual a una incertidumbre en el momento , por lo que la entropía viene dada por:
donde la constante de proporcionalidad es k , la constante de Boltzmann . Utilizando la aproximación de Stirling para la función Gamma que omite términos de orden menor que N , la entropía para N grande se convierte en:
Esta cantidad no es extensiva, como se puede ver al considerar dos volúmenes idénticos con el mismo número de partículas y la misma energía. Supongamos que los dos volúmenes están separados por una barrera al principio. Quitar o volver a insertar la pared es reversible, pero la entropía aumenta cuando se quita la barrera en la cantidad
Lo cual está en contradicción con la termodinámica si se vuelve a insertar la barrera. Esta es la paradoja de Gibbs.
La paradoja se resuelve postulando que las partículas del gas son, de hecho, indistinguibles. Esto significa que todos los estados que difieren solo por una permutación de partículas deben considerarse como el mismo estado. Por ejemplo, si tenemos un gas de 2 partículas y especificamos AB como un estado del gas donde la primera partícula ( A ) tiene un momento p 1 y la segunda partícula ( B ) tiene un momento p 2 , entonces este estado, así como el estado BA donde la partícula B tiene un momento p 1 y la partícula A tiene un momento p 2, deben considerarse como el mismo estado.
Para un gas de N partículas, hay N ! estados que son idénticos en este sentido, si se supone que cada partícula está en un estado de partícula individual diferente. Se puede hacer esta suposición con seguridad siempre que el gas no tenga una densidad extremadamente alta. En condiciones normales, se puede calcular el volumen del espacio de fases ocupado por el gas, dividiendo la ecuación 1 por N !. Utilizando de nuevo la aproximación de Stirling para N grande , ln( N !) ≈ N ln( N ) − N , la entropía para N grande es:
cuya extensibilidad se puede demostrar fácilmente. Esta es la ecuación de Sackur-Tetrode .
Una paradoja estrechamente relacionada con la paradoja de Gibbs es la paradoja de la mezcla . La paradoja de Gibbs es un caso especial de la "paradoja de la mezcla" que contiene todas las características salientes. La diferencia es que la paradoja de la mezcla trata de distinciones arbitrarias entre los dos gases, no sólo distinciones en el orden de las partículas como había considerado Gibbs. En este sentido, es una generalización directa del argumento expuesto por Gibbs. De nuevo, tomemos una caja con una partición en ella, con el gas A en un lado, el gas B en el otro lado, y ambos gases están a la misma temperatura y presión. Si el gas A y B son gases diferentes, hay una entropía que surge una vez que los gases se mezclan, la entropía de la mezcla . Si los gases son los mismos, no se calcula ninguna entropía adicional. La entropía adicional de la mezcla no depende del carácter de los gases; sólo depende del hecho de que los gases son diferentes. Los dos gases pueden ser arbitrariamente similares, pero la entropía de la mezcla no desaparece a menos que sean el mismo gas: una discontinuidad paradójica.
Esta "paradoja" se puede explicar si se considera detenidamente la definición de entropía. En particular, como explica de forma concisa Edwin Thompson Jaynes , [2] las definiciones de entropía son arbitrarias.
Como señala un ejemplo central del artículo de Jaynes, se puede desarrollar una teoría que trate a dos gases como similares incluso si en realidad esos gases pueden distinguirse mediante mediciones suficientemente detalladas. Mientras no realicemos esas mediciones detalladas, la teoría no tendrá inconsistencias internas. (En otras palabras, no importa que llamemos a los gases A y B con el mismo nombre si aún no hemos descubierto que son distintos). Si nuestra teoría llama a los gases A y B por el mismo nombre, entonces la entropía no cambia cuando los mezclamos. Si nuestra teoría llama a los gases A y B por diferentes, entonces la entropía sí aumenta cuando se mezclan. Esta idea sugiere que las ideas de "estado termodinámico" y de "entropía" son algo subjetivas.
El aumento diferencial de entropía ( dS ) como resultado de mezclar gases diferentes, multiplicado por la temperatura ( T ), es igual a la cantidad mínima de trabajo que debemos realizar para restaurar los gases a su estado original separado. Supongamos que dos gases son diferentes, pero que no podemos detectar sus diferencias. Si estos gases están en una caja, separados entre sí por una partición, ¿cuánto trabajo se necesita para restaurar el estado original del sistema después de quitar la partición y dejar que los gases se mezclen?
Ninguna, simplemente vuelva a insertar la partición. Aunque los gases se mezclaron, nunca hubo un cambio de estado detectable en el sistema, porque, según la hipótesis, los gases son experimentalmente indistinguibles.
Tan pronto como podemos distinguir la diferencia entre los gases, el trabajo necesario para recuperar la configuración macroscópica previa a la mezcla a partir del estado posterior a la mezcla se vuelve distinto de cero. Esta cantidad de trabajo no depende de cuán diferentes sean los gases, sino solo de si son distinguibles.
Esta línea de razonamiento es particularmente informativa cuando se consideran los conceptos de partículas indistinguibles y el conteo correcto de Boltzmann . La expresión original de Boltzmann para el número de estados disponibles para un gas suponía que un estado podía expresarse en términos de un número de "subniveles" de energía, cada uno de los cuales contiene un número particular de partículas. Mientras que las partículas en un subnivel dado se consideraban indistinguibles entre sí, las partículas en diferentes subniveles se consideraban distinguibles de las partículas en cualquier otro subnivel. Esto equivale a decir que el intercambio de dos partículas en dos subniveles diferentes dará como resultado un "macroestado de intercambio" del gas detectablemente diferente. Por ejemplo, si consideramos un gas simple con N partículas, a una densidad suficientemente baja como para que sea prácticamente seguro que cada subnivel contiene una partícula o ninguna (es decir, un gas de Maxwell-Boltzmann), esto significa que un simple contenedor de gas estará en uno de N ! "macroestados de intercambio" detectablemente diferentes, uno para cada posible intercambio de partículas.
Así como la paradoja de la mezcla comienza con dos recipientes detectablemente diferentes, y la entropía adicional que resulta de la mezcla es proporcional a la cantidad promedio de trabajo necesario para restaurar ese estado inicial después de la mezcla, la entropía adicional en la derivación original de Boltzmann es proporcional a la cantidad promedio de trabajo requerido para restaurar el gas simple desde algún "macroestado de intercambio" a su "macroestado de intercambio" original. Si asumimos que de hecho no hay ninguna diferencia detectable experimentalmente en estos "macroestados de intercambio" disponibles, entonces el uso de la entropía que resulta de suponer que las partículas son indistinguibles producirá una teoría consistente. Esto es "el recuento correcto de Boltzmann".
Se suele decir que la solución a la paradoja de Gibbs se deriva del hecho de que, según la teoría cuántica, las partículas iguales son indistinguibles en principio. Según el razonamiento de Jaynes, si las partículas son indistinguibles experimentalmente por cualquier razón, la paradoja de Gibbs queda resuelta, y la mecánica cuántica sólo proporciona una garantía de que, en el ámbito cuántico, esta indistinguibilidad será cierta como una cuestión de principio, en lugar de deberse a una capacidad experimental insuficientemente refinada.
En esta sección, presentamos a grandes rasgos una derivación puramente clásica de la entropía no extensiva para un gas ideal considerada por Gibbs antes de que se tenga en cuenta el "conteo correcto" (imposibilidad de distinguir las partículas). A esto le sigue una breve discusión de dos métodos estándar para hacer que la entropía sea extensiva. Finalmente, presentamos un tercer método, debido a R. Swendsen, para un resultado extensivo (aditivo) para la entropía de dos sistemas si se les permite intercambiar partículas entre sí. [5] [6]
Presentaremos una versión simplificada del cálculo. Se diferencia del cálculo completo en tres aspectos:
Comenzamos con una versión de la entropía de Boltzmann en la que el integrando es todo el espacio de fases accesible :
La integral está restringida a un contorno de regiones disponibles del espacio de fases, sujetas a la conservación de la energía. A diferencia de las integrales lineales unidimensionales que se encuentran en la física elemental, el contorno de energía constante posee una gran cantidad de dimensiones. La justificación para integrar sobre el espacio de fases utilizando la medida canónica implica el supuesto de probabilidad igual. El supuesto puede hacerse invocando la hipótesis ergódica , así como el teorema de Liouville de los sistemas hamiltonianos .
(La hipótesis ergódica subyace a la capacidad de un sistema físico de alcanzar el equilibrio térmico , pero esto puede no ser siempre válido para simulaciones por computadora (véase el problema de Fermi–Pasta–Ulam–Tsingou ) o en ciertos sistemas del mundo real como los plasmas no térmicos ).
El teorema de Liouville supone un número fijo de dimensiones que el sistema "explora". En los cálculos de entropía, el número de dimensiones es proporcional al número de partículas en el sistema, lo que obliga al espacio de fases a cambiar abruptamente de dimensionalidad cuando se añaden o se restan partículas. Esto puede explicar las dificultades para construir una derivación clara y sencilla de la dependencia de la entropía con respecto al número de partículas.
Para el gas ideal, el espacio de fases accesible es una ( n − 1)-esfera (también llamada hiperesfera) en el espacio n -dimensional :
Para recuperar el resultado paradójico de que la entropía no es extensiva, integramos sobre el espacio de fases para un gas de partículas monoatómicas confinadas a una única dimensión espacial mediante . Dado que nuestro único propósito es iluminar una paradoja, simplificamos la notación tomando la masa de la partícula y la constante de Boltzmann iguales a la unidad: . Representamos los puntos en el espacio de fases y sus partes x y v mediante vectores dimensionales n y 2 n :
Para calcular la entropía, utilizamos el hecho de que la (n-1)-esfera, tiene un "volumen de hipersuperficie" de ( n − 1) -dimensionalidad de
Por ejemplo, si n = 2, la 1-esfera es el círculo , una "hipersuperficie" en el plano. Cuando la esfera es de dimensión par ( n impar), será necesario utilizar la función gamma para dar sentido al factorial; véase más abajo.
La paradoja de Gibbs surge cuando se calcula la entropía utilizando un espacio de fases dimensional, donde también es el número de partículas en el gas. Estas partículas están confinadas espacialmente en el intervalo unidimensional . El volumen de la superficie de energía fija es
Los subíndices en se utilizan para definir las "variables de estado" y se analizarán más adelante, cuando se argumente que el número de partículas carece de estatus completo como variable de estado en este cálculo. La integral sobre el espacio de configuración es . Como lo indica la llave debajo, la integral sobre el espacio de velocidad está restringida al "área de superficie" de la hiperesfera n − 1 dimensional de radio , y por lo tanto es igual al "área" de esa hipersuperficie. Por lo tanto
Después de aproximar el factorial y eliminar los términos pequeños, obtenemos
En la segunda expresión, se restó y se agregó el término, utilizando el hecho de que . Esto se hizo para resaltar exactamente cómo la "entropía" definida aquí no es una propiedad extensiva de la materia. Los primeros dos términos son extensivos: si el volumen del sistema se duplica, pero se llena con la misma densidad de partículas con la misma energía, entonces cada uno de estos términos se duplica. Pero el tercer término no es extensivo ni intensivo y, por lo tanto, es incorrecto.
Se ha añadido la constante arbitraria porque la entropía puede definirse normalmente hasta una constante aditiva arbitraria. Esto es especialmente necesario cuando la entropía se define como el logaritmo de un volumen de espacio de fases medido en unidades de momento-posición. Cualquier cambio en la forma en que se definen estas unidades añadirá o restará una constante al valor de la entropía.
Como se ha comentado anteriormente, se recupera una forma extensiva de entropía si dividimos el volumen del espacio de fases, , por n !. Un enfoque alternativo es argumentar que no se puede confiar en la dependencia del número de partículas sobre la base de que el cambio también cambia la dimensionalidad del espacio de fases. Tales cambios en la dimensionalidad quedan fuera del alcance de la mecánica hamiltoniana y del teorema de Liouville . Por esa razón es plausible permitir que la constante arbitraria sea una función de . [7] Definiendo la función como, , tenemos:
que tiene una amplia escalabilidad:
Siguiendo a Swendsen, [5] [6] permitimos que dos sistemas intercambien partículas. Esto esencialmente "hace lugar" en el espacio de fases para que las partículas entren o salgan sin requerir un cambio en el número de dimensiones del espacio de fases. El número total de partículas es :
Tomando la integral sobre el espacio de fases, tenemos:
Los signos de interrogación (?) sirven como recordatorio de que no podemos suponer que las primeras n partículas A (es decir, 1 a n A ) están en el sistema A mientras que las otras partículas ( n B a N ) están en el sistema B . (Esto se analiza más detalladamente en la siguiente sección).
Tomando el logaritmo y manteniendo sólo los términos más grandes, tenemos:
Esto puede interpretarse como la suma de la entropía del sistema A y del sistema B , ambos extensivos. Y hay un término, , que no es extensivo.
Las fórmulas correctas (extensivas) para los sistemas A y B se obtuvieron porque incluimos todas las formas posibles en que los dos sistemas podrían intercambiar partículas. El uso de combinaciones (es decir, N partículas eligen N A ) se utilizó para determinar el número de formas en que N partículas pueden dividirse en el sistema A que contiene n partículas A y el sistema B que contiene n partículas B. Este recuento no se justifica por razones físicas, sino por la necesidad de integrar sobre el espacio de fases. Como se ilustrará a continuación, el espacio de fases no contiene una única n A -esfera y una única n B -esfera, sino
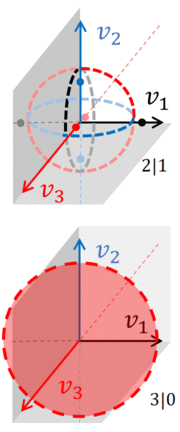
pares de n -esferas, todas situadas en el mismo espacio de velocidad de ( N +1) dimensión. La integral sobre el espacio de fases accesible debe incluir todas estas n -esferas, como se puede ver en la figura, que muestra el espacio de fases de velocidad real asociado con un gas que consta de tres partículas . Además, este gas se ha dividido en dos sistemas, A y B.
Si ignoramos las variables espaciales, el espacio de fases de un gas con tres partículas es tridimensional, lo que permite esbozar las n -esferas sobre las que debe tomarse la integral sobre el espacio de fases. Si las tres partículas están juntas, la división entre los dos gases es 3|0. El espacio de fases accesible está delimitado por una esfera ordinaria ( 2-esfera ) con un radio que es o (dependiendo de qué sistema tenga las partículas).
Si la división es 2|1, entonces el espacio de fases consta de círculos y puntos . Cada círculo ocupa dos dimensiones y, para cada círculo, dos puntos se encuentran en el tercer eje, equidistantes del centro del círculo. En otras palabras, si el sistema A tiene 2 partículas, el espacio de fases accesible consta de 3 pares de n -esferas , cada par es una 1-esfera y una 0-esfera :
Tenga en cuenta que
En particular, Gibbs no señaló que una "constante de integración" no era una constante arbitraria, sino una función arbitraria. Pero esto tiene, como veremos, consecuencias físicas no triviales. Lo notable no es que Gibbs no haya enfatizado un punto matemático sutil en casi las últimas palabras que escribió, sino que durante 80 años después todos los escritores de libros de texto (excepto posiblemente Pauli) no lo vieron.