


Un fósforo es una sustancia que presenta el fenómeno de la luminiscencia ; emite luz cuando se expone a algún tipo de energía radiante . El término se utiliza tanto para las sustancias fluorescentes o fosforescentes que brillan al exponerlas a la luz ultravioleta o visible, como para las sustancias catodoluminiscentes que brillan cuando son golpeadas por un haz de electrones ( rayos catódicos ) en un tubo de rayos catódicos .
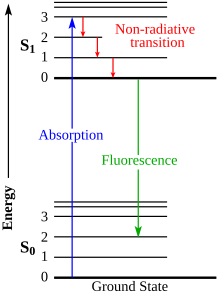
Cuando un fósforo se expone a la radiación, los electrones orbitales de sus moléculas se excitan hasta alcanzar un nivel energético superior ; cuando vuelven a su nivel anterior, emiten la energía en forma de luz de un color determinado. Los fósforos se pueden clasificar en dos categorías: sustancias fluorescentes , que emiten la energía inmediatamente y dejan de brillar cuando se apaga la radiación excitadora, y sustancias fosforescentes , que emiten la energía después de un tiempo, por lo que siguen brillando después de que se apaga la radiación, y su brillo disminuye en un período de milisegundos a días.
Los materiales fluorescentes se utilizan en aplicaciones en las que el fósforo se excita de forma continua: tubos de rayos catódicos (TRC) y pantallas de plasma para visualización de vídeo, pantallas de fluoroscopios , luces fluorescentes , sensores de centelleo , LED blancos y pinturas luminosas para arte con luz negra . Los materiales fosforescentes se utilizan donde se necesita una luz persistente, como en las esferas de los relojes que brillan en la oscuridad y en los instrumentos de los aviones, y en las pantallas de radar para permitir que los "puntos" del objetivo permanezcan visibles a medida que gira el haz del radar. Los fósforos de los TRC se estandarizaron a principios de la Segunda Guerra Mundial y se designaron con la letra "P" seguida de un número.
El fósforo , el elemento químico emisor de luz que da nombre a los fósforos, emite luz debido a la quimioluminiscencia , no a la fosforescencia. [1]
El proceso de centelleo en los materiales inorgánicos se debe a la estructura de bandas electrónicas que se encuentra en los cristales . Una partícula entrante puede excitar un electrón desde la banda de valencia a la banda de conducción o a la banda de excitones (ubicada justo debajo de la banda de conducción y separada de la banda de valencia por un espacio de energía ). Esto deja un hueco asociado detrás, en la banda de valencia. Las impurezas crean niveles electrónicos en el espacio prohibido .
Los excitones son pares electrón-hueco débilmente unidos que deambulan por la red cristalina hasta que son capturados en su totalidad por centros de impurezas. Luego se desexcitan rápidamente emitiendo luz de centelleo (componente rápido).
En la banda de conducción, los electrones son independientes de sus huecos asociados. Esos electrones y huecos son capturados sucesivamente por centros de impurezas que excitan ciertos estados metaestables no accesibles a los excitones. La desexcitación retardada de esos estados de impurezas metaestables, ralentizada por la dependencia del mecanismo prohibido de baja probabilidad , da como resultado nuevamente la emisión de luz (componente lento). En el caso de los centelleadores inorgánicos , las impurezas activadoras se eligen típicamente de modo que la luz emitida esté en el rango visible o cerca del UV , donde los fotomultiplicadores son efectivos.
Los fósforos suelen ser compuestos de metales de transición o de tierras raras de diversos tipos. En los fósforos inorgánicos, estas inhomogeneidades en la estructura cristalina se crean normalmente mediante la adición de una cantidad mínima de dopantes , impurezas llamadas activadores . (En casos excepcionales, las dislocaciones u otros defectos del cristal pueden desempeñar el papel de la impureza). La longitud de onda emitida por el centro de emisión depende del propio átomo y de la estructura cristalina circundante.
Los fósforos se fabrican generalmente a partir de un material huésped adecuado con un activador añadido . El tipo más conocido es el sulfuro de cinc activado con cobre (ZnS) y el sulfuro de cinc activado con plata ( sulfuro de cinc y plata ).
Los materiales hospedantes son típicamente óxidos , nitruros y oxinitruros, [2] sulfuros , seleniuros , haluros o silicatos de zinc , cadmio , manganeso , aluminio , silicio o varios metales de tierras raras . Los activadores prolongan el tiempo de emisión (resplandor). A su vez, se pueden utilizar otros materiales (como el níquel ) para extinguir el resplandor y acortar la parte de desintegración de las características de emisión del fósforo.
Muchos polvos de fósforo se producen en procesos de baja temperatura, como el sol-gel , y generalmente requieren un recocido posterior a temperaturas de ~1000 °C, lo que no es deseable para muchas aplicaciones. Sin embargo, la optimización adecuada del proceso de crecimiento permite a los fabricantes evitar el recocido. [3]
Los fósforos utilizados para lámparas fluorescentes requieren un proceso de producción de varios pasos, con detalles que varían según el fósforo en particular. El material a granel debe molerse para obtener un rango de tamaño de partícula deseado, ya que las partículas grandes producen un revestimiento de lámpara de mala calidad y las partículas pequeñas producen menos luz y se degradan más rápidamente. Durante la cocción del fósforo, las condiciones del proceso deben controlarse para evitar la oxidación de los activadores del fósforo o la contaminación de los recipientes de proceso. Después de la molienda, el fósforo puede lavarse para eliminar el exceso menor de elementos activadores. No se debe permitir que los elementos volátiles escapen durante el procesamiento. Los fabricantes de lámparas han cambiado las composiciones de los fósforos para eliminar algunos elementos tóxicos que se usaban anteriormente, como el berilio , el cadmio o el talio . [4]
Los parámetros comúnmente citados para los fósforos son la longitud de onda de emisión máxima (en nanómetros, o alternativamente la temperatura de color en kelvin para mezclas blancas), el ancho de pico (en nanómetros al 50% de intensidad) y el tiempo de decaimiento (en segundos ).
Ejemplos:
Muchos fósforos tienden a perder eficacia gradualmente por varios mecanismos: los activadores pueden sufrir cambios de valencia (normalmente oxidación ), la red cristalina se degrada, los átomos (a menudo los activadores) se difunden a través del material, la superficie sufre reacciones químicas con el medio ambiente con la consiguiente pérdida de eficacia o la formación de una capa que absorbe la energía excitante y/o radiada, etc.
La degradación de los dispositivos electroluminiscentes depende de la frecuencia de la corriente de activación, el nivel de luminancia y la temperatura; la humedad también perjudica de manera muy notable la vida útil del fósforo.
Los materiales más duros, de alto punto de fusión e insolubles en agua muestran una menor tendencia a perder luminiscencia durante el funcionamiento. [7]
Ejemplos:
Las capas de fósforo proporcionan la mayor parte de la luz producida por las lámparas fluorescentes y también se utilizan para mejorar el equilibrio de la luz producida por las lámparas de haluro metálico . Varios letreros de neón utilizan capas de fósforo para producir diferentes colores de luz. Las pantallas electroluminiscentes que se encuentran, por ejemplo, en los paneles de instrumentos de los aviones, utilizan una capa de fósforo para producir una iluminación sin deslumbramiento o como dispositivos de visualización numérica y gráfica. Las lámparas LED blancas consisten en un emisor azul o ultravioleta con un revestimiento de fósforo que emite en longitudes de onda más largas, lo que proporciona un espectro completo de luz visible. Los tubos de rayos catódicos no enfocados y no desviados se han utilizado como lámparas estroboscópicas desde 1958. [15]
La termometría de fósforo es un método de medición de temperatura que utiliza la dependencia de la temperatura de ciertos fósforos. Para ello, se aplica un revestimiento de fósforo a una superficie de interés y, por lo general, el tiempo de decaimiento es el parámetro de emisión que indica la temperatura. Debido a que la iluminación y la óptica de detección se pueden ubicar de forma remota, el método se puede utilizar para superficies móviles, como las superficies de motores de alta velocidad. Además, el fósforo se puede aplicar al extremo de una fibra óptica como un análogo óptico de un termopar. [ cita requerida ]
En estas aplicaciones, el fósforo se añade directamente al plástico utilizado para moldear los juguetes o se mezcla con un aglutinante para su uso como pintura.
El fósforo ZnS:Cu se utiliza en cremas cosméticas que brillan en la oscuridad y que se utilizan con frecuencia para los maquillajes de Halloween . Por lo general, la persistencia del fósforo aumenta a medida que aumenta la longitud de onda. Véase también barra luminosa para artículos luminosos basados en quimioluminiscencia .
La extinción del estado triplete por O2 ( que tiene un estado fundamental triplete) como resultado de la transferencia de energía de Dexter es bien conocida en soluciones de complejos de metales pesados fosforescentes y polímeros dopados. [16] En los últimos años, los materiales porosos fosforescentes (como los marcos metalorgánicos y los marcos orgánicos covalentes ) han demostrado capacidades prometedoras de detección de oxígeno, por su adsorción de gas no lineal en presiones parciales ultrabajas de oxígeno. [17] [18]
Los sellos con bandas de fósforo aparecieron por primera vez en 1959 como guías para las máquinas que clasifican el correo. [19] En todo el mundo existen muchas variedades con diferentes cantidades de bandas. [20] Los sellos postales a veces se coleccionan por si están o no "etiquetados" con fósforo (o impresos en papel luminiscente ).
Los fósforos de sulfuro de cinc se utilizan con materiales radiactivos , donde el fósforo se excita con los isótopos alfa y beta de desintegración, para crear pintura luminiscente para diales de relojes e instrumentos ( esferas de radio ). Entre 1913 y 1950, el radio-228 y el radio-226 se utilizaron para activar un fósforo hecho de sulfuro de cinc dopado con plata (ZnS:Ag), que daba un brillo verdoso. El fósforo no es adecuado para ser utilizado en capas más gruesas que 25 mg/cm 2 , ya que la autoabsorción de la luz se convierte en un problema. Además, el sulfuro de cinc sufre una degradación de su estructura de red cristalina, lo que lleva a una pérdida gradual de brillo significativamente más rápida que el agotamiento del radio. Ernest Rutherford utilizó pantallas de espintariscopio revestidas de ZnS:Ag en sus experimentos para descubrir el núcleo atómico .
El sulfuro de cinc dopado con cobre (ZnS:Cu) es el fósforo más común y produce luz azul verdosa. El sulfuro de cinc dopado con cobre y magnesio (ZnS:Cu,Mg) produce luz amarillo-anaranjada.
El tritio también se utiliza como fuente de radiación en diversos productos que utilizan iluminación con tritio .
La electroluminiscencia se puede aprovechar en fuentes de luz. Estas fuentes suelen emitir desde un área amplia, lo que las hace adecuadas para la retroiluminación de pantallas LCD. La excitación del fósforo se consigue normalmente mediante la aplicación de un campo eléctrico de alta intensidad , normalmente con una frecuencia adecuada. Las fuentes de luz electroluminiscentes actuales tienden a degradarse con el uso, lo que da lugar a una vida útil relativamente corta.
ZnS:Cu fue la primera formulación que mostró con éxito electroluminiscencia, probada en 1936 por Georges Destriau en los laboratorios Madame Marie Curie en París.
La electroluminiscencia en polvo o CA se encuentra en una variedad de aplicaciones de iluminación nocturna y de retroiluminación. Varios grupos ofrecen productos EL de marca (por ejemplo, IndiGlo utilizado en algunos relojes Timex) o "Lighttape", otro nombre comercial de un material electroluminiscente, utilizado en tiras de luz electroluminiscente. El programa espacial Apolo suele ser considerado el primer uso significativo de EL para retroiluminación e iluminación. [21]
Los diodos emisores de luz blanca son generalmente LED azules de InGaN con un revestimiento de un material adecuado. A menudo se utiliza YAG dopado con cerio (III) ( YAG:Ce 3+ o Y 3 Al 5 O 12 :Ce 3+ ); absorbe la luz del LED azul y emite en un amplio rango de verdoso a rojizo, con la mayor parte de su salida en amarillo. Esta emisión amarilla combinada con la emisión azul restante da la luz "blanca", que se puede ajustar a la temperatura de color como blanco cálido (amarillento) o frío (azulado). La emisión amarilla pálida del Ce 3+ :YAG se puede ajustar sustituyendo el cerio por otros elementos de tierras raras como el terbio y el gadolinio e incluso se puede ajustar aún más sustituyendo parte o la totalidad del aluminio en el YAG por galio. Sin embargo, este proceso no es de fosforescencia. La luz amarilla se produce mediante un proceso conocido como centelleo , siendo la ausencia total de resplandor una de las características del proceso.
Algunos sialones dopados con tierras raras son fotoluminiscentes y pueden servir como fósforos. El β-SiAlON dopado con europio (II) absorbe en el espectro de luz ultravioleta y visible y emite una intensa emisión visible de banda ancha. Su luminancia y color no cambian significativamente con la temperatura, debido a la estructura cristalina estable a la temperatura. Tiene un gran potencial como fósforo de conversión descendente verde para LED blancos ; también existe una variante amarilla (α-SiAlON [22] ). Para LED blancos, se utiliza un LED azul con un fósforo amarillo, o con un fósforo SiAlON verde y amarillo y un fósforo rojo basado en CaAlSiN 3 (CASN). [23] [24] [25]
Los LED blancos también se pueden fabricar recubriendo los LED que emiten luz ultravioleta cercana con una mezcla de fósforos de europio de alta eficiencia que emiten luz roja y azul más sulfuro de cinc dopado con cobre y aluminio (ZnS:Cu,Al) que emite luz verde . Este es un método análogo al funcionamiento de las lámparas fluorescentes .
Algunos LED blancos más nuevos utilizan un emisor amarillo y azul en serie para aproximarse al blanco; esta tecnología se utiliza en algunos teléfonos Motorola como el Blackberry, así como en la iluminación LED y en los emisores apilados de la versión original que utilizan GaN sobre SiC sobre InGaP, pero luego se descubrió que se fracturaba con corrientes de excitación más altas.
Muchos LED blancos utilizados en sistemas de iluminación general se pueden utilizar para la transferencia de datos, como, por ejemplo, en sistemas que modulan el LED para que actúe como baliza . [26]
También es común que los LED blancos utilicen fósforos distintos del Ce:YAG, o que utilicen dos o tres fósforos para lograr un CRI más alto, a menudo a costa de la eficiencia. Ejemplos de fósforos adicionales son el R9, que produce un rojo saturado, los nitruros que producen rojo y los aluminatos como el granate de lutecio y aluminio que producen verde. Los fósforos de silicato son más brillantes pero se desvanecen más rápidamente y se utilizan en las retroiluminaciones LED de LCD en dispositivos móviles. Los fósforos LED se pueden colocar directamente sobre el chip o hacer una cúpula y colocarse sobre el LED: este enfoque se conoce como fósforo remoto. [27] Algunos LED de color, en lugar de utilizar un LED de color, utilizan un LED azul con un fósforo de color porque tal disposición es más eficiente que un LED de color. Los fósforos de oxinitruro también se pueden utilizar en los LED. Los precursores utilizados para fabricar los fósforos pueden degradarse cuando se exponen al aire. [28]

Los tubos de rayos catódicos producen patrones de luz generados por señales en un formato (normalmente) redondo o rectangular. Los voluminosos CRT se utilizaban en los televisores domésticos en blanco y negro que se hicieron populares en la década de 1950, así como en los televisores en color de primera generación basados en tubos y en la mayoría de los monitores de ordenador anteriores. Los CRT también se han utilizado ampliamente en instrumentación científica y de ingeniería, como los osciloscopios , normalmente con un único color de fósforo, normalmente el verde. Los fósforos para dichas aplicaciones pueden tener una persistencia luminosa prolongada, para una mayor persistencia de la imagen.
Los fósforos se pueden depositar como película delgada o como partículas discretas, un polvo adherido a la superficie. Las películas delgadas tienen una vida útil más larga y una mejor resolución, pero proporcionan una imagen menos brillante y menos eficiente que las de polvo. Esto se debe a múltiples reflexiones internas en la película delgada, que dispersan la luz emitida.
Blanco (en blanco y negro): La mezcla de sulfuro de zinc y cadmio y sulfuro de zinc y plata, ZnS:Ag + (Zn,Cd)S:Ag, es el fósforo blanco P4 que se utiliza en los CRT de los televisores en blanco y negro. Las mezclas de fósforos amarillos y azules son habituales. También se pueden encontrar mezclas de fósforos rojo, verde y azul, o un único fósforo blanco.
Rojo: El óxido de itrio - sulfuro activado con europio se utiliza como fósforo rojo en los CRT en color. El desarrollo de la televisión en color llevó mucho tiempo debido a la búsqueda de un fósforo rojo. El primer fósforo de tierras raras que emite rojo, YVO 4 :Eu 3+ , fue introducido por Levine y Palilla como un color primario en la televisión en 1964. [29] En forma de monocristal, se utilizó como un excelente polarizador y material láser. [30]
Amarillo: Cuando se mezcla con sulfuro de cadmio , el sulfuro de zinc y cadmio resultante (Zn,Cd)S:Ag , proporciona una luz amarilla intensa.
Verde: La combinación de sulfuro de zinc con cobre , el fósforo P31 o ZnS:Cu , proporciona una luz verde con un pico a 531 nm y un brillo prolongado.
Azul: Combinación de sulfuro de cinc con unas pocas ppm de plata , el ZnS:Ag, cuando se excita con electrones, proporciona un intenso resplandor azul con un máximo a 450 nm, con una breve persistencia con una duración de 200 nanosegundos. Se lo conoce como fósforo P22B . Este material, sulfuro de cinc y plata , sigue siendo uno de los fósforos más eficientes en los tubos de rayos catódicos. Se utiliza como fósforo azul en los CRT de color.
Los fósforos suelen ser malos conductores eléctricos, lo que puede provocar la deposición de carga residual en la pantalla, lo que reduce de forma efectiva la energía de los electrones que chocan entre sí debido a la repulsión electrostática (un efecto conocido como "adherencia"). Para eliminar esto, se deposita una fina capa de aluminio (de unos 100 nm) sobre los fósforos, normalmente mediante evaporación al vacío, y se conecta a la capa conductora del interior del tubo. Esta capa también refleja la luz del fósforo en la dirección deseada y protege al fósforo del bombardeo de iones resultante de un vacío imperfecto.
Para reducir la degradación de la imagen por la reflexión de la luz ambiental, se puede aumentar el contraste mediante varios métodos. Además de enmascarar con negro las áreas no utilizadas de la pantalla, las partículas de fósforo en las pantallas de color se recubren con pigmentos del mismo color. Por ejemplo, los fósforos rojos se recubren con óxido férrico (que reemplaza al Cd(S,Se) anterior debido a la toxicidad del cadmio), los fósforos azules se pueden recubrir con azul marino ( CoO · n Al
2Oh
3) o ultramar ( Na
8Alabama
6Si
6Oh
24S
2). Los fósforos verdes basados en ZnS:Cu no necesitan ser recubiertos debido a su propio color amarillento. [7]
Las pantallas de televisión en blanco y negro requieren un color de emisión cercano al blanco. Normalmente se utiliza una combinación de fósforos.
La combinación más común es ZnS:Ag + (Zn,Cd)S:Cu,Al (azul + amarillo). Otras combinaciones son ZnS:Ag + (Zn,Cd)S:Ag (azul + amarillo) y ZnS:Ag + ZnS:Cu,Al + Y2O2S : Eu3 + ( azul + verde + rojo; no contiene cadmio y tiene una eficiencia baja). El tono de color se puede ajustar mediante las proporciones de los componentes.
Como las composiciones contienen granos discretos de diferentes fósforos, producen una imagen que puede no ser completamente uniforme. Un único fósforo de emisión blanca, (Zn,Cd)S:Ag,Au,Al, supera este obstáculo. Debido a su baja eficiencia, se utiliza solo en pantallas muy pequeñas.
Las pantallas suelen estar cubiertas con fósforo mediante un revestimiento de sedimentación, donde las partículas suspendidas en una solución se dejan sedimentar en la superficie. [31]
Para mostrar una paleta de colores limitada, hay algunas opciones.
En los tubos de penetración de rayos , se colocan capas de fósforos de diferentes colores y se separan con material dieléctrico. El voltaje de aceleración se utiliza para determinar la energía de los electrones; los de menor energía se absorben en la capa superior del fósforo, mientras que algunos de los de mayor energía se disparan a través de él y se absorben en la capa inferior. De este modo, se muestra el primer color o una mezcla del primero y el segundo. Con una pantalla con una capa exterior roja y una capa interior verde, la manipulación del voltaje de aceleración puede producir un continuo de colores desde el rojo hasta el naranja y el amarillo y el verde.
Otro método consiste en utilizar una mezcla de dos fósforos con características diferentes. El brillo de uno depende linealmente del flujo de electrones, mientras que el brillo del otro se satura a flujos más altos: el fósforo no emite más luz, independientemente de cuántos electrones más impacten en él. A flujos de electrones bajos, ambos fósforos emiten juntos; a flujos más altos, prevalece la contribución luminosa del fósforo no saturante, lo que cambia el color combinado. [31]
Estas pantallas pueden tener una alta resolución, debido a la ausencia de estructuración bidimensional de los fósforos RGB de los CRT. Sin embargo, su paleta de colores es muy limitada. Se utilizaron, por ejemplo, en algunas pantallas de radar militares antiguas.
Los fósforos de los CRT en color necesitan un mayor contraste y una mayor resolución que los de los CRT en blanco y negro. La densidad de energía del haz de electrones es aproximadamente 100 veces mayor que en los CRT en blanco y negro; el punto de electrones se enfoca a unos 0,2 mm de diámetro en lugar de los 0,6 mm de diámetro de los CRT en blanco y negro. Por lo tanto, los efectos relacionados con la degradación de la irradiación de electrones son más pronunciados.
Los CRT en color requieren tres fósforos diferentes, que emiten en rojo, verde y azul, y que se muestran en la pantalla. Para la producción de color se utilizan tres cañones de electrones independientes (excepto en las pantallas que utilizan tecnología de tubo de índice de haz , que es poco común). El fósforo rojo siempre ha sido un problema, ya que es el más tenue de los tres, lo que hace necesario ajustar las corrientes de los haces de electrones verde y azul, que son más brillantes, para que sean iguales al brillo más bajo del fósforo rojo. Esto hizo que los primeros televisores en color solo se pudieran utilizar en interiores, ya que la luz brillante hacía imposible ver la imagen tenue, mientras que los televisores portátiles en blanco y negro que se podían ver a la luz del sol en exteriores ya eran comunes.
La composición de los fósforos cambió con el tiempo, a medida que se desarrollaron mejores fósforos y las preocupaciones ambientales llevaron a reducir el contenido de cadmio y luego a abandonarlo por completo. El (Zn,Cd)S:Ag,Cl se reemplazó por (Zn,Cd)S:Cu,Al con una proporción cadmio/zinc más baja, y luego por ZnS:Cu,Al sin cadmio .
El fósforo azul permaneció en general sin cambios, un sulfuro de cinc dopado con plata. El fósforo verde inicialmente utilizó silicato de cinc dopado con manganeso, luego evolucionó a través de sulfuro de cadmio-cinc activado con plata, a una fórmula activada de cobre-aluminio con menor contenido de cadmio, y luego a una versión sin cadmio del mismo. El fósforo rojo fue el que experimentó más cambios; originalmente era fosfato de cinc activado con manganeso, luego sulfuro de cadmio-cinc activado con plata, luego aparecieron los fósforos activados con europio(III); primero en una matriz de vanadato de itrio , luego en óxido de itrio y actualmente en oxisulfuro de itrio. La evolución de los fósforos fue, por lo tanto (ordenada por BGR):
Para los televisores de proyección , donde la densidad de potencia del haz puede ser dos órdenes de magnitud mayor que en los CRT convencionales, se deben utilizar fósforos diferentes.
Para el color azul se utiliza ZnS:Ag,Cl, pero se satura. Se puede utilizar (La,Gd)OBr:Ce,Tb 3+ como alternativa, que es más lineal a altas densidades de energía.
Para el verde, un Gd2O2Tb3 + activado con terbio ; su pureza de color y brillo a bajas densidades de excitación es peor que la alternativa de sulfuro de cinc, pero se comporta de forma lineal a altas densidades de energía de excitación, mientras que el sulfuro de cinc se satura. Sin embargo, también se satura, por lo que se puede sustituir por Y3Al5O12:Tb3+ o Y2SiO5 : Tb3 + . El LaOBr : Tb3 + es brillante pero sensible al agua , propenso a la degradación y la morfología en forma de placa de sus cristales dificulta su uso; estos problemas se han resuelto ahora, por lo que se está utilizando cada vez más debido a su mayor linealidad.
Se utiliza Y2O2S:Eu3+ para la emisión roja . [ 31 ]
Otros fósforos disponibles comercialmente, para su uso como pantallas de rayos X , detectores de neutrones , centelleadores de partículas alfa , etc., son:
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace )