
La química de organoboro o química de organoboranos estudia los compuestos de organoboro , también llamados organoboranos . Estos compuestos químicos combinan boro y carbono ; por lo general, son derivados orgánicos del borano (BH3 ) , como en el caso de los trialquilboranos. [1] [2]
Los organoboranos y los -boratos permiten muchas transformaciones químicas en la química orgánica , las más importantes son la hidroboración y la carboboración . La mayoría de las reacciones transfieren un sustituyente nucleofílico de boro a un centro electrofílico, ya sea intermolecular o intramolecularmente . En particular, los boratos α,β -insaturados y los boratos con un grupo saliente α son altamente susceptibles a la migración intramolecular 1,2 de un grupo desde el boro a la posición electrofílica α. La oxidación o protonólisis de los organoboranos resultantes genera muchos productos orgánicos, incluidos alcoholes, compuestos carbonílicos, alquenos y haluros. [3]
El enlace CB tiene baja polaridad ( electronegatividad 2,55 para el carbono y 2,04 para el boro). Los compuestos de alquilboro son en general estables, aunque se oxidan fácilmente.
El boro a menudo forma compuestos deficientes en electrones sin un octeto completo , como los triorganoboranos. Estos compuestos son electrófilos fuertes , pero normalmente están demasiado impedidos estéricamente como para dimerizarse . La donación de electrones de los grupos vinilo y arilo puede otorgar al enlace CB un carácter de doble enlace .

La clase más estudiada de compuestos de organoboro tiene la fórmula BR n H 3−n . Estos compuestos son catalizadores, reactivos e intermediarios sintéticos. Los derivados de trialquilo y triarilo presentan un centro de boro trigonal-planar que típicamente es sólo débilmente ácido de Lewis . Excepto unos pocos derivados voluminosos, los hidruros (n = 1 o 2) se dimerizan, como el propio diborano . Los derivados trisustituidos, por ejemplo, el trietilboro , son monómeros. [5]
Los monoalquilboranos son relativamente raros. Cuando el grupo alquilo es pequeño, como el metilo, los monoalquilboranos tienden a redistribuirse para dar mezclas de diborano y di- y trialquilboranos. Los monoalquilboranos existen típicamente como dímeros de la forma [RBH 2 ] 2 . Un ejemplo es el xilborano (ThxBH 2 ), producido por la hidroboración de tetrametiletileno : [6] Un ejemplo quiral es el monoisopinocanfeilborano. Aunque a menudo se escribe como IpcBH 2 , es un dímero [IpcBH 2 ] 2 . Se obtiene por hidroboración de (−)‐α‐pineno con sulfuro de dimetilo de borano . [7]
Los dialquilboranos también son raros para los grupos alquilo pequeños. Una forma común de prepararlos es la reducción de dialquilhalogenoboranos con hidruros metálicos. [8] Una aplicación sintética importante que utiliza dichos dialquilboranos, como el dietilborano, es la transmetalación de los compuestos de organoboro para formar compuestos de organocinc. [9] [10]
Algunos diarilboranos y dialquilboranos son bien conocidos. El dimesitilborano es un dímero (C6H2Me3 ) 4B2H2 ) . Reacciona sólo lentamente con alquenos terminales simples. Se añade a los alquinos para dar alquenilboranos. [ 11 ] Entre los dialquilboranos impedidos está el disiamilborano , abreviado Sia2BH . También es un dímero. Debido a su volumen estérico, hidrobora selectivamente alquenos menos impedidos, normalmente terminales, en presencia de alquenos más sustituidos. [12] El disiamilborano debe prepararse recién, ya que sus soluciones sólo se pueden almacenar a 0 °C durante unas pocas horas. El diciclohexilborano Chx2BH exhibe una estabilidad térmica mejorada que el Sia2BH . Un dialquilborano versátil es el 9-BBN . También llamado "borano banana", existe como dímero. Se puede destilar sin descomposición a 195 °C (12 mm Hg). Las reacciones con 9-BBN ocurren típicamente a 60–80 °C, y la mayoría de los alquenos reaccionan en una hora. Los alquenos tetrasustituidos agregan 9-BBN a temperatura elevada. La hidroboración de alquenos con 9-BBN se produce con excelente regioselectividad. Es más sensible a las diferencias estéricas que Sia2BH , quizás debido a su estructura rígida de C8 . El 9-BBN es más reactivo con los alquenos que con los alquinos. [13]
Los compuestos del tipo BR n (OR) 3-n se denominan ésteres borínicos (n = 2), ésteres borónicos (n = 1) y boratos (n = 0). Los ácidos borónicos son clave para la reacción de Suzuki . El borato de trimetilo , que no es un compuesto organoborónico, es un intermediario en la producción de borohidruro de sodio.
El boro es conocido por sus especies de agrupaciones , por ejemplo, el dodecaborato [B 12 H 12 ] 2- . Dichas agrupaciones tienen muchos derivados orgánicos. Un ejemplo es [B 12 (CH 3 ) 12 ] 2- y su derivado radical [B 12 (CH 3 ) 12 ] − . [14] Los compuestos de agrupaciones relacionados con vértices de carbono son los carboranos ; el más conocido es el ortocarborano, C 2 B 10 H 12 . Los carboranos tienen pocas aplicaciones comerciales. Los derivados aniónicos como [C 2 B 9 H 11 ] 2− , llamados dicarbollidas, se ligan de manera similar al ciclopentadienuro .
En el borabenceno , el boro reemplaza un centro CH en el benceno. El borabenceno y sus derivados aparecen invariablemente como aductos, por ejemplo, C 5 H 5 B-piridina.
El compuesto cíclico boro , un análogo estructural del pirrol , no ha sido aislado, pero se conocen derivados sustituidos (boroles).
El compuesto cíclico borepin es aromático.
Los compuestos organometálicos con enlaces metal-boro (M–BR 2 ) son complejos de borilo, correspondientes al anión borilo teórico R 2 B − . Los ligandos relacionados son los borilenos (M–B(R)–M).
Las bases fuertes no desprotonan los boranos R 2 BH. En cambio, estas reacciones dan lugar al aducto octeto-completo R 2 HB-base. [15]
Se conocen compuestos isoelectrónicos con los carbenos N-heterocíclicos. El compuesto inusual se preparó por reducción de un precursor de bromuro de boro: [16] [17]

Los alquilidenoboranos (RB=CRR) con un doble enlace boro-carbono son poco comunes. Un ejemplo es el borabenceno . El compuesto original, HB=CH 2 , se puede detectar a baja temperatura. El derivado CH 3 B=C(SiMe 3 ) 2 es bastante estable, pero propenso a la ciclodimerización. [18]
Los NHC y los boranos forman aductos NHC-borano estables . [19] Los aductos de trietilborano se pueden sintetizar directamente a partir de la sal de imidazolio y el trietilborohidruro de litio .
Los enlaces dobles boro-boro son poco frecuentes. Un ejemplo es el diboreno (RHB=BHR): [20] [21]

Cada átomo de boro tiene un protón unido y está coordinado a un carbeno NHC . La estructura original con los ligandos carbenos adicionales es diborano(2) . [22] [23]
Un diboryne reportado se basa en una química similar.
Se pueden preparar organoboranos simples, como el trietilborano o el tris(pentafluorofenil)boro, a partir del trifluoroborano (en éter ) y el reactivo de Grignard de etilo o pentafluorofenilo. La adición de carbaniones adicionales dará como resultado un borato (R 4 B − ).
Los ácidos borónicos RB(OH) 2 reaccionan con bifluoruro de potasio K[HF 2 ] para formar sales de trifluoroborato K[RBF 3 ], [24] precursores de difluoruros de boro de alquilo y arilo nucleofílicos, ArBF 2 : [25]

En la hidroboración , los alquenos se insertan en enlaces BH de borano, con estereoquímica anti-Markovnikov . La hidroboración ocurre estereoespecíficamente syn — en la misma cara del alqueno. El estado de transición para esta reacción concertada se puede visualizar como un cuadrado con las esquinas ocupadas por carbono, carbono, hidrógeno y boro, maximizando la superposición entre los orbitales p de olefina y el orbital de boro vacío.
La hidroboración con equivalentes de borano (BH 3 ) convierte solo el 33 % de la olefina de partida en producto; los subproductos que contienen boro consumen el resto. El efecto quelante mejora esa proporción para los reactivos que contienen boro cíclico. Un reactivo de organoboro cíclico común es el 9-BBN . [26] [27]
Las reacciones de borilación catalizadas por metales producen un compuesto de organoboro a partir de enlaces sigma CH alifáticos o aromáticos mediante un catalizador de metal de transición. Un reactivo común es el bis(pinacolato)diboro .
El monóxido de carbono reacciona con los alquilboranos para formar un carbonilo de borano inestable . Luego, un sustituyente de alquilo migra del boro al carbono carbonílico. Por ejemplo, los alcoholes primarios homologados resultan de organoboranos, monóxido de carbono y un agente reductor (aquí, borohidruro de sodio ): [28]
Los alquinilboranos atacan a los electrófilos para dar transalquenilboranos , [29] como en el primer paso de esta síntesis de olefinas:
La propiedad clave de los organoboranos (R 3 B) y los boratos (R 4 B − , generados mediante la adición de R − a R 3 B) es su susceptibilidad a la reorganización. Estos compuestos poseen enlaces boro-carbono polarizados hacia el carbono. El carbono unido al boro es nucleófilo; [30] en los boratos, la nucleoficidad es suficiente para la transferencia intermolecular a un electrófilo. [31] [3]
Los boranos por sí solos generalmente no son lo suficientemente nucleofílicos como para transferir un grupo R intermolecularmente. En cambio, el grupo 1,2-migra a un carbono electrofílico unido al boro, especialmente si ese carbono está insaturado o tiene un buen grupo saliente: [31]
La propensión a la migración de un grupo orgánico depende de su capacidad para estabilizar la carga negativa: alquinilo > arilo ≈ alquenilo > alquilo primario > alquilo secundario > alquilo terciario. [32] El bis(norbornil)borano y el 9-BBN suelen ser reactivos de hidroboración por este motivo: solo es probable que la olefina hidroborada migre tras la activación nucleofílica.
La migración conserva la configuración en el carbono migrante [33] y la invierte en el extremo (presumiblemente hibridado sp 3 ). [34] El borano reorganizado resultante puede luego oxidarse o protolizarse hasta obtener un producto final.
Los organoboranos son inestables a los ácidos de Brønsted-Lowry y se desboronan a favor de un protón. En consecuencia, los organoboranos se eliminan fácilmente de un sustrato de alcano o alqueno, como en el segundo paso de esta síntesis de olefinas: [29]
Los α-haloenolatos son nucleófilos comunes en la reorganización del borano. Después del ataque nucleofílico al boro, el cetoboronato resultante elimina el halógeno y se tautomeriza a un enolborano neutro. Luego, se obtiene un compuesto carbonílico funcionalizado a partir de la protonólisis [35] o la extinción con otros electrófilos:
Debido a que la migración es estereoespecífica, este método sintetiza cetonas α-alquil o -aril enantiopuras. [36]
Los enolatos de α-haloéster se agregan de manera similar a los boranos, pero con rendimientos más bajos: [37]
Los diazoésteres y diazocetonas eliminan el requisito de una base externa. [38] Los α,α'-dihalo enolatos reaccionan con boranos para formar compuestos de α-halo carbonilo que pueden funcionalizarse aún más en la posición α. [39]
En la alilboración, un alilborano se añade a través de un aldehído o cetona con un desplazamiento alílico y luego puede convertirse en un alcohol homoalílico durante el procesamiento . La reacción es mucho más lenta con cetonas que con aldehídos. [40] Por ejemplo, en la síntesis de epotilonas de Nicolaou , la alilboración asimétrica (con un alilborano derivado del alfa-pineno quiral) es el primer paso en una homologación de dos carbonos a acetogenina : [41]
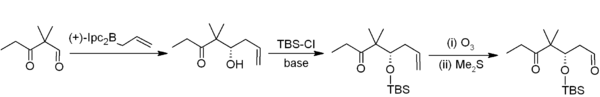
Las sales de trifluoroborato son más estables que los ácidos borónicos y alquilan selectivamente los aldehídos : [42]

El par de reacciones de hidroboración-oxidación oxida el borano a un alcohol con peróxido de hidrógeno o a un grupo carbonilo con óxido de cromo .
La oxidación de un alquenilborano produce un enol libre de boro. [43]
La activación del organoborano con hidróxido o alcóxido y el tratamiento con X 2 produce haloalcanos. Con un exceso de base, dos de los tres grupos alquilo unidos al átomo de boro pueden convertirse en haluro, pero el disiamilborano sólo permite la halogenación de la olefina hidroborada: [44]
El tratamiento de un alquenilborano con yodo o bromo induce la migración de un grupo orgánico unido al boro. Los grupos alquinilo migran selectivamente, formando eninos después del tratamiento con acetato de sodio y peróxido de hidrógeno: [45]
Los compuestos de organoboro también se transmetalizan fácilmente, especialmente a compuestos de organopaladio . En la reacción de Suzuki , un ácido arílico o vinílico borónico se acopla a un haluro arílico o vinílico a través de un catalizador complejo de paladio(0) : [46]
Los hidruros de borano, como el 9-BBN y el L-selectride (borohidruro de tri( sec-butilo ) de litio), son agentes reductores . Un catalizador asimétrico para las reducciones de carbonilo es el catalizador CBS , que se basa en la coordinación del boro con el oxígeno del carbonilo.
Los alcoholes primarios homologados resultan del tratamiento de organoboranos con monóxido de carbono y un hidruro: [47]
Los alcoholes terciarios con dos grupos idénticos unidos al carbono del alcohol pueden sintetizarse a través de una doble migración de alquinilborano: [43]
Los aniones organoboratos se eliminan por reducción frente a haluros de acilo. En este caso, el borato se generó a partir de tri(ciclopentil)borano y fenillitio; los tres grupos ciclopentilo no migran significativamente: [48]
La química del organoboro tiene valor comercial principalmente en la industria farmacéutica.
Se utilizó trietilborano para encender el combustible JP-7 de los motores de ciclo variable Pratt & Whitney J58 que impulsaban el Lockheed SR-71 Blackbird .
Los compuestos organoborónicos se han debatido durante mucho tiempo para su uso como agentes de suministro de boro en la terapia de captura de neutrones para el cáncer . [49]