
Un anestésico general (o anestésico ) es un fármaco que provoca una pérdida reversible del conocimiento . [2] Estos medicamentos generalmente son administrados por un anestesista/ anestesiólogo para inducir o mantener la anestesia general para facilitar la cirugía .
Los anestésicos generales se han utilizado ampliamente en cirugía desde 1842, cuando Crawford Long administró por primera vez éter dietílico a un paciente y realizó una operación indolora. Durante mucho tiempo se ha creído que los anestésicos generales ejercen sus efectos (analgesia, inconsciencia, inmovilidad) [3] a través de un mecanismo mediado por membrana o modulando directamente la actividad de las proteínas de membrana en la membrana neuronal. En general, diferentes anestésicos exhiben diferentes mecanismos de acción, de modo que existen numerosos objetivos moleculares no excluyentes en todos los niveles de integración dentro del sistema nervioso central . [4] Sin embargo, para ciertos anestésicos intravenosos, como el propofol y el etomidato , se cree que el principal objetivo molecular es el receptor GABA A , y que determinadas subunidades β desempeñan un papel crucial. [5] [6] [7]
El concepto de interacciones específicas entre receptores y fármacos introducido por primera vez por Paul Ehrlich en 1897 [8] establece que los fármacos actúan sólo cuando están unidos a sus objetivos (receptores). [1] La identificación de objetivos moleculares concretos para los anestésicos generales sólo fue posible con el desarrollo moderno de técnicas de biología molecular para mutaciones de aminoácidos individuales en proteínas de ratones genéticamente modificados . [1] [5] [6] [7]

Emil Harless y Ernst von Bibra propusieron por primera vez un mecanismo no específico de acción anestésica general en 1847. [9] Sugirieron que los anestésicos generales pueden actuar disolviéndose en la fracción grasa de las células cerebrales y eliminando sus constituyentes grasos, cambiando así la actividad de los anestésicos generales. células cerebrales e inducir anestesia. En 1899 Hans Horst Meyer publicó la primera evidencia experimental de que la potencia anestésica está relacionada con la solubilidad en lípidos. [10] [11] Dos años más tarde , Charles Ernest Overton publicó de forma independiente una teoría similar . [12]
Meyer comparó la potencia de muchos agentes, definidos como el recíproco de la concentración molar requerida para inducir la anestesia en renacuajos, con su coeficiente de partición aceite de oliva/agua . Encontró una relación casi lineal entre la potencia y el coeficiente de partición para muchos tipos de moléculas anestésicas como alcoholes , aldehídos , cetonas , éteres y ésteres . La concentración de anestésico requerida para inducir la anestesia en el 50% de una población de animales (la CE 50 ) fue independiente del medio por el cual se administró el anestésico, es decir, la fase gaseosa o acuosa. [10] [11] [13]
Meyer y Overton habían descubierto la sorprendente correlación entre las propiedades físicas de las moléculas de anestésico general y su potencia: cuanto mayor es la liposolubilidad de un compuesto en el aceite de oliva, mayor es su potencia anestésica. [13] Esta correlación es cierta para una amplia gama de anestésicos con solubilidades lipídicas que oscilan entre 4 y 5 órdenes de magnitud si se utiliza aceite de oliva como fase oleosa. Esta correlación se puede mejorar considerablemente en términos tanto de la calidad de la correlación como del mayor rango de anestésicos si se utiliza octanol a granel [14] o una bicapa lipídica fluida completamente hidratada [15] [16] [17] [18] como base. Fase "petróleo". También se observó que los anestésicos volátiles tienen efectos aditivos (una mezcla de media dosis de dos anestésicos volátiles diferentes produjo el mismo efecto anestésico que una dosis completa de cualquiera de los fármacos solos).
El sitio anestésico mejor caracterizado que representa la correlación de Meyer-Overton reside en los dominios lipídicos ordenados. Los anestésicos se adhieren de forma no específica a la superficie de un sitio de unión específico del palmitato dentro de la membrana lipídica, desplazando al palmitato de los lípidos GM1 ordenados. El proceso da lugar a un componente de la anestesia mediada por membrana . [19] Se demostró un mecanismo similar para la luciferasa. [20] Los anestésicos se unieron de forma no específica a una superficie hidrófoba y compitieron con la unión específica de la luciferina. Sin embargo, la luciferasa no es fisiológicamente relevante para los vertebrados ya que no se expresa endógenamente en los vertebrados.

A partir de la correlación entre la solubilidad en lípidos y la potencia anestésica, tanto Meyer como Overton habían supuesto un mecanismo unitario de anestesia general. Supusieron que la solubilización del anestésico general lipófilo en la bicapa lipídica de la neurona provoca su mal funcionamiento y efecto anestésico cuando se alcanza una concentración crítica de anestésico. Más tarde, en 1973, Miller y Smith sugirieron la hipótesis del volumen crítico, también llamada hipótesis de expansión de la bicapa lipídica. [21] Supusieron que las moléculas anestésicas voluminosas e hidrofóbicas se acumulan dentro de las regiones hidrofóbicas (o lipófilas) de la membrana lipídica neuronal, provocando su distorsión y expansión (engrosamiento) debido al desplazamiento de volumen. La acumulación de cantidades críticas de anestésico provoca un engrosamiento de la membrana suficiente como para alterar reversiblemente la función de los canales iónicos de la membrana, proporcionando así un efecto anestésico. La estructura química real del agente anestésico per se no es importante, pero su volumen molecular juega el papel principal: cuanto más espacio ocupa el anestésico dentro de la membrana, mayor es el efecto anestésico. Basándose en esta teoría, Mullins en 1954 sugirió que la correlación de Meyer-Overton con la potencia puede mejorarse si se tienen en cuenta los volúmenes moleculares de las moléculas anestésicas. [22] Esta teoría existió durante más de 60 años y fue respaldada por el hecho experimental de que los aumentos en la presión atmosférica invierten el efecto anestésico ( efecto de inversión de presión ). [21] [23] [24]
Luego surgieron otras teorías fisicoquímicas de la acción anestésica que tenían en cuenta la diversa naturaleza química de los anestésicos generales y sugerían que el efecto anestésico se ejerce a través de alguna perturbación de la bicapa lipídica. [25] Se propusieron varios tipos de perturbaciones de la bicapa para causar un efecto anestésico, incluidos (1) cambios en la separación de fases, (2) cambios en el espesor de la bicapa, (3) cambios en los parámetros de orden o (4) cambios en la elasticidad de la curvatura. [26] [27] [28]
Según la teoría de la separación de fases lateral [28], los anestésicos ejercen su acción fluidificando las membranas nerviosas hasta un punto en el que desaparecen las separaciones de fases en las regiones lipídicas críticas. Esta fluidización inducida por anestésicos hace que las membranas sean menos capaces de facilitar los cambios conformacionales en las proteínas que pueden ser la base de eventos de membrana como la activación de iones, la liberación de transmisores sinápticos y la unión del transmisor a los receptores. Técnicas más recientes con imágenes de súper resolución muestran que los anestésicos no superan la separación de fases: la separación de fases persiste. Los lípidos más bien saturados dentro de la separación de fases pueden sufrir transiciones de ordenadas a desordenadas que se ven dramáticamente afectadas por los anestésicos. No obstante, ahora se ha demostrado que el concepto de proteínas que se mueven entre lípidos separados en fases en respuesta a la anestesia es correcto. [29]
En general, se pensaba que todas estas primeras teorías sobre los lípidos adolecían de cuatro debilidades [1] (la descripción completa con las refutaciones se encuentra en las secciones siguientes):
Se pensó que la correlación entre la solubilidad en lípidos y la potencia de los anestésicos generales era una condición necesaria pero insuficiente para inferir un sitio objetivo de lípidos. Los anestésicos generales también podrían unirse a sitios diana hidrofóbicos en proteínas en el cerebro, pero dada la diversidad química de los anestésicos, esto probablemente necesitaría incluir más de un sitio y esos sitios no excluirían inherentemente un sitio en la membrana. En el caso de las proteínas, una de las razones por las que los anestésicos generales más polares podrían ser menos potentes es que tienen que cruzar la barrera hematoencefálica para ejercer su efecto sobre las neuronas del cerebro.

Hay dos hipótesis modernas sobre lípidos que no son excluyentes con la unión directa a proteínas. La hipótesis más reciente postula que los lípidos ordenados en la membrana plasmática contienen un sitio de unión estructurado para el palmitato de lípidos . Es un sitio de unión de lípidos dentro de una estructura lipídica, no una estructura proteica. Las proteínas que contienen un palmitato unido covalentemente ( palmitoilación ) se dirigen a los lípidos ordenados a través de una interacción lípido-lípido específica. La unión del palmitato al dominio lipídico depende del colesterol y la célula regula la proteína mediante localización nanoscópica. Los anestésicos actúan uniéndose de forma no específica al sitio de unión del palmitato, lo que altera la capacidad del colesterol para unirse y secuestrar la proteína a un estado inactivo. Pavel y sus colegas demostraron experimentalmente este mecanismo mediado por membrana en 2020. Demostraron que la enzima fosfolipasa D2 (PLD2) es sensible a los anestésicos y activa el canal de potasio TREK-1 a través de un mecanismo mediado por membrana . Los anestésicos desplazaron a PLD2 de los dominios lipídicos ordenados, permitiendo que la enzima se activara mediante la presentación del sustrato y activara el canal. [29] [30]
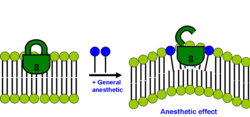
La segunda hipótesis de los lípidos establece que el efecto anestésico se produce si la solubilización del anestésico general en la bicapa provoca una redistribución de las presiones laterales de la membrana. [31] [32]
Cada membrana bicapa tiene un perfil distinto de cómo se distribuyen las presiones laterales dentro de ella. La mayoría de las proteínas de membrana (especialmente los canales iónicos) son sensibles a los cambios en este perfil de distribución de presión lateral. Estas tensiones laterales son bastante grandes y varían con la profundidad dentro de la membrana. Según la hipótesis moderna de los lípidos, un cambio en el perfil de presión lateral de la membrana cambia el equilibrio conformacional de ciertas proteínas de la membrana que se sabe que se ven afectadas por concentraciones clínicas de anestésicos, como los canales iónicos activados por ligandos. Este mecanismo también es inespecífico porque la potencia del anestésico no está determinada por su estructura química real, sino por la distribución posicional y orientacional de sus segmentos y enlaces dentro de la bicapa.
En 1997, Cantor sugirió un mecanismo detallado de anestesia general basado en la termodinámica estadística reticular. [32] Se propuso que la incorporación de solutos anfifílicos y otros solutos interfacialmente activos (por ejemplo, anestésicos generales) en la bicapa aumenta selectivamente la presión lateral cerca de las interfaces acuosas, lo que se compensa con una disminución de la presión lateral hacia el centro de la bicapa. Los cálculos mostraron que la anestesia general probablemente implica la inhibición de la apertura del canal iónico en una proteína de membrana dependiente de ligando postsináptico [32] mediante el siguiente mecanismo:

Por lo tanto, según la hipótesis moderna de los lípidos, los anestésicos no actúan directamente sobre sus objetivos proteicos de membrana, sino que perturban matrices lipídicas especializadas en la interfaz proteína-lípido, que actúan como mediadores. Este es un nuevo tipo de mecanismo de transducción, diferente de la interacción habitual entre ligando y receptor, donde el anestésico (ligando) afecta la función de las proteínas de la membrana uniéndose al sitio específico de la proteína. Por tanto, se propone que algunas proteínas de membrana sean sensibles a su entorno lipídico. Ese mismo año se propuso un mecanismo molecular detallado ligeramente diferente sobre cómo la perturbación de la bicapa puede influir en el canal iónico. La oleamida (amida de ácido graso del ácido oleico) es un anestésico endógeno que se encuentra in vivo (en el cerebro del gato) y se sabe que potencia el sueño y reduce la temperatura del cuerpo al cerrar la conexión del canal de unión gap. [33] El mecanismo detallado se muestra en la imagen: el anillo bien ordenado de lípidos (verde)/colesterol (amarillo) que existe alrededor de la conexión (magenta) se desordena con el tratamiento con anestésico (triángulos rojos), lo que promueve el cierre de la conexión. canal. Esto disminuye la actividad cerebral e induce letargo y efecto anestésico. Recientemente, las imágenes de súper resolución mostraron evidencia experimental directa de que los anestésicos volátiles alteran los dominios lipídicos ordenados como se predijo. [34] En el mismo estudio, surgió un mecanismo relacionado donde los anestésicos liberaron la enzima fosfolipasa D (PLD) de los dominios lipídicos y la enzima se unió al canal TREK-1 y lo activó mediante la producción de ácido fosfatídico. Estos resultados demostraron experimentalmente que la membrana es un objetivo fisiológicamente relevante de los anestésicos generales.

A principios de la década de 1980, Nicholas P. Franks y William R. Lieb [35] demostraron que la correlación Meyer-Overton puede reproducirse utilizando una proteína soluble. Descubrieron que dos clases de proteínas se inactivan con dosis clínicas de anestésico en ausencia total de lípidos. Estas son las luciferasas , que son utilizadas por animales y bacterias bioluminiscentes para producir luz, [36] y el citocromo P450 , [37] que es un grupo de proteínas hemo que hidroxilan un grupo diverso de compuestos, incluidos ácidos grasos , esteroides y xenobióticos como como fenobarbital . Sorprendentemente, la inhibición de estas proteínas por los anestésicos generales se correlacionó directamente con sus potencias anestésicas. La inhibición de la luciferasa también presenta un límite de alcohol de cadena larga, que está relacionado con el tamaño de la bolsa de unión del anestésico. [38]
Estas observaciones fueron importantes porque demostraron que los anestésicos generales ejercen su efecto de forma no específica, incluso cuando se unen a proteínas. Esto también abrió la posibilidad de que los anestésicos pudieran funcionar mediante la unión directa a las proteínas, en lugar de afectar indirectamente a las proteínas de la membrana a través de interacciones no específicas con la bicapa lipídica como mediadora. [14] [39] Se demostró que los anestésicos alteran las funciones de muchas proteínas de señalización citoplasmáticas, incluida la proteína quinasa C , [40] [41]
Sin embargo, las proteínas consideradas los objetivos moleculares más probables de los anestésicos son los canales iónicos. Según esta teoría, los anestésicos generales son mucho más selectivos que en el marco de la hipótesis de los lípidos y se unen directamente sólo a un pequeño número de objetivos en el sistema nervioso central, principalmente canales iónicos activados por ligandos en las sinapsis y receptores acoplados a proteínas G, alterando su flujo iónico. . En particular, los receptores Cys-loop [42] son objetivos plausibles para los anestésicos generales que se unen en la interfaz entre las subunidades. La superfamilia de receptores Cys-loop incluye receptores inhibidores ( receptores GABA A , receptores GABA C , receptores de glicina ) y receptores excitadores ( receptor nicotínico de acetilcolina y receptor de serotonina 5-HT3 ). Los anestésicos generales pueden inhibir las funciones de los canales de los receptores excitadores o potenciar las funciones de los receptores inhibidores, respectivamente.
La ubicación de los sitios de unión no específicos en los canales iónicos sigue siendo una cuestión importante en este campo. En particular, ¿cómo un compuesto que sigue a Overton-Meyer provoca directamente un cambio conformacional en la proteína? Normalmente, la regulación alostérica implica un cambio en la forma de la proteína que se adapta a la unión del ligando. Este mecanismo es distinto del mecanismo de la luciferasa. Una segunda pregunta importante: ¿cómo se conservan los sitios de unión a proteínas no específicos entre especies y por qué generalmente inhiben los receptores excitadores y potencian los receptores inhibidores?
Varios estudios experimentales y computacionales han demostrado que los anestésicos generales podrían alterar la dinámica en los bucles flexibles que conectan las hélices α en un haz y están expuestos a la interfaz membrana-agua de los receptores Cys-loop. [43] [44] [45] [46] [47] [48] Sin embargo, las principales bolsas de unión de los anestésicos generales se encuentran dentro de los haces transmembrana de cuatro hélices α de los receptores Cys-loop. [49] [50] [51]

El receptor GABA A (GABA A R) es un receptor ionotrópico activado por el neurotransmisor inhibidor ácido γ-aminobutírico (GABA). La activación del receptor GABA A conduce a la entrada de iones cloruro , lo que provoca la hiperpolarización de las membranas neuronales. [52] El receptor GABA A ha sido identificado como el principal objetivo de los anestésicos intravenosos como el propofol y el etomidato . [4] [5] El sitio de unión del propofol en los receptores GABA A de los mamíferos se ha identificado mediante fotomarcaje utilizando un derivado de diazirina . [53] La fuerte activación de la conductancia del receptor tónico GABA A por concentraciones clínicas de propofol se ha confirmado con registros electrofisiológicos de neuronas CA1 del hipocampo en cortes de cerebro de ratas adultas . [54] Los receptores GABA A que contienen subunidades β3 son los principales objetivos moleculares de las acciones anestésicas del etomidato , mientras que los receptores GABA A que contienen β2 participan en la sedación provocada por este fármaco. [55] Los experimentos electrofisiológicos con concentraciones amnésicas de etomidato también han demostrado una mejora de la conductancia tónica GABA A de las neuronas piramidales CA1 en cortes del hipocampo. [56] También se ha demostrado una potente activación de la inhibición mediada por el receptor GABA A , con la consiguiente fuerte depresión de las tasas de activación de las neuronas neocorticales, para concentraciones clínicas de anestésicos volátiles como isoflurano , enflurano y halotano . [57]
Es poco probable que la mejora de la actividad del receptor GABA A sea el único mecanismo que explique la amplia gama de efectos conductuales de los anestésicos generales. [1] La acumulación de datos experimentales sugiere que la modulación de los canales de potasio con dominio de dos poros , [58] [59] o los canales de sodio dependientes de voltaje [60] también pueden explicar algunas de las acciones de los agentes anestésicos volátiles. Alternativamente, la inhibición de los receptores de N-metil-D-aspartato activados por glutamato mediante ketamina , xenón y óxido nitroso proporciona un mecanismo de acción acorde con un perfil analgésico predominante. [1]
Los estereoisómeros que representan imágenes especulares entre sí se denominan enantiómeros o isómeros ópticos (por ejemplo, los isómeros de R-(+)- y S-(-)-etomidato). [1] Los efectos fisicoquímicos de los enantiómeros son siempre idénticos en un entorno aquiral (por ejemplo, en la bicapa lipídica). Sin embargo, los enantiómeros in vivo de muchos anestésicos generales (por ejemplo, isoflurano , tiopental , etomidato ) pueden diferir mucho en su potencia anestésica a pesar de los coeficientes de partición petróleo/gas similares. [61] [62] Por ejemplo, el isómero R-(+) del etomidato es un anestésico 10 veces más potente que su isómero S-(-). [1] Esto significa que los isómeros ópticos se dividen de manera idéntica en lípidos, pero tienen efectos diferenciales en los canales iónicos y la transmisión sináptica . Esta objeción proporciona una evidencia convincente de que el objetivo principal de los anestésicos no es la bicapa lipídica aquiral en sí, sino los sitios de unión estereoselectiva en las proteínas de la membrana que proporcionan un entorno quiral para interacciones específicas de acoplamiento entre el anestésico y la proteína. [1]
Refutación a la objeción: 1) Nunca se consideró el transporte estereoselectivo del anestésico. Los anestésicos son hidrofóbicos y se transportan unidos a proteínas en la sangre. Cualquier unión estereoselectiva a la proteína transportadora cambiaría la concentración en el sitio de acción. Además, un sumidero de proteínas en la membrana podría unirse ligeramente mejor a uno de los isómeros y reducir la concentración efectiva que experimenta la membrana. Todos los estereoisómeros son anestésicos eficaces, solo cambiaron la sensibilidad, lo que sugiere que se debe considerar el transporte selectivo y los sumideros de proteínas selectivos. 2) Los lípidos son quirales, al igual que las proteínas. Y al igual que las proteínas, los lípidos tienen regiones ordenadas y desordenadas. [63] [64] El campo no pudo investigar la quiralidad de los lípidos ordenados debido a la falta de conocimiento de su existencia.
Todos los anestésicos generales inducen la inmovilización (ausencia de movimiento en respuesta a estímulos nocivos) mediante la depresión de las funciones de la médula espinal, mientras que sus acciones amnésicas se ejercen dentro del cerebro. Según la correlación de Meyer-Overton la potencia anestésica del fármaco es directamente proporcional a su liposolubilidad; sin embargo, existen muchos compuestos que no cumplen esta regla. Estos fármacos son sorprendentemente similares a los anestésicos generales potentes y se prevé que sean anestésicos potentes basándose en su solubilidad en lípidos, pero ejercen sólo un componente de la acción anestésica (amnesia) y no suprimen el movimiento (es decir, no deprimen las funciones de la médula espinal) como lo hacen los anestésicos generales potentes. todos los anestésicos lo hacen. [65] [66] [67] [68] Estos medicamentos se denominan no inmovilizadores. La existencia de no inmovilizadores sugiere que los anestésicos inducen diferentes componentes del efecto anestésico (amnesia e inmovilidad) al afectar diferentes objetivos moleculares y no sólo uno (bicapa neuronal) como se creía anteriormente. [69] Un buen ejemplo de no inmovilizadores son los alcanos halogenados que son muy hidrofóbicos, pero no logran suprimir el movimiento en respuesta a estimulación nociva en concentraciones apropiadas. Ver también: flurotilo .
Refutación a la objeción: Ésta es una falacia lógica. La hipótesis no requiere que cada molécula jamás probada obedezca la hipótesis para que la hipótesis sea verdadera. La existencia de menos de 10 a 20 compuestos relacionados que se sabe que desobedecen la hipótesis de Meyer-Overton no niega de ninguna manera los cientos, si no miles, de compuestos químicamente diversos que sí obedecen a la hipótesis de Overton-Meyer. Pueden existir excepciones por razones no relacionadas con el mecanismo subyacente a la hipótesis de Meyer-Overton.
Los estudios experimentales han demostrado que los anestésicos generales, incluido el etanol, son potentes fluidificantes de membranas naturales y artificiales. Sin embargo, los cambios en la densidad y fluidez de la membrana en presencia de concentraciones clínicas de anestésicos generales son tan pequeños que aumentos relativamente pequeños de temperatura (~1 °C) pueden imitarlos sin causar anestesia. [70] El cambio en la temperatura corporal de aproximadamente 1 °C está dentro del rango fisiológico y claramente no es suficiente para inducir la pérdida del conocimiento per se. Así, las membranas se fluidizan sólo con grandes cantidades de anestésicos, pero no hay cambios en la fluidez de la membrana cuando las concentraciones de anestésicos son pequeñas y restringidas a lo farmacológicamente relevante.
Refutación a la objeción: Los primeros estudios sólo consideraron la fluidez de la membrana lipídica en masa. Trabajos recientes han demostrado que pueden ocurrir cambios de temperatura de varios grados en dominios lipídicos nanoscópicos ordenados. [71] Además, la fluidez está regulada activamente por las desaturasas de ácidos grasos . Y, por último, la competencia de los anestésicos con las proteínas palmitoiladas se produce independientemente de la temperatura y a pesar del aumento de los lípidos ordenados. [29]
Según la correlación de Meyer-Overton, en una serie homóloga de cualquier anestésico general (por ejemplo, n - alcoholes o alcanos), el aumento de la longitud de la cadena aumenta la solubilidad lipídica y, por lo tanto, debería producir un aumento correspondiente en la potencia anestésica. Sin embargo, a partir de una determinada longitud de cadena el efecto anestésico desaparece. Para los n -alcoholes, este límite se produce en una longitud de cadena de carbonos de aproximadamente 13 [72] y para los n -alcanos en una longitud de cadena de entre 6 y 10, dependiendo de la especie. [73]

Si los anestésicos generales alteran los canales iónicos al dividirse y perturbar la bicapa lipídica, entonces se esperaría que su solubilidad en las bicapas lipídicas también mostrara el efecto de corte. Sin embargo, la partición de alcoholes en bicapas lipídicas no muestra un límite para los alcoholes de cadena larga de n - decanol a n - pentadecanol . Una gráfica de la longitud de la cadena frente al logaritmo del coeficiente de partición K de la bicapa lipídica/tampón es lineal, y la adición de cada grupo metileno provoca un cambio en la energía libre de Gibbs de -3,63 kJ/mol.
El efecto de corte se interpretó inicialmente como evidencia de que los anestésicos ejercen su efecto no actuando globalmente sobre los lípidos de la membrana sino más bien uniéndose directamente a bolsas hidrofóbicas de volúmenes bien definidos en las proteínas. A medida que crece la cadena alquílica , el anestésico llena una mayor parte de la bolsa hidrófoba y se une con mayor afinidad. Cuando la molécula es demasiado grande para ser acomodada por completo en la bolsa hidrófoba, la afinidad de unión ya no aumenta al aumentar la longitud de la cadena. Por tanto, el volumen de la cadena de n-alcanol en la longitud de corte proporciona una estimación del volumen del sitio de unión. Esta objeción proporcionó la base para la hipótesis de las proteínas sobre el efecto anestésico (ver más abajo).

Sin embargo, el efecto de corte todavía puede explicarse en el marco de la hipótesis de los lípidos. [31] [74] En los alcanoles de cadena corta (A), los segmentos de la cadena son bastante rígidos (en términos de entropía conformacional) y muy cercanos al grupo hidroxilo unido a la región interfacial acuosa ("boya"). En consecuencia, estos segmentos redistribuyen eficientemente las tensiones laterales desde el interior de la bicapa hacia la interfaz. En los alcanoles de cadena larga (B), los segmentos de la cadena de hidrocarburos están ubicados más lejos del grupo hidroxilo y son más flexibles que en los alcanoles de cadena corta. La eficiencia de la redistribución de la presión disminuye a medida que aumenta la longitud de la cadena de hidrocarburos hasta que en algún momento se pierde la potencia anestésica. Se propuso que los polialcanoles (C) tendrán un efecto anestésico similar a los 1-alcanoles de cadena corta si la longitud de la cadena entre dos grupos hidroxilo vecinos es menor que el límite. [75] Esta idea fue respaldada por la evidencia experimental porque los polihidroxialcanos 1,6,11,16-hexadecanetetraol y 2,7,12,17-octadecanetetraol exhibieron una potencia anestésica significativa como se propuso originalmente. [74]
Refutación a la objeción: El argumento supone que todas las clases de anestésicos deben actuar de la misma manera sobre la membrana. Es muy posible que una o dos clases de moléculas puedan funcionar mediante un mecanismo no mediado por membranas. Por ejemplo, se demostró que los alcoholes se incorporan a la membrana lipídica mediante una reacción enzimática de transfosfatidilación. [76] El metabolito del etanol se unió a un canal anestésico e lo inhibió. Y si bien este mecanismo puede contradecir un único mecanismo unitario de anestesia, no excluye uno mediado por membrana.