El nitrato de plomo (II) es un compuesto inorgánico con la fórmula química Pb ( NO 3 ) 2 . Se presenta comúnmente como un cristal incoloro o un polvo blanco y, a diferencia de la mayoría de las otras sales de plomo (II) , es soluble en agua .
Conocido desde la Edad Media con el nombre de plumbum dulce , la producción de nitrato de plomo (II) a partir de plomo metálico u óxido de plomo en ácido nítrico era a pequeña escala, para su uso directo en la fabricación de otros compuestos de plomo . En el siglo XIX, el nitrato de plomo (II) comenzó a producirse comercialmente en Europa y Estados Unidos. Históricamente, el uso principal era como materia prima en la producción de pigmentos para pinturas de plomo , pero dichas pinturas han sido reemplazadas por pinturas menos tóxicas basadas en dióxido de titanio . Otros usos industriales incluían la estabilización térmica en nailon y poliésteres , y en recubrimientos de papel fototermográfico . Desde aproximadamente el año 2000, el nitrato de plomo (II) ha comenzado a usarse en la cianuración de oro .
El nitrato de plomo (II) es tóxico y debe manipularse con cuidado para evitar su inhalación, ingestión y contacto con la piel. Debido a su naturaleza peligrosa , las aplicaciones limitadas del nitrato de plomo (II) están bajo constante escrutinio.
El nitrato de plomo fue identificado por primera vez en 1597 por el alquimista Andreas Libavius , quien llamó a la sustancia plumbum dulce , que significa "plomo dulce", debido a su sabor. [5] Se produce comercialmente por reacción de plomo metálico con ácido nítrico concentrado en el que es escasamente soluble. [6] [7] Se ha producido como materia prima para hacer pigmentos como el amarillo de cromo (cromato de plomo (II), PbCrO 4 ) y el naranja de cromo (cromato básico de plomo (II), Pb 2 CrO 5 ) y el amarillo de Nápoles . Estos pigmentos se usaban para teñir e imprimir percal y otros textiles. [8] Se ha utilizado como oxidante en pólvora negra y junto con azida de plomo en explosivos especiales . [9]
El nitrato de plomo se produce por reacción del óxido de plomo (II) con ácido nítrico concentrado: [10]
También se puede obtener por evaporación de la solución obtenida al reaccionar plomo metálico con ácido nítrico diluido . [11]
En el procesamiento de los desechos de plomo y bismuto de las refinerías de plomo se forman soluciones y cristales de nitrato de plomo (II) . [12]
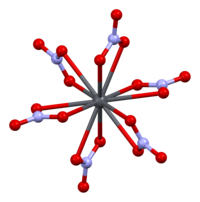
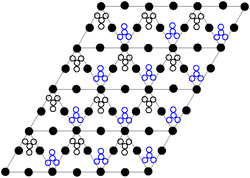
La estructura cristalina del nitrato de plomo (II) sólido se ha determinado mediante difracción de neutrones . [13] [14] El compuesto cristaliza en el sistema cúbico con los átomos de plomo en un sistema cúbico centrado en las caras . Su grupo espacial es Pa3 Z=4 ( notación reticular de Bravais ), con cada lado del cubo con una longitud de 784 picómetros .
Los puntos negros representan los átomos de plomo, los puntos blancos los grupos de nitratos 27 picómetros por encima del plano de los átomos de plomo, y los puntos azules los grupos de nitratos a la misma distancia por debajo de este plano. En esta configuración, cada átomo de plomo está unido a doce átomos de oxígeno ( longitud de enlace : 281 pm). Todas las longitudes de enlace N–O son idénticas, 127 picómetros. [15]
El interés de la investigación sobre la estructura cristalina del nitrato de plomo (II) se basó en parte en la posibilidad de una rotación interna libre de los grupos nitrato dentro de la red cristalina a temperaturas elevadas, pero esto no se materializó. [14]
El nitrato de plomo se descompone al calentarlo, una propiedad que se ha utilizado en pirotecnia . [9] Es soluble en agua y ácido nítrico diluido.
Los nitratos básicos se forman cuando se añade álcali a una solución. El Pb2 ( OH) 2 (NO3 ) 2 es la especie predominante formada a pH bajo. A pH más alto se forma Pb6(OH)5(NO3). [ 17 ] El catión [ Pb6O ( OH) 6 ] 4+ es inusual porque tiene un ion óxido dentro de un grupo de 3 tetraedros de PbO4 que comparten caras . [18] No hay evidencia de la formación del hidróxido, Pb(OH) 2 , en solución acuosa a un pH inferior a 12.
Las soluciones de nitrato de plomo se pueden utilizar para formar complejos de coordinación. El plomo (II) es un aceptor duro ; forma complejos más fuertes con ligandos donantes de electrones de nitrógeno y oxígeno . Por ejemplo, la combinación de nitrato de plomo y pentaetilenglicol (EO 5 ) en una solución de acetonitrilo y metanol seguida de una evaporación lenta produjo el compuesto [Pb(NO 3 ) 2 (EO 5 )]. [19] En la estructura cristalina de este compuesto, la cadena EO 5 está enrollada alrededor del ion plomo en un plano ecuatorial similar al de un éter corona . Los dos ligandos de nitrato bidentados están en configuración trans . El número de coordinación total es 10, con el ion plomo en una geometría molecular de antiprisma cuadrado bicapipado .
El complejo formado por el nitrato de plomo con un ligando bidentado bitiazol N-donador es binuclear. La estructura cristalina muestra que el grupo nitrato forma un puente entre dos átomos de plomo. [20] Un aspecto interesante de este tipo de complejos es la presencia de un hueco físico en la esfera de coordinación ; es decir, los ligandos no están colocados simétricamente alrededor del ion metálico. Esto se debe potencialmente a un par solitario de electrones de plomo, que también se encuentra en complejos de plomo con un ligando imidazol . [21]
El nitrato de plomo se ha utilizado como estabilizador térmico en nailon y poliésteres, como revestimiento para papel fototermográfico y en raticidas . [10]
Calentar nitrato de plomo es un medio conveniente para producir dióxido de nitrógeno.
En el proceso de cianuración del oro , la adición de una solución de nitrato de plomo (II) mejora el proceso de lixiviación . Solo se requieren cantidades limitadas (entre 10 y 100 miligramos de nitrato de plomo por kilogramo de oro). [22] [23]
En química orgánica, se puede utilizar en la preparación de isotiocianatos a partir de ditiocarbamatos . [24] Se ha informado de su uso como eliminador de bromuro durante la sustitución S N 1. [25]
El nitrato de plomo (II) es tóxico y su ingestión puede provocar una intoxicación aguda por plomo, como ocurre con todos los compuestos solubles de plomo. [26] La Agencia Internacional para la Investigación sobre el Cáncer (IARC) clasifica todos los compuestos inorgánicos de plomo como probablemente cancerígenos para los seres humanos (categoría 2A). [27] Se han relacionado con el cáncer renal y el glioma en animales de experimentación y con el cáncer renal, el cáncer cerebral y el cáncer de pulmón en seres humanos, aunque los estudios de trabajadores expuestos al plomo a menudo se complican por la exposición simultánea al arsénico . [28] Se sabe que el plomo sustituye al zinc en varias enzimas , incluida la deshidratasa del ácido δ-aminolevulínico (porfobilinógeno sintasa) en la vía biosintética del hemo y la pirimidina-5′-nucleotidasa , importante para el metabolismo correcto del ADN y, por lo tanto, puede causar daño fetal. [29]
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: otros ( enlace )