Los virus de ARN de cadena negativa ( virus −ssRNA ) son un grupo de virus relacionados que tienen genomas monocatenarios de sentido negativo hechos de ácido ribonucleico (ARN). Tienen genomas que actúan como cadenas complementarias a partir de las cuales se sintetiza el ARN mensajero (ARNm) por la enzima viral ARN polimerasa dependiente de ARN (RdRp). Durante la replicación del genoma viral, RdRp sintetiza un antígeno de sentido positivo que utiliza como plantilla para crear ARN genómico de sentido negativo. Los virus de ARN de cadena negativa también comparten otras características: la mayoría contiene una envoltura viral que rodea la cápside, que encierra el genoma viral, los genomas de los virus −ssRNA suelen ser lineales y es común que su genoma esté segmentado.
Los virus de ARN de cadena negativa constituyen el filo Negarnaviricota , en el reino Orthornavirae y reino Riboviria . Descienden de un ancestro común que era un virus de ARN bicatenario (dsRNA) , y se consideran un clado hermano de los reovirus , que son virus dsRNA. Dentro del filo, hay dos ramas principales que forman dos subfilos: Haploviricotina , cuyos miembros son en su mayoría no segmentados y que codifican un RdRp que sintetiza capuchones en el ARNm, y Polyploviricotina , cuyos miembros están segmentados y que codifican un RdRp que arrebata capuchones de los ARNm del huésped. Se reconocen un total de seis clases en el filo.
Los virus de ARN de cadena negativa están estrechamente asociados con los artrópodos y pueden dividirse informalmente entre aquellos que dependen de los artrópodos para su transmisión y aquellos que descienden de los virus de los artrópodos pero que ahora pueden replicarse en vertebrados sin la ayuda de los artrópodos. Los virus de ARN de cadena negativa más destacados transmitidos por artrópodos incluyen el virus de la fiebre del Valle del Rift y el virus del marchitamiento moteado del tomate . Los virus de ARN de cadena negativa más destacados de vertebrados incluyen el virus del Ébola , los hantavirus , los virus de la gripe , el virus de la fiebre de Lassa y el virus de la rabia .
Negarnaviricota toma la primera parte de su nombre del latín nega , que significa negativo, la parte media rna se refiere al ARN, y la parte final, viricota , es el sufijo utilizado para los filos de virus. El subfilo Haploviricotina toma la primera parte de su nombre, Haplo , del griego antiguo ἁπλός, que significa simple, y 'viricotina es el sufijo utilizado para los subfilos de virus. El subfilo Polyploviricotina sigue el mismo patrón, Polyplo se toma del griego antiguo πολύπλοκος, que significa complejo. [1]

Todos los virus de Negarnaviricota son virus de ARN monocatenario (−ssRNA) de sentido negativo. Tienen genomas hechos de ARN, que son monocatenarios en lugar de bicatenarios. Sus genomas son de sentido negativo, lo que significa que el ARN mensajero (ARNm) puede sintetizarse directamente a partir del genoma por la enzima viral ARN polimerasa dependiente de ARN (RdRp), también llamada ARN replicasa, que está codificada por todos los virus −ssRNA. Excluyendo los virus del género Tenuivirus y algunos de la familia Chuviridae , todos los virus −ssRNA tienen genomas lineales en lugar de circulares, y los genomas pueden estar segmentados o no segmentados. [1] [3] [4] Todos los genomas −ssRNA contienen repeticiones terminales invertidas , que son secuencias de nucleótidos palindrómicas en cada extremo del genoma. [5]
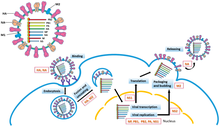
La replicación de los genomas de −ssRNA se ejecuta mediante RdRp, que inicia la replicación uniéndose a una secuencia líder en el extremo 3' (que suele pronunciarse como "tres extremos principales") del genoma. A continuación, RdRp utiliza el genoma de sentido negativo como plantilla para sintetizar un antígeno de sentido positivo. Al replicar el antígeno, RdRp se une primero a la secuencia final en el extremo 3' del antígeno. A continuación, RdRp ignora todas las señales de transcripción en el antígeno y sintetiza una copia del genoma mientras utiliza el antígeno como plantilla. [6] La replicación se ejecuta mientras el genoma está dentro de la nucleocápside, y RdRp revela la cápside y se transloca a lo largo del genoma durante la replicación. A medida que RdRp sintetiza nuevas secuencias de nucleótidos, las proteínas de la cápside se ensamblan y encapsidan el ARN viral recién replicado. [2]
La transcripción del ARNm del genoma sigue el mismo patrón direccional que la producción del antígeno. En la secuencia líder, RdRp sintetiza un ARN líder trifosfato en el extremo 5' (que suele pronunciarse "five prime end") y, en el caso del subfilo Haploviricotina , cubre el extremo 5' o, en el caso del subfilo Polyploviricotina , toma una cubierta de un ARNm hospedador y la adhiere al ARNm viral para que los ribosomas de la célula hospedadora puedan traducirlo . [7] [8] [9]
Después de tapar el ARNm, RdRp inicia la transcripción en una señal de inicio del gen y luego termina la transcripción al alcanzar una señal de fin del gen. [10] Al final de la transcripción, RdRp sintetiza una cola poliadenilada (cola poli (A)) que consiste en cientos de adeninas en el extremo 3 del ARNm, lo que puede hacerse tartamudeando en una secuencia de uracilos . [11] [12] Después de que se construye la cola poli (A), RdRp libera el ARNm. En genomas que codifican más de una porción transcribible, RdRp puede continuar escaneando hasta la siguiente secuencia de inicio para continuar con la transcripción. [10] [7] [13]
Algunos virus −ssRNA son ambisense , lo que significa que tanto la cadena genómica negativa como el antígeno positivo codifican por separado proteínas diferentes. Para transcribir los virus ambisense, se realizan dos rondas de transcripción: primero, el ARNm se produce directamente a partir del genoma; segundo, el ARNm se crea a partir del antígeno. Todos los virus ambisense contienen una estructura de bucle de horquilla para detener la transcripción después de que se haya transcrito el ARNm de la proteína. [14]

Los virus de ARN de cadena negativa contienen un complejo de ribonucleoproteína compuesto por el genoma y una RdRp unida a cada segmento del genoma rodeado por una cápside. [15] La cápside está compuesta por proteínas cuya estructura plegada contiene cinco hélices alfa en el lóbulo N-terminal (motivo 5-H) y tres hélices alfa en el lóbulo C-terminal (motivo 3-H). Dentro de la cápside, el genoma está intercalado entre estos dos motivos. [2] Excluyendo la familia Aspiviridae , los virus de ARN monocatenario contienen una envoltura viral externa , un tipo de membrana lipídica que rodea la cápside. La forma de la partícula viral, llamada virión, de los virus de ARN monocatenario varía y puede ser filamentosa, pleomórfica, esférica o tubular. [16]
La segmentación del genoma es un rasgo destacado entre muchos virus −ssRNA, y los virus −ssRNA varían desde tener genomas con un segmento, típico de los miembros del orden Mononegavirales , hasta genomas con diez segmentos, como es el caso de Tilapia tilapinevirus . [5] [17] No hay una tendencia clara a lo largo del tiempo que determine el número de segmentos, y la segmentación del genoma entre los virus −ssRNA parece ser un rasgo flexible ya que ha evolucionado de forma independiente en múltiples ocasiones. La mayoría de los miembros del subfilo Haploviricotina no están segmentados, mientras que la segmentación es universal en Polyploviricotina . [2] [5]

El análisis filogenético basado en RdRp muestra que los virus −ssRNA descienden de un ancestro común y que probablemente sean un clado hermano de los reovirus , que son virus dsRNA. Dentro del filo, hay dos ramas claras, asignadas a dos subfilos, en función de si RdRp sintetiza una tapa en el ARNm viral o toma una tapa del ARNm del huésped y la adhiere al ARNm viral. [1] [3]
Dentro del filo, los virus −ssRNA que infectan a los artrópodos parecen ser los basales y los ancestros de todos los demás virus −ssRNA. Los artrópodos con frecuencia viven juntos en grupos grandes, lo que permite que los virus se transmitan fácilmente. Con el tiempo, esto ha llevado a que los virus −ssRNA de los artrópodos adquieran un alto nivel de diversidad. Si bien los artrópodos albergan grandes cantidades de virus, existe desacuerdo sobre el grado en que se produce la transmisión entre especies de virus −ssRNA de los artrópodos entre artrópodos. [4] [5]
Los virus ARN monocatenarios de plantas y vertebrados tienden a estar genéticamente relacionados con los virus infectados por artrópodos. Además, la mayoría de los virus ARN monocatenarios fuera de los artrópodos se encuentran en especies que interactúan con ellos. Por lo tanto, los artrópodos sirven como hospedadores clave y vectores de transmisión de los virus ARN monocatenarios. En términos de transmisión, los virus ARN monocatenarios no artrópodos se pueden distinguir entre aquellos que dependen de los artrópodos para su transmisión y aquellos que pueden circular entre vertebrados sin la ayuda de los artrópodos. Es probable que este último grupo se haya originado a partir del primero, adaptándose a la transmisión solo entre vertebrados. [5]
Negarnaviricota pertenece al reino Orthornavirae , que abarca todos los virus de ARN que codifican RdRp, y al reino Riboviria , que incluye Orthornavirae así como todos los virus que codifican la transcriptasa inversa en el reino Pararnavirae . Negarnaviricota contiene dos subfilos, que contienen seis clases combinadas, cinco de las cuales son monotípicas hasta taxones inferiores: [2] [9] [18]

Los virus de ARN de cadena negativa se clasifican como Grupo V en el sistema de clasificación de Baltimore , que agrupa a los virus en función de su forma de producción de ARNm y que suele utilizarse junto con la taxonomía estándar de virus, que se basa en la historia evolutiva. Por lo tanto, el Grupo V y Negarnaviricota son sinónimos. [1]
Los virus de ARN de cadena negativa causaron muchas enfermedades ampliamente conocidas. Muchas de ellas son transmitidas por artrópodos, incluido el virus de la fiebre del Valle del Rift y el virus del marchitamiento moteado del tomate . [19] [20] Entre los vertebrados, los murciélagos y los roedores son vectores comunes de muchos virus, incluido el virus del Ébola y el virus de la rabia , transmitidos por murciélagos y otros vertebrados, [21] [22] y el virus de la fiebre de Lassa y los hantavirus , transmitidos por roedores. [23] [24] Los virus de la influenza son comunes entre las aves y los mamíferos. [25] Los virus de ARN monocatenario específicos de los humanos incluyen el virus del sarampión y el virus de las paperas . [26] [27]
A lo largo de la historia se han conocido muchas enfermedades causadas por virus −ssRNA, incluidas la infección por hantavirus, el sarampión y la rabia. [28] [29] [30] En la historia moderna, algunas como el ébola y la gripe han causado brotes de enfermedades mortales. [31] [32] El virus de la estomatitis vesicular , aislado por primera vez en 1925 y uno de los primeros virus animales en ser estudiados porque podía estudiarse bien en cultivos celulares , fue identificado como un virus −ssRNA, lo que era único en ese momento porque otros virus de ARN que se habían descubierto eran de sentido positivo. [33] [34] A principios del siglo XXI, la enfermedad bovina peste bovina , causada por el virus de la peste bovina −ssRNA, se convirtió en la segunda enfermedad en ser erradicada, después de la viruela , causada por un virus de ADN. [35]
En el siglo XXI, la metagenómica viral se ha vuelto común para identificar virus en el medio ambiente. Para los virus −ssRNA, esto permitió identificar una gran cantidad de virus de invertebrados, y especialmente de artrópodos, lo que ayudó a proporcionar información sobre la historia evolutiva de los virus −ssRNA. Con base en el análisis filogenético de RdRp que muestra que los virus −ssRNA descienden de un ancestro común, Negarnaviricota y sus dos subfilos se establecieron en 2018, y se colocaron en el reino Riboviria , entonces recién establecido . [1] [36]
{{cite book}}: |journal=ignorado ( ayuda )