
Los nódulos radiculares se encuentran en las raíces de las plantas , principalmente leguminosas , que forman una simbiosis con bacterias fijadoras de nitrógeno . [1] En condiciones limitantes de nitrógeno , las plantas capaces forman una relación simbiótica con una cepa de bacterias específica del huésped conocida como rizobios . [2] Este proceso ha evolucionado varias veces dentro de las leguminosas, así como en otras especies que se encuentran dentro del clado Rosid . [3] Los cultivos de leguminosas incluyen frijoles , guisantes y soja .
Dentro de los nódulos de las raíces de las leguminosas, el gas nitrógeno (N 2 ) de la atmósfera se convierte en amoníaco (NH 3 ), que luego se asimila en aminoácidos (los componentes básicos de las proteínas), nucleótidos (los componentes básicos del ADN y el ARN , así como la importante molécula energética ATP ) y otros componentes celulares como vitaminas , flavonas y hormonas . [ cita necesaria ] Su capacidad para fijar nitrógeno gaseoso convierte a las leguminosas en un organismo agrícola ideal, ya que se reduce su necesidad de fertilizantes nitrogenados. De hecho, el alto contenido de nitrógeno bloquea el desarrollo de los nódulos, ya que no hay ningún beneficio para la planta al formar la simbiosis. La energía para dividir el gas nitrógeno en el nódulo proviene del azúcar que se transloca desde la hoja (un producto de la fotosíntesis ). El malato , como producto de degradación de la sacarosa , es la fuente directa de carbono del bacteroide. La fijación de nitrógeno en el nódulo es muy sensible al oxígeno. Los nódulos de las leguminosas albergan una proteína que contiene hierro llamada leghemoglobina , estrechamente relacionada con la mioglobina animal , para facilitar la difusión del gas oxígeno utilizado en la respiración.
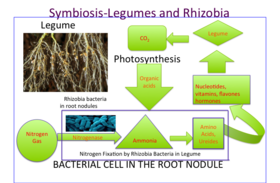
Las plantas que contribuyen a la fijación de N2 incluyen la familia de las leguminosas ( Fabaceae ) con taxones como el kudzu , el trébol , la soja , la alfalfa , el altramuz , el maní y el rooibos . Contienen bacterias simbióticas llamadas rizobios dentro de los nódulos, que producen compuestos de nitrógeno que ayudan a la planta a crecer y competir con otras plantas. Cuando la planta muere, el nitrógeno fijado se libera, poniéndolo a disposición de otras plantas, y esto ayuda a fertilizar el suelo . [4] [5] La gran mayoría de las leguminosas tienen esta asociación, pero algunos géneros (por ejemplo, Styphnolobium ) no la tienen. En muchas prácticas agrícolas tradicionales, los campos se rotan entre varios tipos de cultivos, que generalmente incluyen uno que consiste principalmente o enteramente en una leguminosa como el trébol, para aprovechar esto.
Aunque, con diferencia, la mayoría de las plantas capaces de formar nódulos radiculares fijadores de nitrógeno pertenecen a la familia de las leguminosas Fabaceae , existen algunas excepciones:
La capacidad de fijar nitrógeno está lejos de estar presente universalmente en estas familias. Por ejemplo, de los 122 géneros de las Rosáceas , sólo 4 géneros son capaces de fijar nitrógeno. Todas estas familias pertenecen a los órdenes Cucurbitales , Fagales y Rosales , que junto con los Fabales forman un clado fijador de nitrógeno (NFC) de eurosidos . En este clado, los Fabales fueron el primer linaje en ramificarse; por lo tanto, la capacidad de fijar nitrógeno puede ser plesiomorfa y posteriormente perderse en la mayoría de los descendientes de la planta fijadora de nitrógeno original; sin embargo, puede ser que los requisitos genéticos y fisiológicos básicos estuvieran presentes en un estado incipiente en los últimos ancestros comunes de todas estas plantas, pero solo evolucionaron hasta alcanzar su pleno funcionamiento en algunas de ellas:

En las leguminosas se han descrito dos tipos principales de nódulos: determinados e indeterminados. [9]
Los nódulos determinados se encuentran en ciertas tribus de leguminosas tropicales como las de los géneros Glycine (soja), Phaseolus (frijol común) y Vigna . y sobre algunas leguminosas de zonas templadas como la lota . Estos nódulos determinados pierden actividad meristemática poco después del inicio, por lo que el crecimiento se debe a la expansión celular que da como resultado nódulos maduros que tienen forma esférica. Otro tipo de nódulo determinado se encuentra en una amplia gama de hierbas, arbustos y árboles, como el Arachis ( maní ). Estos siempre están asociados a las axilas de raíces laterales o adventicias y se forman tras la infección a través de grietas por donde emergen estas raíces y sin utilizar pelos radiculares . Su estructura interna es bastante diferente a la del nódulo de tipo soja . [10]
Los nódulos indeterminados se encuentran en la mayoría de las leguminosas de las tres subfamilias, ya sea en regiones templadas o tropicales. Se pueden observar en leguminosas Faboideae como Pisum (guisante), Medicago (alfalfa), Trifolium (trébol) y Vicia (arveja) y en todas las leguminosas mimosoides como las acacias , las pocas leguminosas cesalpinoides noduladas como la perdiz . Se ganaron el nombre de "indeterminados" porque mantienen un meristemo apical activo que produce nuevas células que crecen durante la vida del nódulo. Esto da como resultado que el nódulo tenga una forma generalmente cilíndrica, que puede estar ampliamente ramificada. [10] Debido a que están creciendo activamente, los nódulos indeterminados manifiestan zonas que delimitan diferentes etapas de desarrollo/simbiosis: [11] [12] [13]

Este es el tipo de nódulo más estudiado, pero los detalles son bastante diferentes en los nódulos del maní y parientes y en algunos otros cultivos importantes como los altramuces, donde el nódulo se forma después de la infección directa de los rizobios a través de la epidermis y donde nunca se forman hilos de infección. . Los nódulos crecen alrededor de la raíz, formando una estructura similar a un collar. En estos nódulos y en el tipo maní, el tejido central infectado es uniforme y carece de las células no infectadas que se observan en los nódulos de la soja y en muchos tipos indeterminados, como los guisantes y los tréboles.
Los nódulos de tipo actinorízico son estructuras marcadamente diferentes que se encuentran en no leguminosas. En este tipo, las células derivadas de la corteza de la raíz forman el tejido infectado y el prenódulo pasa a formar parte del nódulo maduro. A pesar de esta diferencia aparentemente importante, es posible producir tales nódulos en las legumbres mediante una única mutación homeótica . [14]


Las legumbres liberan compuestos orgánicos como metabolitos secundarios llamados flavonoides desde sus raíces, que atraen a los rizobios hacia ellas y que también activan genes nod en las bacterias para producir factores nod e iniciar la formación de nódulos. [15] [16] Estos factores de inclinación inician el rizado del cabello de la raíz . El rizado comienza con la punta del pelo de la raíz enrollándose alrededor del Rhizobium . Dentro de la punta de la raíz, se forma un pequeño tubo llamado hilo de infección, que proporciona una vía para que Rhizobium viaje hacia las células epidérmicas de la raíz a medida que el pelo de la raíz continúa rizándose. [17]
El rizado parcial se puede lograr incluso sólo con el factor de inclinación . [16] Esto se demostró mediante el aislamiento de factores de cabeceo y su aplicación a partes de la raíz del cabello. Los pelos de la raíz se curvaron en la dirección de la aplicación, lo que demuestra la acción de un pelo de la raíz que intenta enrollarse alrededor de una bacteria. Incluso la aplicación en las raíces laterales provocó rizado. Esto demostró que es el factor de cabeceo en sí, no la bacteria, lo que provoca la estimulación del rizado. [dieciséis]
Cuando la raíz detecta el factor de asentimiento, se producen una serie de cambios bioquímicos y morfológicos: se desencadena la división celular en la raíz para crear el nódulo, y el crecimiento del pelo de la raíz se redirige para enrollarse alrededor de las bacterias varias veces hasta que encapsula completamente una o más bacterias. Las bacterias encapsuladas se dividen varias veces formando una microcolonia . Desde esta microcolonia, las bacterias ingresan al nódulo en desarrollo a través del hilo de infección, que crece a través del pelo de la raíz hasta la parte basal de la célula de la epidermis y luego hasta la corteza de la raíz ; luego están rodeados por una membrana simbiosómica de origen vegetal y se diferencian en bacteroides que fijan nitrógeno . [18]
La nodulación efectiva tiene lugar aproximadamente cuatro semanas después de la siembra del cultivo , y el tamaño y la forma de los nódulos dependen del cultivo. Cultivos como la soja o el maní tendrán nódulos más grandes que las leguminosas forrajeras como el trébol rojo o la alfalfa, ya que sus necesidades de nitrógeno son mayores. El número de nódulos, y su color interno, indicarán el estado de fijación de nitrógeno en la planta. [19]
La nodulación está controlada por una variedad de procesos, tanto externos (calor, suelos ácidos, sequía, nitrato) como internos (autorregulación de la nodulación, etileno). La autorregulación de la nodulación [20] controla el número de nódulos por planta a través de un proceso sistémico que involucra a la hoja. El tejido de la hoja detecta los primeros eventos de nodulación en la raíz a través de una señal química desconocida y luego restringe el desarrollo de nódulos en el tejido de la raíz recién desarrollado. Las quinasas receptoras de repetición rica en leucina (LRR) (NARK en soja ( Glycine max ); HAR1 en Lotus japonicus , SUNN en Medicago truncatula ) son esenciales para la autorregulación de la nodulación (AON). La mutación que conduce a la pérdida de función en estos receptores quinasas AON conduce a una supernodulación o hipernodulación. A menudo, las anomalías del crecimiento de las raíces acompañan a la pérdida de la actividad de la quinasa del receptor AON, lo que sugiere que el crecimiento de los nódulos y el desarrollo de las raíces están funcionalmente relacionados. Las investigaciones sobre los mecanismos de formación de nódulos mostraron que el gen ENOD40 , que codifica una proteína de 12 a 13 aminoácidos [41], está regulado positivamente durante la formación de nódulos [3].
Los nódulos de raíz aparentemente han evolucionado tres veces dentro de Fabaceae , pero son raros fuera de esa familia. La propensión de estas plantas a desarrollar nódulos radiculares parece estar relacionada con su estructura radicular. En particular, una tendencia a desarrollar raíces laterales en respuesta al ácido abscísico puede permitir la evolución posterior de los nódulos radiculares. [21]
Algunos hongos producen estructuras nodulares conocidas como ectomicorrizas tuberculadas en las raíces de sus plantas hospedantes. Suillus tomentosus , por ejemplo, produce estas estructuras con su planta huésped, el pino torcido ( Pinus contorta var. latifolia ). A su vez, se ha demostrado que estas estructuras albergan bacterias fijadoras de nitrógeno que aportan una cantidad significativa de nitrógeno y permiten a los pinos colonizar sitios pobres en nutrientes. [22]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )