La microscopía confocal , más frecuentemente llamada microscopía confocal de barrido láser ( CLSM ) o microscopía confocal de barrido láser ( LSCM ), es una técnica de obtención de imágenes ópticas para aumentar la resolución óptica y el contraste de una micrografía mediante el uso de un orificio espacial para bloquear la luz desenfocada en la formación de la imagen. [1] La captura de múltiples imágenes bidimensionales a diferentes profundidades en una muestra permite la reconstrucción de estructuras tridimensionales (un proceso conocido como seccionamiento óptico ) dentro de un objeto. Esta técnica se utiliza ampliamente en las comunidades científicas e industriales y las aplicaciones típicas son en ciencias de la vida , inspección de semiconductores y ciencia de los materiales .
En un microscopio convencional, la luz atraviesa la muestra hasta donde puede penetrar, mientras que un microscopio confocal solo enfoca un haz de luz más pequeño en un nivel de profundidad estrecho a la vez. El CLSM logra una profundidad de campo controlada y muy limitada.


El principio de la obtención de imágenes confocales fue patentado en 1957 por Marvin Minsky [2] y tiene como objetivo superar algunas limitaciones de los microscopios de fluorescencia de campo amplio tradicionales . [3] En un microscopio de fluorescencia convencional (es decir, de campo amplio) , toda la muestra se inunda de manera uniforme con luz de una fuente de luz. Todas las partes de la muestra se pueden excitar al mismo tiempo y la fluorescencia resultante es detectada por el fotodetector o la cámara del microscopio , incluida una gran parte de fondo desenfocada. Por el contrario, un microscopio confocal utiliza iluminación puntual (consulte Función de dispersión de puntos ) y un orificio en un plano ópticamente conjugado frente al detector para eliminar la señal fuera de foco; el nombre "confocal" proviene de esta configuración. Como solo se puede detectar la luz producida por fluorescencia muy cerca del plano focal , la resolución óptica de la imagen , particularmente en la dirección de profundidad de la muestra, es mucho mejor que la de los microscopios de campo amplio. Sin embargo, como gran parte de la luz de la fluorescencia de la muestra se bloquea en el orificio, esta mayor resolución se produce a costa de una menor intensidad de la señal, por lo que a menudo se requieren exposiciones prolongadas . Para compensar esta caída de la señal después del orificio , la intensidad de la luz se detecta mediante un detector sensible, generalmente un tubo fotomultiplicador (PMT) o un fotodiodo de avalancha , que transforma la señal luminosa en una señal eléctrica. [4]
Como solo se ilumina un punto de la muestra a la vez, la obtención de imágenes en 2D o 3D requiere escanear sobre una trama regular (es decir, un patrón rectangular de líneas de escaneo paralelas) en la muestra. El haz se escanea a través de la muestra en el plano horizontal utilizando uno o más espejos oscilantes ( controlados por servo ). Este método de escaneo generalmente tiene una latencia de reacción baja y la velocidad de escaneo puede variar. Los escaneos más lentos proporcionan una mejor relación señal-ruido , lo que resulta en un mejor contraste .
El espesor alcanzable del plano focal se define principalmente por la longitud de onda de la luz utilizada dividida por la apertura numérica de la lente del objetivo , pero también por las propiedades ópticas de la muestra. La posibilidad de realizar cortes ópticos finos hace que estos tipos de microscopios sean especialmente buenos para la obtención de imágenes en 3D y el perfilado de superficies de muestras.
Los cortes sucesivos forman una "pila z", que puede procesarse para crear una imagen 3D o fusionarse en una pila 2D (predominantemente se toma la intensidad máxima del píxel; otros métodos comunes incluyen el uso de la desviación estándar o la suma de los píxeles). [1]
La microscopía confocal proporciona la capacidad de seccionamiento óptico serial, directo y no invasivo de especímenes vivos, gruesos e intactos con un mínimo de preparación de la muestra, así como una mejora marginal en la resolución lateral en comparación con la microscopía de campo amplio. [4] Las muestras biológicas a menudo se tratan con tintes fluorescentes para hacer visibles los objetos seleccionados. Sin embargo, la concentración real del tinte puede ser baja para minimizar la perturbación de los sistemas biológicos: algunos instrumentos pueden rastrear moléculas fluorescentes individuales. Además, las técnicas transgénicas pueden crear organismos que produzcan sus propias moléculas quiméricas fluorescentes (como una fusión de GFP, proteína fluorescente verde con la proteína de interés). Los microscopios confocales funcionan según el principio de excitación puntual en la muestra (punto limitado por difracción) y detección puntual de la señal fluorescente resultante. Un orificio en el detector proporciona una barrera física que bloquea la fluorescencia desenfocada. Solo se registra el punto enfocado o central del disco de Airy .
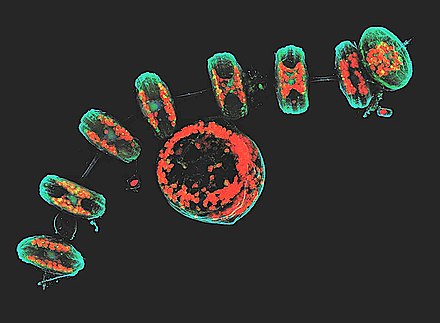
Existen cuatro tipos de microscopios confocales disponibles comercialmente:
Los microscopios láser de barrido confocal utilizan varios espejos (normalmente 2 o 3 que escanean linealmente a lo largo de los ejes x e y) para escanear la muestra con el láser y "desescanear" la imagen a través de un orificio fijo y un detector. Este proceso suele ser lento y no funciona para imágenes en vivo, pero puede ser útil para crear imágenes representativas de alta resolución de muestras fijas .
Los microscopios confocales de disco giratorio ( disco de Nipkow ) utilizan una serie de orificios móviles en un disco para escanear puntos de luz. Dado que una serie de orificios escanea un área en paralelo, cada orificio puede permanecer suspendido sobre un área específica durante un período de tiempo más prolongado, lo que reduce la energía de excitación necesaria para iluminar una muestra en comparación con los microscopios de escaneo láser. La energía de excitación reducida reduce la fototoxicidad y el fotoblanqueo de una muestra, lo que a menudo lo convierte en el sistema preferido para obtener imágenes de células u organismos vivos.
Los microscopios confocales de disco giratorio doble o mejorados con microlentes funcionan según los mismos principios que los microscopios confocales de disco giratorio, excepto que se coloca un segundo disco giratorio que contiene microlentes antes del disco giratorio que contiene los orificios. Cada orificio tiene una microlente asociada. Las microlentes actúan para capturar una amplia banda de luz y enfocarla en cada orificio, lo que aumenta significativamente la cantidad de luz dirigida a cada orificio y reduce la cantidad de luz bloqueada por el disco giratorio. Por lo tanto, los microscopios confocales mejorados con microlentes son significativamente más sensibles que los sistemas de disco giratorio estándar. Yokogawa Electric inventó esta tecnología en 1992. [5]
Los microscopios de matriz programable (PAM) utilizan un modulador de luz espacial (SLM) controlado electrónicamente que produce un conjunto de orificios móviles. El SLM es un dispositivo que contiene una matriz de píxeles con alguna propiedad ( opacidad , reflectividad o rotación óptica ) de los píxeles individuales que se puede ajustar electrónicamente. El SLM contiene espejos microelectromecánicos o componentes de cristal líquido . La imagen se adquiere generalmente mediante una cámara con dispositivo acoplado a carga (CCD).
Cada una de estas clases de microscopios confocales tiene ventajas y desventajas particulares. La mayoría de los sistemas están optimizados para la velocidad de grabación (es decir, captura de video) o alta resolución espacial. Los microscopios confocales de escaneo láser pueden tener una densidad de muestreo programable y resoluciones muy altas, mientras que Nipkow y PAM utilizan una densidad de muestreo fija definida por la resolución de la cámara. Las velocidades de cuadros de las imágenes son típicamente más lentas para los sistemas de escaneo láser de un solo punto que para los sistemas de disco giratorio o PAM. Los microscopios confocales de disco giratorio comerciales alcanzan velocidades de cuadros de más de 50 por segundo [6] , una característica deseable para observaciones dinámicas como la obtención de imágenes de células vivas.
En la práctica, Nipkow y PAM permiten que varios orificios escaneen la misma área en paralelo [7] siempre que los orificios estén suficientemente separados.
El desarrollo de vanguardia de la microscopía confocal de barrido láser ahora permite obtener imágenes a una velocidad de video mejor que la estándar (60 cuadros por segundo) mediante el uso de múltiples espejos de barrido microelectromecánicos.
La obtención de imágenes por fluorescencia de rayos X confocales es una técnica más nueva que permite controlar la profundidad, además de la orientación horizontal y vertical, por ejemplo, al analizar capas enterradas en una pintura. [8]
CLSM es una técnica de obtención de imágenes por barrido en la que la resolución obtenida se explica mejor comparándola con otra técnica de barrido como la del microscopio electrónico de barrido (SEM). CLSM tiene la ventaja de no requerir que una sonda esté suspendida a nanómetros de la superficie, como en un AFM o STM , por ejemplo, donde la imagen se obtiene escaneando con una punta fina sobre una superficie. La distancia desde la lente del objetivo hasta la superficie (llamada distancia de trabajo ) es típicamente comparable a la de un microscopio óptico convencional. Varía con el diseño óptico del sistema, pero las distancias de trabajo de cientos de micrómetros a varios milímetros son típicas.
En el CLSM, una muestra se ilumina mediante una fuente láser puntual y cada elemento de volumen está asociado con una intensidad de fluorescencia o dispersión discreta. Aquí, el tamaño del volumen de escaneo está determinado por el tamaño del punto (cerca del límite de difracción ) del sistema óptico porque la imagen del láser de escaneo no es un punto infinitamente pequeño sino un patrón de difracción tridimensional. El tamaño de este patrón de difracción y el volumen focal que define están controlados por la apertura numérica de la lente del objetivo del sistema y la longitud de onda del láser utilizado. Esto puede verse como el límite de resolución clásico de los microscopios ópticos convencionales que utilizan iluminación de campo amplio. Sin embargo, con la microscopía confocal es incluso posible mejorar el límite de resolución de las técnicas de iluminación de campo amplio porque la apertura confocal se puede cerrar para eliminar órdenes superiores del patrón de difracción [ cita requerida ] . Por ejemplo, si el diámetro del orificio se establece en 1 unidad Airy , solo el primer orden del patrón de difracción pasa a través de la abertura hacia el detector, mientras que los órdenes superiores se bloquean, mejorando así la resolución a costa de una ligera disminución del brillo. En las observaciones de fluorescencia, el límite de resolución de la microscopía confocal a menudo está limitado por la relación señal-ruido causada por el pequeño número de fotones normalmente disponibles en la microscopía de fluorescencia. Se puede compensar este efecto utilizando fotodetectores más sensibles o aumentando la intensidad de la fuente puntual del láser de iluminación. Aumentar la intensidad del láser de iluminación corre el riesgo de blanquear excesivamente u otros daños a la muestra de interés, especialmente para experimentos en los que se requiere la comparación del brillo de la fluorescencia. Cuando se obtienen imágenes de tejidos que son diferencialmente refractivos, como el mesófilo esponjoso de las hojas de las plantas u otros tejidos que contienen espacio aéreo, las aberraciones esféricas que perjudican la calidad de la imagen confocal suelen ser pronunciadas. Sin embargo, estas aberraciones se pueden reducir significativamente montando las muestras en perfluorocarbonos ópticamente transparentes y no tóxicos, como la perfluorodecalina , que se infiltra fácilmente en los tejidos y tiene un índice de refracción casi idéntico al del agua. [9] Cuando se toman imágenes en una geometría de reflexión, también es posible detectar la interferencia de la luz reflejada y dispersa de un objeto como un orgánulo intracelular. La naturaleza interferométrica de la señal permite reducir el diámetro del orificio a 0,2 unidades Airy y, por lo tanto, permite una mejora de la resolución ideal de √2 sin sacrificar la relación señal-ruido como en la microscopía de fluorescencia confocal. [10]
El CLSM se utiliza ampliamente en diversas disciplinas de las ciencias biológicas , desde la biología celular y la genética hasta la microbiología y la biología del desarrollo . [11] También se utiliza en óptica cuántica e imágenes y espectroscopia de nanocristales.
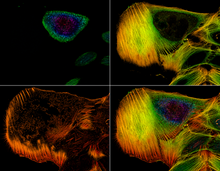
Clínicamente, la CLSM se utiliza en la evaluación de varias enfermedades oculares y es particularmente útil para la obtención de imágenes, el análisis cualitativo y la cuantificación de las células endoteliales de la córnea . [12] Se utiliza para localizar e identificar la presencia de elementos fúngicos filamentosos en el estroma corneal en casos de queratomicosis , lo que permite un diagnóstico rápido y, por lo tanto, la instauración temprana de una terapia definitiva. La investigación sobre técnicas CLSM para procedimientos endoscópicos ( endomicroscopía ) también muestra resultados prometedores. [13] En la industria farmacéutica, se recomendó seguir el proceso de fabricación de formas farmacéuticas de película delgada, para controlar la calidad y uniformidad de la distribución del fármaco. [14] La microscopía confocal también se utiliza para estudiar biopelículas , estructuras porosas complejas que son el hábitat preferido de los microorganismos. Algunas de las funciones temporales y espaciales de las biopelículas solo se pueden comprender estudiando su estructura en micro y mesoescalas. El estudio de la microescala es necesario para detectar la actividad y la organización de microorganismos individuales. [15]
CLSM se utiliza como mecanismo de recuperación de datos en algunos sistemas de almacenamiento de datos ópticos 3D y ha ayudado a determinar la edad del papiro de Magdalena .
El sistema IRENE utiliza microscopía confocal para el escaneo óptico y la recuperación de audio histórico dañado. [16]
Los microscopios confocales de barrido láser se utilizan para caracterizar la superficie de materiales microestructurados, como las obleas de silicio que se utilizan en la producción de células solares . Durante los primeros pasos de procesamiento, las obleas se graban químicamente en húmedo con compuestos ácidos o alcalinos, lo que le da textura a su superficie. A continuación, se utiliza la microscopía confocal láser para observar el estado de la superficie resultante en la palanca micrométrica. La microscopía confocal láser también se puede utilizar para analizar el grosor y la altura de los dedos de metalización impresos en la parte superior de las células solares.
La función de dispersión de puntos del orificio es un elipsoide, varias veces más largo que ancho. Esto limita la resolución axial del microscopio. Una técnica para superar esto es la microscopía 4Pi , en la que se permite que la luz incidente o emitida interfiera tanto desde arriba como desde abajo de la muestra para reducir el volumen del elipsoide. Una técnica alternativa es la microscopía theta confocal . En esta técnica, el cono de luz iluminadora y la luz detectada forman un ángulo entre sí (los mejores resultados se obtienen cuando son perpendiculares). La intersección de las dos funciones de dispersión de puntos da como resultado un volumen de muestra efectivo mucho menor. A partir de esto, se desarrolló el microscopio de iluminación de un solo plano . Además, se puede emplear la deconvolución utilizando una función de dispersión de puntos derivada experimentalmente para eliminar la luz desenfocada, lo que mejora el contraste tanto en el plano axial como en el lateral.
Existen variantes confocales que logran una resolución por debajo del límite de difracción, como la microscopía de agotamiento por emisión estimulada (STED). Además de esta técnica, hay una amplia variedad de otras técnicas de súper resolución (no basadas en confocal), como PALM, (d)STORM , SIM, etc. Todas tienen sus propias ventajas, como la facilidad de uso, la resolución y la necesidad de equipos especiales, soluciones tampón o fluoróforos.
Para obtener imágenes de muestras a bajas temperaturas, se han utilizado dos enfoques principales, ambos basados en la arquitectura de microscopía confocal de barrido láser . Un enfoque es utilizar un criostato de flujo continuo : solo la muestra está a baja temperatura y se aborda ópticamente a través de una ventana transparente. [17] Otro enfoque posible es tener parte de la óptica (especialmente el objetivo del microscopio) en un dewar de almacenamiento criogénico . [18] Este segundo enfoque, aunque más engorroso, garantiza una mejor estabilidad mecánica y evita las pérdidas debidas a la ventana.
Para estudiar las interacciones moleculares mediante el CLSM se puede utilizar la transferencia de energía de resonancia de Förster (FRET) para confirmar que dos proteínas se encuentran a una determinada distancia una de la otra.

En 1940 Hans Goldmann, oftalmólogo de Berna , Suiza, desarrolló un sistema de lámpara de hendidura para documentar los exámenes oculares. [19] Este sistema es considerado por algunos autores posteriores como el primer sistema óptico confocal. [20] [21]
En 1943, Zyun Koana publicó un sistema confocal. [22] [20]
En 1951, Hiroto Naora, un colega de Koana, describió un microscopio confocal en la revista Science para espectrofotometría . [23]
El primer microscopio confocal de barrido fue construido por Marvin Minsky en 1955 y se presentó una patente en 1957. El barrido del punto de iluminación en el plano focal se lograba moviendo la platina. No se presentó ninguna publicación científica y no se conservaron imágenes realizadas con él. [2] [24]

En la década de 1960, el checoslovaco Mojmír Petráň, de la Facultad de Medicina de la Universidad Carolina de Pilsen, desarrolló el microscopio de barrido en tándem, el primer microscopio confocal comercializado. Lo vendía una pequeña empresa en Checoslovaquia y en Estados Unidos Tracor-Northern (posteriormente Noran) y utilizaba un disco Nipkow giratorio para generar múltiples orificios de excitación y emisión. [21] [25]
La patente checoslovaca fue presentada en 1966 por Petráň y Milan Hadravský, un colaborador checoslovaco. Una primera publicación científica con datos e imágenes generadas con este microscopio fue publicada en la revista Science en 1967, escrita por M. David Egger de la Universidad de Yale y Petráň. [26] Como nota al pie de este artículo se menciona que Petráň diseñó el microscopio y supervisó su construcción y que era, en parte, un "investigador asociado" en Yale. Una segunda publicación de 1968 describía la teoría y los detalles técnicos del instrumento y tenía a Hadravský y Robert Galambos , el jefe del grupo en Yale, como autores adicionales. [27] En 1970 se concedió la patente estadounidense. Fue presentada en 1967. [28]
En 1969 y 1971, M. David Egger y Paul Davidovits de la Universidad de Yale publicaron dos artículos que describían el primer microscopio láser confocal de barrido. [29] [30] Era un escáner puntual, lo que significa que se generaba un solo punto de iluminación. Utilizaba microscopía de epi-iluminación-reflexión para la observación del tejido nervioso. Un láser de helio-neón de 5 mW con luz de 633 nm se reflejaba mediante un espejo semitransparente hacia el objetivo. El objetivo era una lente simple con una longitud focal de 8,5 mm. A diferencia de todos los sistemas anteriores y la mayoría de los posteriores, la muestra se escaneaba mediante el movimiento de esta lente (escaneo objetivo), lo que provocaba un movimiento del punto focal. La luz reflejada regresaba al espejo semitransparente, la parte transmitida se enfocaba mediante otra lente en el orificio de detección detrás del cual se colocaba un tubo fotomultiplicador. La señal se visualizaba mediante un CRT de un osciloscopio, el rayo catódico se movía simultáneamente con el objetivo. Un dispositivo especial permitió hacer fotografías Polaroid , tres de las cuales fueron mostradas en la publicación de 1971.
Los autores especulan sobre los tintes fluorescentes para las investigaciones in vivo . Citan la patente de Minsky, agradecen a Steve Baer, en ese momento estudiante de doctorado en la Escuela de Medicina Albert Einstein de la ciudad de Nueva York , donde desarrolló un microscopio de barrido de línea confocal, [31] por sugerir el uso de un láser con el "microscopio de Minsky" y agradecen a Galambos, Hadravsky y Petráň por las discusiones que llevaron al desarrollo de su microscopio. La motivación para su desarrollo fue que en el microscopio de barrido en tándem solo una fracción de 10 −7 de la luz de iluminación participa en la generación de la imagen en el ocular. Por lo tanto, la calidad de la imagen no era suficiente para la mayoría de las investigaciones biológicas. [20] [32]
En 1977 Colin JR Sheppard y Amarjyoti Choudhury , de Oxford , Reino Unido, publicaron un análisis teórico de los microscopios confocales y de barrido láser. [33] Es probablemente la primera publicación que utiliza el término "microscopio confocal". [20] [32]
En 1978, los hermanos Christoph Cremer y Thomas Cremer publicaron un diseño de microscopio láser confocal de barrido que utilizaba excitación fluorescente con autoenfoque electrónico. También sugirieron una iluminación puntual con láser mediante un " holograma de 4π puntos ". [32] [34] Este diseño de CLSM combinó por primera vez el método de barrido láser con la detección 3D de objetos biológicos marcados con marcadores fluorescentes .
En 1978 y 1980, el grupo de Oxford dirigido por Colin Sheppard y Tony Wilson describió un microscopio confocal con iluminación láser epi, barrido de platina y tubos fotomultiplicadores como detectores. La platina podía moverse a lo largo del eje óptico (eje z), lo que permitía realizar cortes ópticos en serie. [32]
En 1979, Fred Brakenhoff y sus colaboradores demostraron que las ventajas teóricas del seccionamiento óptico y la mejora de la resolución se podían conseguir en la práctica. En 1985, este grupo se convirtió en el primero en publicar imágenes convincentes tomadas con un microscopio confocal que podían responder a preguntas biológicas. [35] Poco después, muchos otros grupos comenzaron a utilizar la microscopía confocal para responder a preguntas científicas que hasta entonces habían permanecido en el misterio debido a las limitaciones tecnológicas.
En 1983, IJ Cox y C. Sheppard, de Oxford, publicaron el primer trabajo en el que un microscopio confocal era controlado por un ordenador. El primer microscopio láser de barrido comercial, el escáner de platina SOM-25, fue ofrecido por Oxford Optoelectronics (después de varias adquisiciones por parte de BioRad) a partir de 1982. Se basaba en el diseño del grupo de Oxford. [21] [36]
A mediados de la década de 1980, William Bradshaw Amos y John Graham White y sus colegas que trabajaban en el Laboratorio de Biología Molecular de Cambridge construyeron el primer microscopio de barrido de haz confocal. [37] [38] La platina con la muestra no se movía, en cambio el punto de iluminación sí, lo que permitía una adquisición de imágenes más rápida: cuatro imágenes por segundo con 512 líneas cada una. Las imágenes intermedias enormemente magnificadas, debido a un recorrido del haz de 1 a 2 metros de largo, permitieron el uso de un diafragma de iris convencional como un "agujero de alfiler", con diámetros de ~1 mm. Las primeras micrografías se tomaron con exposición a largo plazo en película antes de que se añadiera una cámara digital. Una mejora adicional permitió hacer zoom en la preparación por primera vez. Zeiss , Leitz y Cambridge Instruments no tenían ningún interés en una producción comercial. [39] El Consejo de Investigación Médica (MRC) finalmente patrocinó el desarrollo de un prototipo. El diseño fue adquirido por Bio-Rad , modificado con control por computadora y comercializado como 'MRC 500'. El sucesor MRC 600 fue posteriormente la base para el desarrollo del primer microscopio fluorescente de dos fotones desarrollado en 1990 en la Universidad de Cornell . [35]
Los avances que se produjeron en el Instituto Real de Tecnología KTH de Estocolmo en la misma época dieron lugar a un CLSM comercial distribuido por la empresa sueca Sarastro. [40] La empresa fue adquirida en 1990 por Molecular Dynamics, [41] pero el CLSM acabó descontinuado. En Alemania, Heidelberg Instruments, fundada en 1984, desarrolló un CLSM, que inicialmente estaba destinado a aplicaciones industriales más que a la biología. Este instrumento fue adquirido en 1990 por Leica Lasertechnik . Zeiss ya tenía en el mercado un microscopio láser de barrido de punto volante no confocal que se actualizó a confocal. Un informe de 1990, [42] mencionaba algunos fabricantes de confocales: Sarastro, Technical Instrument, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern y Zeiss. [35]
En 1989, Fritz Karl Preikschat , junto con su hijo Ekhard Preikschat, inventaron el microscopio de diodo láser de barrido para el análisis del tamaño de partículas. [43] [44] y cofundaron Lasentec para comercializarlo. En 2001, Lasentec fue adquirida por Mettler Toledo . [45] Se utilizan principalmente en la industria farmacéutica para proporcionar un control in situ del proceso de cristalización en grandes sistemas de purificación.
En los instrumentos confocales estándar, el segundo orificio o "orificio de salida" se utiliza para filtrar la luz emitida o dispersa. Tradicionalmente, este orificio es un componente pasivo que bloquea la luz para filtrar la iluminación ópticamente. Sin embargo, los diseños más nuevos han intentado realizar este filtrado digitalmente.
Los métodos más recientes han reemplazado el orificio pasivo por un elemento detector compuesto. Por lo general, después del procesamiento digital, este método conduce a una mejor resolución y presupuesto de fotones, ya que el límite de resolución puede acercarse al de un orificio infinitamente pequeño. [46]
Otros investigadores han intentado reenfocar digitalmente la luz desde una fuente de excitación puntual utilizando redes neuronales convolucionales profundas. [47]
{{cite journal}}: Falta o está vacío |title=( ayuda ) El artículo está disponible en el sitio web de la revista. El archivo pdf denominado "P359 - 402" tiene un tamaño de 19.020 kilobytes y también contiene artículos vecinos del mismo número. La figura 1b del artículo muestra el esquema de la trayectoria del haz de transmisión confocal.