
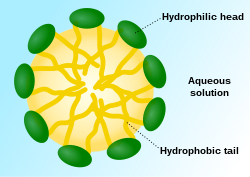
Una micela ( / m aɪ ˈ s ɛ l / ) o micela ( / m aɪ ˈ s ɛ l ə / ) ( pl. micelas o micelas , respectivamente) es un agregado (o ensamblaje supramolecular ) de moléculas lipídicas anfipáticas tensioactivas dispersas en un líquido, formando una suspensión coloidal (también conocida como sistema coloidal asociado). [4] Una micela típica en agua forma un agregado con las regiones de "cabeza" hidrófilas en contacto con el disolvente circundante , secuestrando las regiones hidrófobas de cola única en el centro de la micela.
Esta fase es causada por el comportamiento de empaquetamiento de los lípidos de cola única en una bicapa . La dificultad para llenar el volumen del interior de una bicapa, al mismo tiempo que se acomoda el área por grupo de cabeza forzada en la molécula por la hidratación del grupo de cabeza del lípido, conduce a la formación de la micela. Este tipo de micela se conoce como micela de fase normal (o micela de aceite en agua). Las micelas inversas tienen los grupos de cabeza en el centro con las colas extendiéndose hacia afuera (o micela de agua en aceite).
Las micelas tienen una forma aproximadamente esférica. También son posibles otras formas, como elipsoides, cilindros y bicapas. La forma y el tamaño de una micela son una función de la geometría molecular de sus moléculas de surfactante y de las condiciones de la solución, como la concentración de surfactante, la temperatura , el pH y la fuerza iónica . El proceso de formación de micelas se conoce como micelización y forma parte del comportamiento de fase de muchos lípidos según su polimorfismo . [5]
La capacidad de una solución jabonosa para actuar como detergente ha sido reconocida durante siglos. Sin embargo, fue recién a principios del siglo XX que se estudió científicamente la constitución de tales soluciones. El trabajo pionero en esta área fue realizado por James William McBain en la Universidad de Bristol . Ya en 1913, postuló la existencia de "iones coloidales" para explicar la buena conductividad electrolítica de las soluciones de palmitato de sodio . [6] Estos cúmulos altamente móviles, formados espontáneamente, llegaron a llamarse micelas, un término tomado de la biología y popularizado por GS Hartley en su clásico libro Paraffin Chain Salts: A Study in Micelle Formation . [7] El término micela fue acuñado en la literatura científica del siglo XIX como el diminutivo -elle de la palabra latina mica (partícula), que transmite una nueva palabra para "partícula diminuta". [8]
Las moléculas de surfactante individuales que están en el sistema pero no son parte de una micela se denominan " monómeros ". Las micelas representan un conjunto molecular , en el que los componentes individuales están termodinámicamente en equilibrio con monómeros de la misma especie en el medio circundante. En el agua, las "cabezas" hidrófilas de las moléculas de surfactante siempre están en contacto con el disolvente, independientemente de si los surfactantes existen como monómeros o como parte de una micela. Sin embargo, las "colas" lipófilas de las moléculas de surfactante tienen menos contacto con el agua cuando son parte de una micela, siendo esta la base del impulso energético para la formación de micelas. En una micela, las colas hidrófobas de varias moléculas de surfactante se ensamblan en un núcleo similar al aceite, cuya forma más estable no tiene contacto con el agua. Por el contrario, los monómeros de surfactante están rodeados por moléculas de agua que crean una "jaula" o capa de solvatación conectada por enlaces de hidrógeno . Esta jaula de agua es similar a un clatrato y tiene una estructura cristalina similar al hielo y se puede caracterizar de acuerdo con el efecto hidrófobo. El grado de solubilidad de los lípidos está determinado por la contribución de entropía desfavorable debido al ordenamiento de la estructura del agua según el efecto hidrofóbico.
Las micelas compuestas de surfactantes iónicos tienen una atracción electrostática hacia los iones que las rodean en solución, estos últimos conocidos como contraiones . Aunque los contraiones más cercanos enmascaran parcialmente una micela cargada (hasta en un 92%), los efectos de la carga de la micela afectan la estructura del solvente circundante a distancias apreciables de la micela. Las micelas iónicas influyen en muchas propiedades de la mezcla, incluida su conductividad eléctrica. Agregar sales a un coloide que contiene micelas puede disminuir la fuerza de las interacciones electrostáticas y conducir a la formación de micelas iónicas más grandes. [9] Esto se ve con mayor precisión desde el punto de vista de una carga efectiva en la hidratación del sistema.
Las micelas se forman solo cuando la concentración de surfactante es mayor que la concentración micelar crítica (CMC), y la temperatura del sistema es mayor que la temperatura micelar crítica, o temperatura de Krafft . La formación de micelas se puede entender utilizando la termodinámica : las micelas pueden formarse espontáneamente debido a un equilibrio entre la entropía y la entalpía . En el agua, el efecto hidrofóbico es la fuerza impulsora para la formación de micelas, a pesar del hecho de que el ensamblaje de moléculas de surfactante es desfavorable en términos de entalpía y entropía del sistema. A concentraciones muy bajas del surfactante, solo los monómeros están presentes en solución. A medida que aumenta la concentración del surfactante, se llega a un punto en el que la contribución desfavorable de la entropía, de la agrupación de las colas hidrofóbicas de las moléculas, se supera por una ganancia de entropía debido a la liberación de las capas de solvatación alrededor de las colas del surfactante. En este punto, las colas lipídicas de una parte de los surfactantes deben segregarse del agua. Por lo tanto, comienzan a formarse micelas. En términos generales, por encima de la CMC, la pérdida de entropía debido al ensamblaje de las moléculas de surfactante es menor que la ganancia de entropía al liberar las moléculas de agua que estaban "atrapadas" en las capas de solvatación de los monómeros surfactantes. También son importantes las consideraciones entálpicas, como las interacciones electrostáticas que ocurren entre las partes cargadas de los surfactantes.
La ecuación del parámetro de empaquetamiento micelar se utiliza para ayudar a "predecir el autoensamblaje molecular en soluciones surfactantes": [10]
donde es el volumen de la cola del surfactante, es la longitud de la cola y es el área de equilibrio por molécula en la superficie del agregado.
El concepto de micelas se introdujo para describir los agregados de núcleo-corona de pequeñas moléculas de surfactante , sin embargo, también se ha extendido para describir agregados de copolímeros de bloque anfifílicos en solventes selectivos. [11] [12] Es importante conocer la diferencia entre estos dos sistemas. La principal diferencia entre estos dos tipos de agregados está en el tamaño de sus bloques de construcción. Las moléculas de surfactante tienen un peso molecular que generalmente es de unos pocos cientos de gramos por mol, mientras que los copolímeros de bloque son generalmente uno o dos órdenes de magnitud más grandes. Además, gracias a las partes hidrófilas e hidrófobas más grandes, los copolímeros de bloque pueden tener una naturaleza anfifílica mucho más pronunciada en comparación con las moléculas de surfactante.
Debido a estas diferencias en los componentes básicos, algunas micelas de copolímeros en bloque se comportan como si fueran tensioactivos, mientras que otras no. Por lo tanto, es necesario hacer una distinción entre las dos situaciones. Las primeras pertenecen a las micelas dinámicas , mientras que las segundas se denominan micelas congeladas cinéticamente.
Ciertas micelas de copolímeros en bloque anfifílicos muestran un comportamiento similar al de las micelas de surfactantes. Estas se denominan generalmente micelas dinámicas y se caracterizan por los mismos procesos de relajación asignados al intercambio de surfactantes y a la escisión/recombinación de micelas. Aunque los procesos de relajación son los mismos entre los dos tipos de micelas, la cinética del intercambio de unímeros es muy diferente. Mientras que en los sistemas surfactantes los unímeros salen y se unen a las micelas a través de un proceso controlado por difusión , para los copolímeros la constante de velocidad de entrada es más lenta que en un proceso controlado por difusión. Se descubrió que la velocidad de este proceso era una ley de potencia decreciente del grado de polimerización del bloque hidrofóbico elevado a la potencia 2/3. Esta diferencia se debe al enrollamiento del bloque hidrofóbico de un copolímero que sale del núcleo de una micela. [13]
Los copolímeros en bloque que forman micelas dinámicas son algunos de los poloxámeros tribloque en las condiciones adecuadas.
Cuando las micelas de copolímeros en bloque no muestran los procesos de relajación característicos de las micelas de surfactantes, se denominan micelas congeladas cinéticamente . Esto se puede lograr de dos maneras: cuando los unímeros que forman las micelas no son solubles en el disolvente de la solución micelar, o si los bloques que forman el núcleo son vítreos a la temperatura en la que se encuentran las micelas. Las micelas congeladas cinéticamente se forman cuando se cumple cualquiera de estas condiciones. Un ejemplo especial en el que ambas condiciones son válidas es el del poliestireno-b-poli(óxido de etileno). Este copolímero en bloque se caracteriza por la alta hidrofobicidad del bloque que forma el núcleo, PS , que hace que los unímeros sean insolubles en agua. Además, el PS tiene una temperatura de transición vítrea alta que, dependiendo del peso molecular, es superior a la temperatura ambiente. Gracias a estas dos características, una solución acuosa de micelas de PS-PEO de peso molecular suficientemente alto puede considerarse congelada cinéticamente. Esto significa que ninguno de los procesos de relajación, que llevarían la solución micelar hacia el equilibrio termodinámico, es posible. [14] El trabajo pionero sobre estas micelas fue realizado por Adi Eisenberg. [15] También se demostró cómo la falta de procesos de relajación permitió una gran libertad en las posibles morfologías formadas. [16] [17] Además, la estabilidad frente a la dilución y la amplia gama de morfologías de las micelas congeladas cinéticamente las hacen particularmente interesantes, por ejemplo, para el desarrollo de nanopartículas de administración de fármacos de larga circulación. [18]
En un disolvente no polar , la exposición de los grupos de cabeza hidrófilos al disolvente circundante es lo que resulta energéticamente desfavorable, lo que da lugar a un sistema de agua en aceite. En este caso, los grupos hidrófilos están secuestrados en el núcleo de la micela y los grupos hidrófobos se extienden desde el centro. Es proporcionalmente menos probable que se formen estas micelas inversas al aumentar la carga del grupo de cabeza, ya que el secuestro hidrófilo crearía interacciones electrostáticas altamente desfavorables.
Está bien establecido que para muchos sistemas surfactante/disolvente una pequeña fracción de las micelas inversas adquieren espontáneamente una carga neta de +q e o -q e . Esta carga se produce a través de un mecanismo de desproporción/comproporción en lugar de un mecanismo de disociación/asociación y la constante de equilibrio para esta reacción es del orden de 10 −4 a 10 −11 , lo que significa que aproximadamente 1 de cada 100 a 1 de cada 100 000 micelas estarán cargadas. [19]

La supermicela es una estructura micelar jerárquica ( ensamblaje supramolecular ) donde los componentes individuales también son micelas. Las supermicelas se forman a través de enfoques químicos de abajo hacia arriba , como el autoensamblaje de micelas cilíndricas largas en patrones radiales en forma de cruz, estrella o diente de león en un solvente especialmente seleccionado; se pueden agregar nanopartículas sólidas a la solución para que actúen como centros de nucleación y formen el núcleo central de la supermicela. Los tallos de las micelas cilíndricas primarias están compuestos de varios copolímeros de bloque conectados por fuertes enlaces covalentes ; dentro de la estructura de la supermicela, se mantienen unidos de manera flexible mediante enlaces de hidrógeno , interacciones electrostáticas o solvofóbicas . [20] [21]
Cuando los surfactantes están presentes por encima de la concentración micelar crítica (CMC), pueden actuar como emulsionantes que permitirán que un compuesto que normalmente es insoluble (en el solvente que se está utilizando) se disuelva. Esto ocurre porque las especies insolubles se pueden incorporar al núcleo micelar, que a su vez se solubiliza en el solvente a granel en virtud de las interacciones favorables de los grupos de cabeza con las especies de solvente. El ejemplo más común de este fenómeno son los detergentes , que limpian material lipofílico poco soluble (como aceites y ceras) que no se puede eliminar solo con agua. Los detergentes también limpian al reducir la tensión superficial del agua, lo que facilita la eliminación del material de una superficie. La propiedad emulsionante de los surfactantes también es la base de la polimerización en emulsión .
Las micelas también pueden tener papeles importantes en las reacciones químicas. La química micelar utiliza el interior de las micelas para albergar reacciones químicas, lo que en algunos casos puede hacer que la síntesis química de múltiples pasos sea más factible. [22] [23] Hacerlo puede aumentar el rendimiento de la reacción, crear condiciones más favorables para productos de reacción específicos (por ejemplo, moléculas hidrófobas) y reducir los solventes necesarios, los productos secundarios y las condiciones requeridas (por ejemplo, pH extremo). Debido a estos beneficios, la química micelular se considera una forma de química verde . [24] Sin embargo, la formación de micelas también puede inhibir las reacciones químicas, como cuando las moléculas que reaccionan forman micelas que protegen un componente molecular vulnerable a la oxidación. [25]
El uso de micelas catiónicas de cloruro de cetrimonio , cloruro de bencetonio y cloruro de cetilpiridinio puede acelerar las reacciones químicas entre compuestos con carga negativa (como el ADN o la coenzima A ) en un entorno acuoso hasta 5 millones de veces. [26] A diferencia de la catálisis micelar convencional, [27] las reacciones ocurren únicamente en la superficie de las micelas cargadas.
La formación de micelas es esencial para la absorción de vitaminas liposolubles y lípidos complejos en el cuerpo humano. Las sales biliares formadas en el hígado y secretadas por la vesícula biliar permiten la formación de micelas de ácidos grasos. Esto permite la absorción de lípidos complejos (p. ej., lecitina) y vitaminas liposolubles (A, D, E y K) dentro de la micela por el intestino delgado.
Durante el proceso de coagulación de la leche, las proteasas actúan sobre la porción soluble de las caseínas , la κ-caseína , originando así un estado micelar inestable que resulta en la formación del coágulo.
Las micelas también se pueden utilizar para la administración dirigida de fármacos como nanopartículas de oro. [28]