

Los receptores nicotínicos de acetilcolina , o nAChR , son polipéptidos receptores que responden al neurotransmisor acetilcolina . Los receptores nicotínicos también responden a fármacos como el agonista nicotina . Se encuentran en el sistema nervioso central y periférico, los músculos y muchos otros tejidos de muchos organismos. En la unión neuromuscular son el receptor principal en el músculo para la comunicación nervio-músculo motor que controla la contracción muscular. En el sistema nervioso periférico : (1) transmiten señales salientes de las células presinápticas a las postsinápticas dentro del sistema nervioso simpático y parasimpático , y (2) son los receptores que se encuentran en el músculo esquelético que reciben la acetilcolina liberada para indicar la contracción muscular. En el sistema inmunológico, los nAChR regulan los procesos inflamatorios y envían señales a través de vías intracelulares distintas. [1] En los insectos , el sistema colinérgico se limita al sistema nervioso central . [2]
Los receptores nicotínicos se consideran receptores colinérgicos , ya que responden a la acetilcolina. Los receptores nicotínicos reciben su nombre de la nicotina , que no estimula los receptores muscarínicos de acetilcolina, sino que se une selectivamente a los receptores nicotínicos. [3] [4] [5] El receptor muscarínico de acetilcolina también recibe su nombre de una sustancia química que se une selectivamente a ese receptor : la muscarina . [6] La acetilcolina en sí se une a los receptores de acetilcolina tanto muscarínicos como nicotínicos. [7]
Como receptores ionotrópicos , los nAChR están directamente vinculados a los canales iónicos. Algunas evidencias sugieren que estos receptores también pueden utilizar segundos mensajeros (como lo hacen los receptores metabotrópicos ) en algunos casos. [8] Los receptores nicotínicos de acetilcolina son los receptores ionotrópicos mejor estudiados. [3]
Dado que los receptores nicotínicos ayudan a transmitir señales salientes para los sistemas simpático y parasimpático, los antagonistas de los receptores nicotínicos, como el hexametonio, interfieren en la transmisión de estas señales. Así, por ejemplo, los antagonistas de los receptores nicotínicos interfieren en el barorreflejo [9] que normalmente corrige los cambios en la presión arterial mediante la estimulación simpática y parasimpática del corazón.
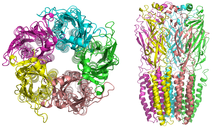
Los receptores nicotínicos, con una masa molecular de 290 kDa , [10] están formados por cinco subunidades, dispuestas simétricamente alrededor de un poro central . [3] Cada subunidad comprende cuatro dominios transmembrana con los extremos N y C ubicados extracelularmente. Poseen similitudes con los receptores GABA A , los receptores de glicina y los receptores de serotonina tipo 3 (que son todos receptores ionotrópicos), o las proteínas distintivas Cys-loop . [11]
En los vertebrados, los receptores nicotínicos se clasifican en dos subtipos en función de sus principales sitios de expresión: receptores nicotínicos de tipo muscular y receptores nicotínicos de tipo neuronal . En los receptores de tipo muscular, que se encuentran en la unión neuromuscular, los receptores son la forma embrionaria, compuesta por las subunidades α 1 , β 1 , γ y δ en una proporción de 2:1:1:1 ((α 1 ) 2 β 1 γδ), o la forma adulta compuesta por las subunidades α 1 , β 1 , δ y ε en una proporción de 2:1:1:1 ((α 1 ) 2 β 1 δε). [3] [4] [5] [12] Los subtipos neuronales son varias combinaciones homoméricas (todas de un tipo de subunidad) o heteroméricas (al menos una α y una β) de doce subunidades diferentes del receptor nicotínico: α 2 −α 10 y β 2 −β 4 . Los ejemplos de los subtipos neuronales incluyen: (α 4 ) 3 (β 2 ) 2 , (α 4 ) 2 (β 2 ) 3 , (α 3 ) 2 (β 4 ) 3 , α 4 α 6 β 3 (β 2 ) 2 , (α 7 ) 5 , y muchos otros. Tanto en los receptores de tipo muscular como en los de tipo neuronal, las subunidades son muy similares entre sí, especialmente en las regiones hidrofóbicas . [13]
Varios estudios de microscopía electrónica y cristalografía de rayos X han proporcionado información estructural de muy alta resolución sobre los nAChR musculares y neuronales y sus dominios de unión. [10] [14] [15] [16]
Al igual que con todos los canales iónicos regulados por ligando, la apertura del poro del canal nAChR requiere la unión de un mensajero químico. Se utilizan varios términos diferentes para referirse a las moléculas que se unen a los receptores, como ligando , agonista o transmisor. Además del agonista endógeno acetilcolina , los agonistas del nAChR incluyen nicotina , epibatidina y colina . Los antagonistas nicotínicos que bloquean el receptor incluyen mecamilamina, dihidro-β-eritroidina y hexametonio . [13]
En los nAChR de tipo muscular, los sitios de unión de la acetilcolina se encuentran en la interfaz de las subunidades α y ε o δ. En los nAChR neuronales, el sitio de unión se encuentra en la interfaz de una subunidad α y una β o entre dos subunidades α en el caso de los receptores α 7. El sitio de unión se encuentra en el dominio extracelular cerca del extremo N. [ 4] [17] Cuando un agonista se une al sitio, todas las subunidades presentes experimentan un cambio conformacional y el canal se abre [18] y se abre un poro con un diámetro de aproximadamente 0,65 nm. [4]
Los AChR nicotínicos pueden existir en diferentes estados conformacionales interconvertibles. La unión de un agonista estabiliza los estados abierto y desensibilizado . En condiciones fisiológicas normales, el receptor necesita exactamente dos moléculas de ACh para abrirse. [19] La apertura del canal permite que los iones con carga positiva se muevan a través de él; en particular, el sodio ingresa a la célula y el potasio sale. El flujo neto de iones con carga positiva es hacia adentro.
El nAChR es un canal catiónico no selectivo, lo que significa que pueden atravesarlo varios iones con carga positiva diferentes. [3] Es permeable a Na + y K + , con algunas combinaciones de subunidades que también son permeables a Ca2 + . [4] [20] [21] La cantidad de sodio y potasio que los canales permiten pasar a través de sus poros (su conductancia ) varía de 50 a 110 pS , y la conductancia depende de la composición de la subunidad específica, así como del ion permeable. [22]
Muchos nAChR neuronales pueden afectar la liberación de otros neurotransmisores. [5] El canal generalmente se abre rápidamente y tiende a permanecer abierto hasta que el agonista se difunde , lo que generalmente demora alrededor de 1 milisegundo . [4] Los AChR pueden abrirse espontáneamente sin ligandos unidos o pueden cerrarse espontáneamente con ligandos unidos, y las mutaciones en el canal pueden cambiar la probabilidad de cualquiera de los eventos. [23] [18] Por lo tanto, la unión de ACh cambia la probabilidad de apertura del poro, que aumenta a medida que se une más ACh.
El nAChR no puede unirse a la ACh cuando se une a cualquiera de las α-neurotoxinas del veneno de serpiente . Estas α - neurotoxinas se unen de forma antagónica, fuerte y no covalente a los nAChR de los músculos esqueléticos y en las neuronas, bloqueando así la acción de la ACh en la membrana postsináptica, inhibiendo el flujo de iones y provocando parálisis y muerte. El nAChR contiene dos sitios de unión para las neurotoxinas del veneno de serpiente. El progreso en el descubrimiento de la dinámica de la acción de unión de estos sitios ha resultado difícil, aunque estudios recientes que utilizan la dinámica del modo normal [24] han ayudado a predecir la naturaleza de los mecanismos de unión de las toxinas de serpiente y de la ACh a los nAChR. Estos estudios han demostrado que un movimiento similar a un giro causado por la unión de la ACh es probablemente responsable de la apertura de los poros, y que una o dos moléculas de α-bungarotoxina (u otra α-neurotoxina de cadena larga) son suficientes para detener este movimiento. Las toxinas parecen bloquear las subunidades vecinas del receptor, inhibiendo la torsión y, por lo tanto, el movimiento de apertura. [25]
La activación de los receptores por la nicotina modifica el estado de las neuronas a través de dos mecanismos principales. Por un lado, el movimiento de cationes provoca una despolarización de la membrana plasmática (que se traduce en un potencial postsináptico excitatorio en las neuronas ) dando lugar a la activación de canales iónicos dependientes de voltaje . Por otro lado, la entrada de calcio actúa, ya sea directa o indirectamente, sobre diferentes cascadas intracelulares . Esto conduce, por ejemplo, a la regulación de la actividad de algunos genes o a la liberación de neurotransmisores . [ cita requerida ]
La desensibilización de los receptores mediante ligando fue caracterizada por primera vez por Katz y Thesleff en el receptor nicotínico de acetilcolina. [26]
La exposición prolongada o repetida a un estímulo a menudo da como resultado una disminución de la capacidad de respuesta de ese receptor hacia un estímulo, denominada desensibilización. La función del nAChR puede ser modulada por fosforilación [27] mediante la activación de las quinasas de proteína dependientes del segundo mensajero. Se ha demostrado que la PKA [26] y la PKC [28] , así como las quinasas de tirosina [29] , fosforilan el nAChR, lo que resulta en su desensibilización. Se ha informado que, después de la exposición prolongada del receptor al agonista, el agonista mismo causa un cambio conformacional inducido por el agonista en el receptor, lo que resulta en la desensibilización del receptor. [30]
Los receptores desensibilizados pueden volver a un estado abierto prolongado cuando un agonista se une en presencia de un modulador alostérico positivo, por ejemplo PNU-120,596 . [31] Además, hay evidencia que indica que moléculas chaperonas específicas tienen efectos reguladores sobre estos receptores. [32]
Las subunidades de los receptores nicotínicos pertenecen a una familia multigénica (16 miembros en humanos) y el ensamblaje de combinaciones de subunidades da como resultado un gran número de receptores diferentes (para más información, consulte la base de datos de canales iónicos controlados por ligando). Estos receptores, con propiedades cinéticas , electrofisiológicas y farmacológicas muy variables , responden a la nicotina de manera diferente, a concentraciones efectivas muy diferentes. Esta diversidad funcional les permite participar en dos tipos principales de neurotransmisión. La transmisión sináptica clásica (transmisión por cableado) implica la liberación de altas concentraciones de neurotransmisor, que actúan sobre receptores inmediatamente vecinos. Por el contrario, la transmisión paracrina (transmisión por volumen) implica neurotransmisores liberados por terminales axónicas , que luego difunden a través del medio extracelular hasta que alcanzan sus receptores, que pueden estar distantes. [33] Los receptores nicotínicos también se pueden encontrar en diferentes ubicaciones sinápticas; por ejemplo, el receptor nicotínico muscular siempre funciona postsinápticamente. Las formas neuronales del receptor se pueden encontrar tanto a nivel postsináptico (involucrado en la neurotransmisión clásica) como presináptico [34] , donde pueden influir en la liberación de múltiples neurotransmisores.
Se han identificado 17 subunidades del receptor nAChR en vertebrados, que se dividen en subunidades de tipo muscular y de tipo neuronal. Aunque una subunidad/gen α8 está presente en especies aviares como el pollo, no está presente en especies humanas o mamíferas. [35]
Las subunidades del nAChR se han dividido en cuatro subfamilias (I–IV) según las similitudes en la secuencia de proteínas. [36] Además, la subfamilia III se ha dividido en tres tipos.
Los nAChR neuronales son proteínas transmembrana que forman estructuras pentaméricas ensambladas a partir de una familia de subunidades compuestas de α 2 –α 10 y β 2 –β 4 . [37] Estas subunidades se descubrieron desde mediados de la década de 1980 hasta principios de la década de 1990, cuando se clonaron ADNc para múltiples subunidades de nAChR de cerebros de ratas y pollos, lo que llevó a la identificación de once genes diferentes (doce en pollos) que codifican subunidades neuronales de nAChR; los genes de las subunidades identificados se denominaron α 2 –α 10 (α 8 solo se encuentra en pollos) y β 2 –β 4 . [38] También se ha descubierto que varias combinaciones de subunidades podrían formar nAChR funcionales que podrían ser activados por acetilcolina y nicotina , y las diferentes combinaciones de subunidades generan subtipos de nAChR con diversas propiedades funcionales y farmacológicas. [39] Cuando se expresan solos, α 7 , α 8 , α 9 y α 10 pueden formar receptores funcionales, pero otras subunidades α requieren la presencia de subunidades β para formar receptores funcionales. [37] En mamíferos, se ha descubierto que las subunidades de nAchR están codificadas por 17 genes, y de estos, nueve genes que codifican subunidades α y tres que codifican subunidades β se expresan en el cerebro. Los nAChR que contienen la subunidad β 2 (β 2 nAChR) y los α 7 nAChR se expresan ampliamente en el cerebro, mientras que otras subunidades de nAChR tienen una expresión más restringida. [40] El ensamblaje pentamérico de nAChR está sujeto a las subunidades que se producen en varios tipos de células, como en el pulmón humano, donde los pentámeros epiteliales y musculares difieren en gran medida. [41]
Un importante grupo de genes nAchR (CHRNA5/A3/B4) contiene los genes que codifican las subunidades α 5 , α3 y β 4 . Los estudios genéticos han identificado polimorfismos de un solo nucleótido (SNP) en el locus cromosómico que codifica estos tres genes nAChR como factores de riesgo para la dependencia de la nicotina , el cáncer de pulmón , la enfermedad pulmonar obstructiva crónica , el alcoholismo y la enfermedad arterial periférica . [37] [42] Los genes de la subunidad nAChR CHRNA5/A3/B4 se encuentran en un grupo compacto en la región cromosómica 15q24–25. Las subunidades del nAChR codificadas por este locus forman los subtipos predominantes de receptores nicotínicos expresados en el sistema nervioso periférico (SNP) y otros sitios clave del sistema nervioso central (SNC) , como la habénula medial , una estructura entre el prosencéfalo límbico y el mesencéfalo involucrada en las principales vías del circuito colinérgico. [37] Investigaciones posteriores de los genes CHRNA5/A3/B4 han revelado que los genes nAChR "neuronales" también se expresan en células no neuronales donde están involucrados en varios procesos fundamentales, como la inflamación. [43] Los genes CHRNA5/A3/B4 se coexpresan en muchos tipos de células y las actividades transcripcionales de las regiones promotoras de los tres genes están reguladas por muchos de los mismos factores de transcripción, lo que demuestra que su agrupamiento puede reflejar el control de la expresión génica. [37]
CHRNB3 y CHRNA6 también se agrupan en un grupo de genes, ubicado en 8p11. [42] Múltiples estudios han demostrado que los SNPS en CHRNB3–CHRNA6 se han relacionado con la dependencia de la nicotina y el comportamiento de fumar, como dos SNP en CHRNB3, rs6474413 y rs10958726. [42] La variación genética en esta región también muestra influencia en la susceptibilidad al uso de drogas de abuso, incluido el consumo de cocaína y alcohol. [44] Los receptores nicotínicos que contienen subunidades α 6 o β 3 expresadas en regiones cerebrales, especialmente en el área tegmental ventral y la sustancia negra , son importantes para los comportamientos de las drogas debido a su papel en la liberación de dopamina . [45] La variación genética en estos genes puede alterar la sensibilidad a las drogas de abuso de numerosas formas, incluido el cambio de la estructura de aminoácidos de la proteína o causar alteraciones en la regulación transcripcional y traduccional. [44]
Otros genes nAChR bien estudiados incluyen el CHRNA4 y el CHRNB2, que se han asociado como genes de la epilepsia del lóbulo frontal nocturna autosómica dominante (ADNFLE) . [42] [46] Ambas subunidades de nAChR están presentes en el cerebro y la aparición de mutaciones en estas dos subunidades causa un tipo generalizado de epilepsia. Los ejemplos incluyen la mutación de inserción 776ins3 de CHRNA4 que está asociada con convulsiones nocturnas y trastornos psiquiátricos, y la mutación I312M de CHRNB2 que parece causar no solo epilepsia sino también déficits cognitivos muy específicos, como déficits en el aprendizaje y la memoria. [46] [47] Existe una variación genética natural entre estos dos genes y el análisis de polimorfismos de un solo nucleótido (SNP) y otras modificaciones genéticas muestran una mayor variación en el gen CHRNA4 que en el gen CHRNB2, lo que implica que nAChR β 2 , la proteína codificada por CHRNB2, se asocia con más subunidades que α 4 . También se ha informado que CHRNA2 es un tercer candidato para las convulsiones nocturnas del lóbulo frontal. [42] [46]
Varios estudios han informado de una asociación entre CHRNA7 y endofenotipos de trastornos psiquiátricos y dependencia de la nicotina, lo que contribuye a la relevancia clínica significativa de α 7 y la investigación que se está realizando sobre él. [46] CHRNA7 fue uno de los primeros genes que se consideró que estaba relacionado con la esquizofrenia . Los estudios identificaron varios polimorfismos del promotor CHRNA7 que reducen la actividad transcripcional de los genes que se asocian con la esquizofrenia, lo que es consistente con el hallazgo de niveles reducidos de nAChR a7 en el cerebro de pacientes esquizofrénicos. [46] Se ha descubierto que ambos subtipos de nAChR, α 4 β 2 y α 7 , están significativamente reducidos en estudios post mortem de individuos con esquizofrenia. [48] Además, las tasas de tabaquismo son significativamente más altas en aquellos con esquizofrenia, lo que implica que fumar nicotina puede ser una forma de automedicación. [49]
Los receptores nicotínicos son pentámeros de estas subunidades; es decir, cada receptor contiene cinco subunidades. Por lo tanto, existe un inmenso potencial de variación de estas subunidades, algunas de las cuales se encuentran más comúnmente que otras. Los subtipos más ampliamente expresados incluyen (α 1 ) 2 β 1 δε (tipo muscular adulto), (α 3 ) 2 (β 4 ) 3 (tipo ganglionar), (α 4 ) 2 (β 2 ) 3 (tipo SNC) y (α 7 ) 5 (otro tipo SNC). [50] A continuación se presenta una comparación:
{{cite book}}: |website=ignorado ( ayuda )K
es
como sigue; α
2
β
4
= 9900 nM [5], α
3
β
2
= 14 nM [1], α
3
β
4
= 187 nM [1], α
4
β
2
= 1 nM [4,6]. Debido a la heterogeneidad de los canales de nACh, no hemos marcado un objetivo farmacológico primario para la nicotina, aunque se informa que α
4
β
2
es el subtipo predominante de alta afinidad en el cerebro que media la adicción a la nicotina [2-3].