Los adipocitos , también conocidos como lipocitos y células grasas , son las células que componen principalmente el tejido adiposo , especializadas en almacenar energía en forma de grasa . [1] Los adipocitos derivan de células madre mesenquimales que dan lugar a adipocitos a través de la adipogénesis . En cultivos celulares , los progenitores de adipocitos también pueden formar osteoblastos , miocitos y otros tipos de células.
Hay dos tipos de tejido adiposo, el tejido adiposo blanco (WAT) y el tejido adiposo marrón (BAT), que también se conocen como grasa blanca y marrón, respectivamente, y comprenden dos tipos de células grasas.


Las células de grasa blanca contienen una sola gota grande de lípido rodeada por una capa de citoplasma , y se conocen como uniloculares. El núcleo es aplanado y empujado hacia la periferia. Una célula de grasa típica tiene 0,1 mm de diámetro [2] y algunas tienen el doble de ese tamaño y otras la mitad. Sin embargo, estas estimaciones numéricas del tamaño de las células de grasa dependen en gran medida del método de medición y la ubicación del tejido adiposo. [2] La grasa almacenada está en un estado semilíquido y está compuesta principalmente de triglicéridos y éster de colesterol . Las células de grasa blanca secretan muchas proteínas que actúan como adipocinas, como resistina , adiponectina , leptina y apelina . Un adulto humano promedio tiene 30 mil millones de células grasas con un peso de 30 libras o 13,5 kg. Si un niño o adolescente gana suficiente exceso de peso, las células grasas pueden aumentar en número absoluto hasta los veinticuatro años. [3] Si un adulto (que nunca fue obeso cuando era niño o adolescente) aumenta de peso en exceso, las células grasas generalmente aumentan de tamaño, no de número, aunque hay alguna evidencia no concluyente que sugiere que la cantidad de células grasas también podría aumentar si las células grasas existentes se vuelven lo suficientemente grandes (como en niveles particularmente severos de obesidad). [3] La cantidad de células grasas es difícil de disminuir a través de una intervención dietética, aunque alguna evidencia sugiere que la cantidad de células grasas puede disminuir si la pérdida de peso se mantiene durante un período de tiempo suficientemente largo (>1 año; aunque es extremadamente difícil para las personas con células grasas más grandes y numerosas mantener la pérdida de peso durante tanto tiempo). [3]
Un metanálisis de gran tamaño ha demostrado que el tamaño de las células del tejido adiposo blanco depende de los métodos de medición, los depósitos de tejido adiposo, la edad y el índice de masa corporal; para el mismo grado de obesidad, los aumentos en el tamaño de las células grasas también se asociaron con desregulaciones en el metabolismo de la glucosa y los lípidos. [2]
Las células de grasa parda tienen forma poliédrica . La grasa parda se deriva de las células dermatomiocíticas. A diferencia de las células de grasa blanca , estas células tienen un citoplasma considerable, con varias gotitas de lípidos esparcidas por todas partes, y se conocen como células multiloculares. El núcleo es redondo y, aunque está ubicado excéntricamente, no está en la periferia de la célula. El color marrón proviene de la gran cantidad de mitocondrias . La grasa parda, también conocida como "grasa de bebé", se utiliza para generar calor.
Los adipocitos de la médula ósea son uniloculares, como las células de grasa blanca. El depósito de tejido adiposo de la médula ósea es poco conocido en términos de su función fisiológica y relevancia para la salud ósea. El tejido adiposo de la médula ósea se expande en estados de baja densidad ósea, pero además se expande en el contexto de la obesidad. [4] La respuesta del tejido adiposo de la médula ósea al ejercicio se aproxima a la del tejido adiposo blanco . [4] [5] [6] [7] El ejercicio reduce tanto el tamaño de los adipocitos como el volumen del tejido adiposo de la médula ósea, cuantificado mediante imágenes de MRI o μCT del hueso teñido con el aglutinante lipídico osmio .

Los preadipocitos son fibroblastos indiferenciados que pueden ser estimulados para formar adipocitos. Los estudios han arrojado luz sobre los posibles mecanismos moleculares en la determinación del destino de los preadipocitos, aunque el linaje exacto de los adipocitos aún no está claro. [8] [9] La variación de la distribución de la grasa corporal resultante del crecimiento normal está influenciada por el estado nutricional y hormonal que depende de las diferencias intrínsecas en las células que se encuentran en cada depósito adiposo. [10]
Las células madre mesenquimales pueden diferenciarse en adipocitos, tejido conectivo , músculo o hueso . [1]
El precursor de la célula adulta se denomina lipoblasto , y un tumor de este tipo de célula se conoce como lipoblastoma . [11]
Se ha demostrado que las células grasas en algunos ratones disminuyen en número debido al ayuno y se observaron otras propiedades cuando se expusieron al frío. [12]
Si los adipocitos del cuerpo alcanzan su capacidad máxima de grasa, pueden replicarse para permitir el almacenamiento de grasa adicional.
Las ratas adultas de diversas cepas se volvieron obesas cuando se las alimentó con una dieta muy palatable durante varios meses. El análisis de la morfología de su tejido adiposo reveló aumentos tanto en el tamaño como en la cantidad de adipocitos en la mayoría de los depósitos. La reintroducción de una dieta de pienso común [13] a estos animales precipitó un período de pérdida de peso durante el cual solo el tamaño medio de los adipocitos volvió a la normalidad. La cantidad de adipocitos se mantuvo en el nivel elevado alcanzado durante el período de aumento de peso. [14]
Según algunos informes y libros de texto, el número de adipocitos puede aumentar en la infancia y la adolescencia, aunque la cantidad suele ser constante en los adultos. Las personas que se vuelven obesas en la edad adulta, en lugar de en la adolescencia, no tienen más adipocitos que antes. [15]
Las personas que han sido obesas desde la infancia generalmente tienen una cantidad inflada de células grasas. Las personas que engordan en la edad adulta pueden no tener más células grasas que sus pares delgados, pero sus células grasas son más grandes. En general, a las personas con un exceso de células grasas les resulta más difícil perder peso y mantenerlo que a las personas obesas que simplemente tienen células grasas agrandadas. [3]
Las células grasas del cuerpo tienen respuestas regionales a la sobrealimentación que se estudió en sujetos adultos. En la parte superior del cuerpo, un aumento del tamaño de los adipocitos se correlacionó con el aumento de grasa en la parte superior del cuerpo; sin embargo, el número de células grasas no cambió significativamente. En contraste con la respuesta de las células grasas de la parte superior del cuerpo, el número de adipocitos de la parte inferior del cuerpo aumentó significativamente durante el transcurso del experimento. Cabe destacar que no hubo cambios en el tamaño de los adipocitos de la parte inferior del cuerpo. [16]
Aproximadamente el 10% de las células grasas se renuevan anualmente en todas las edades adultas y niveles de índice de masa corporal sin un aumento significativo en el número total de adipocitos en la edad adulta. [15]
La obesidad se caracteriza por la expansión de la masa grasa, a través del aumento del tamaño de los adipocitos ( hipertrofia ) y, en menor medida, la proliferación celular ( hiperplasia ). [17] [2] En el tejido graso de los individuos obesos, hay una mayor producción de moduladores del metabolismo, como glicerol , hormonas , quimiocinas estimulantes de macrófagos y citocinas proinflamatorias , lo que conduce al desarrollo de resistencia a la insulina . [18] La producción de estos moduladores y la patogénesis resultante de la resistencia a la insulina probablemente son causadas por los adipocitos, así como por los macrófagos del sistema inmunológico que se infiltran en el tejido. [19]
La producción de grasa en los adipocitos está fuertemente estimulada por la insulina . Al controlar la actividad de las enzimas piruvato deshidrogenasa y acetil-CoA carboxilasa , la insulina promueve la síntesis de ácidos grasos insaturados . También promueve la captación de glucosa e induce SREBF1 , que activa la transcripción de genes que estimulan la lipogénesis . [20]
El SREBF1 ( factor de transcripción 1 de unión al elemento regulador de esterol ) es un factor de transcripción sintetizado como una proteína precursora inactiva insertada en la membrana del retículo endoplasmático (RE) por dos hélices que atraviesan la membrana . También anclada en la membrana del RE está la SCAP (proteína activadora de escisión de SREBF), que se une a SREBF1. El complejo SREBF1-SCAP es retenido en la membrana del RE por INSIG1 (proteína del gen 1 inducido por insulina). Cuando se agotan los niveles de esterol, INSIG1 libera SCAP y el complejo SREBF1-SCAP puede clasificarse en vesículas de transporte recubiertas por el coatómero COPII que se exportan al aparato de Golgi . En el aparato de Golgi, SREBF1 se escinde y se libera como una proteína madura transcripcionalmente activa. Luego es libre de translocarse al núcleo y activar la expresión de sus genes diana. [21]
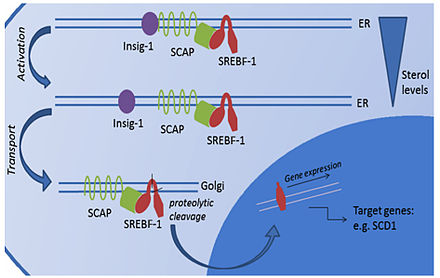
Estudios clínicos han demostrado repetidamente que, aunque la resistencia a la insulina suele estar asociada a la obesidad, los fosfolípidos de membrana de los adipocitos de pacientes obesos generalmente aún muestran un mayor grado de insaturación de ácidos grasos. [22] Esto parece indicar un mecanismo adaptativo que permite al adipocito mantener su funcionalidad, a pesar de las mayores demandas de almacenamiento asociadas a la obesidad y la resistencia a la insulina.
Un estudio realizado en 2013 [22] descubrió que, si bien la expresión del ARNm de INSIG1 y SREBF1 disminuyó en el tejido adiposo de ratones y humanos obesos, la cantidad de SREBF1 activo aumentó en comparación con ratones normales y pacientes no obesos. Esta regulación negativa de la expresión de INSIG1 combinada con el aumento de SREBF1 maduro también se correlacionó con el mantenimiento de la expresión del gen diana de SREBF1. Por lo tanto, parece que, al regular negativamente INSIG1, hay un restablecimiento del bucle INSIG1/SREBF1, lo que permite el mantenimiento de los niveles activos de SREBF1. Esto parece ayudar a compensar los efectos antilipogénicos de la resistencia a la insulina y, por lo tanto, preservar las capacidades de almacenamiento de grasa de los adipocitos y la disponibilidad de niveles adecuados de insaturación de ácidos grasos frente a las presiones nutricionales de la obesidad.
Los adipocitos pueden sintetizar estrógenos a partir de andrógenos , [23] siendo potencialmente la razón por la que el bajo peso o el sobrepeso son factores de riesgo de infertilidad . [24] Además, los adipocitos son responsables de la producción de la hormona leptina . La leptina es importante en la regulación del apetito y actúa como un factor de saciedad. [25]
pienso normal se compone de subproductos agrícolas, como trigo molido, maíz o avena, harinas de alfalfa y soja, una fuente de proteínas como pescado y aceite vegetal, y se complementa con minerales y vitaminas. Por tanto, el pienso es una dieta rica en fibra que contiene carbohidratos complejos, con grasas de una variedad de fuentes vegetales. El pienso es económico de fabricar y es apetecible para los roedores.
Varios factores derivados no solo de los adipocitos sino también de los macrófagos infiltrados probablemente contribuyen a la patogénesis de la resistencia a la insulina.