
Un gradiente electroquímico es un gradiente de potencial electroquímico , generalmente para un ion que puede moverse a través de una membrana . El gradiente consta de dos partes:
Cuando hay concentraciones desiguales de un ion a través de una membrana permeable, el ion se moverá a través de la membrana desde el área de mayor concentración al área de menor concentración mediante difusión simple . Los iones también transportan una carga eléctrica que forma un potencial eléctrico a través de una membrana. Si hay una distribución desigual de cargas a través de la membrana, entonces la diferencia de potencial eléctrico genera una fuerza que impulsa la difusión de iones hasta que las cargas se equilibran en ambos lados de la membrana.
Los gradientes electroquímicos son esenciales para el funcionamiento de las baterías y otras células electroquímicas , la fotosíntesis y la respiración celular , y algunos otros procesos biológicos.
La energía electroquímica es una de las muchas formas intercambiables de energía potencial mediante las cuales se puede conservar la energía . Aparece en química electroanalítica y tiene aplicaciones industriales como baterías y pilas de combustible. En biología, los gradientes electroquímicos permiten a las células controlar la dirección en que se mueven los iones a través de las membranas. En las mitocondrias y los cloroplastos , los gradientes de protones generan un potencial quimiosmótico utilizado para sintetizar ATP , [1] y el gradiente de sodio-potasio ayuda a las sinapsis neuronales a transmitir información rápidamente. [ cita necesaria ]
Un gradiente electroquímico tiene dos componentes: una concentración diferencial de carga eléctrica a través de una membrana y una concentración diferencial de especies químicas a través de esa misma membrana. En el primer efecto, la carga concentrada atrae cargas de signo opuesto; en este último, las especies concentradas tienden a difundirse a través de la membrana para igualar las concentraciones. La combinación de estos dos fenómenos determina la dirección termodinámicamente preferida para el movimiento de un ion a través de la membrana. [2] : 403 [3]
El efecto combinado se puede cuantificar como un gradiente en el potencial electroquímico termodinámico : [ cita necesaria ] con
A veces, se abusa del término "potencial electroquímico" para describir el potencial eléctrico generado por un gradiente de concentración iónica; es decir, φ .
Un gradiente electroquímico es análogo a la presión del agua a través de una presa hidroeléctrica . Las rutas desbloqueadas por la membrana (por ejemplo, proteínas de transporte de membrana o electrodos ) corresponden a turbinas que convierten la energía potencial del agua en otras formas de energía física o química, y los iones que pasan a través de la membrana corresponden al agua que viaja hacia la parte baja del río. [ tono ] Por el contrario, se puede usar energía para bombear agua hacia el lago sobre la presa , y se puede usar energía química para crear gradientes electroquímicos. [4] [5]
El término se aplica típicamente en electroquímica , cuando se utiliza energía eléctrica en forma de voltaje aplicado para modular la favorabilidad termodinámica de una reacción química . En una batería, un potencial electroquímico que surge del movimiento de iones equilibra la energía de reacción de los electrodos. El voltaje máximo que puede producir una reacción de una batería a veces se denomina potencial electroquímico estándar de esa reacción.
La generación de un potencial eléctrico transmembrana a través del movimiento de iones a través de una membrana celular impulsa procesos biológicos como la conducción nerviosa , la contracción muscular , la secreción hormonal y la sensación . Por convención, los voltajes fisiológicos se miden en relación con la región extracelular; una célula animal típica tiene un potencial eléctrico interno de (−70)–(−50) mV. [2] : 464
"Un gradiente electroquímico es esencial para la fosforilación oxidativa mitocondrial ". El último paso de la respiración celular es la cadena de transporte de electrones , compuesta por cuatro complejos incrustados en la membrana mitocondrial interna. Los complejos I, III y IV bombean protones desde la matriz al espacio intermembrana (IMS); por cada par de electrones que ingresa a la cadena, diez protones se trasladan al IMS. El resultado es un potencial eléctrico de más de200 mV . El flujo resultante de protones de regreso a la matriz impulsa los esfuerzos de la ATP sintasa para combinar fosfato inorgánico y ADP . [6] [2] : 743–745
De manera similar a la cadena de transporte de electrones, las reacciones de la fotosíntesis dependientes de la luz bombean protones hacia la luz de los tilacoides de los cloroplastos para impulsar la síntesis de ATP. El gradiente de protones se puede generar mediante fotofosforilación cíclica o no cíclica. De las proteínas que participan en la fotofosforilación no cíclica, el fotosistema II (PSII), la plastiquinona y el complejo citocromo b 6 f contribuyen directamente a generar el gradiente de protones. Por cada cuatro fotones absorbidos por el PSII, se bombean ocho protones hacia la luz. [2] : 769–770
Varios otros transportadores y canales iónicos desempeñan un papel en la generación de un gradiente electroquímico de protones. Uno es TPK 3 , un canal de potasio que es activado por Ca 2+ y conduce K + desde la luz del tilacoide al estroma , lo que ayuda a establecer el campo eléctrico . Por otro lado, el antiportador de eflujo electroneutro de K + (KEA 3 ) transporta K + a la luz del tilacoide y H + al estroma, lo que ayuda a establecer el gradiente de pH . [7]

Dado que los iones están cargados, no pueden atravesar las membranas celulares mediante difusión simple. Dos mecanismos diferentes pueden transportar los iones a través de la membrana: transporte activo o pasivo . [ cita necesaria ]
Un ejemplo de transporte activo de iones es la Na + -K + -ATPasa (NKA). NKA funciona mediante la hidrólisis de ATP en ADP y un fosfato inorgánico; por cada molécula de ATP hidrolizada, se transportan tres Na + al exterior y dos K + al interior de la célula. Esto hace que el interior de la célula sea más negativo que el exterior y, más específicamente, genera un potencial de membrana V membrana de aproximadamente−60 mV . [5]
Un ejemplo de transporte pasivo son los flujos de iones a través de los canales de Na + , K + , Ca 2+ y Cl- . A diferencia del transporte activo, el transporte pasivo funciona mediante la suma aritmética de la ósmosis (un gradiente de concentración) y un campo eléctrico (el potencial transmembrana). Formalmente, el cambio de energía libre de Gibbs molar asociado con el transporte exitoso es [ cita requerida ] donde R representa la constante de los gases , T representa la temperatura absoluta , z es la carga por ion y F representa la constante de Faraday . [2] : 464–465
En el ejemplo del Na + , ambos términos tienden a favorecer el transporte: el potencial eléctrico negativo dentro de la célula atrae al ion positivo y como el Na + se concentra fuera de la célula, la ósmosis favorece la difusión a través del canal de Na + hacia el interior de la célula. En el caso del K + , el efecto de la ósmosis se invierte: aunque los iones externos son atraídos por el potencial intracelular negativo, la entropía busca difundir los iones ya concentrados en el interior de la célula. El fenómeno inverso (la ósmosis favorece el transporte, el potencial eléctrico se opone) se puede lograr para el Na + en células con potenciales transmembrana anormales: en+70 mV , se detiene el flujo de Na + ; a potenciales más altos, se convierte en un eflujo. [ cita necesaria ]
Los gradientes de protones en particular son importantes en muchos tipos de células como forma de almacenamiento de energía. El gradiente suele utilizarse para impulsar la ATP sintasa, la rotación flagelar o el transporte de metabolitos . [15] Esta sección se centrará en tres procesos que ayudan a establecer gradientes de protones en sus respectivas células: bacteriorrodopsina y fotofosforilación no cíclica y fosforilación oxidativa. [ cita necesaria ]
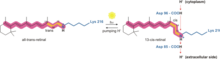
La forma en que la bacteriorrodopsina genera un gradiente de protones en Archaea es a través de una bomba de protones . La bomba de protones se basa en transportadores de protones para impulsar los protones desde el lado de la membrana con una concentración baja de H + hacia el lado de la membrana con una concentración alta de H + . En la bacteriorrodopsina, la bomba de protones se activa mediante la absorción de fotones de longitud de onda de 568 nm , lo que conduce a la isomerización de la base de Schiff (SB) en la retina formando el estado K. Esto aleja a SB de Asp85 y Asp212, lo que provoca la transferencia de H + del SB a Asp85 formando el estado M1. Luego, la proteína cambia al estado M2 al separar Glu204 de Glu194, lo que libera un protón de Glu204 al medio externo. El SB es reprotonado por Asp96 que forma el estado N. Es importante que el segundo protón provenga de Asp96 ya que su estado desprotonado es inestable y rápidamente reprotonado con un protón del citosol . La protonación de Asp85 y Asp96 provoca la reisomerización del SB, formando el estado O. Finalmente, la bacteriorrodopsina vuelve a su estado de reposo cuando Asp85 libera su protón a Glu204. [15] [16]
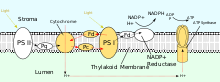
PSII también depende de la luz para impulsar la formación de gradientes de protones en los cloroplastos; sin embargo, PSII utiliza química redox vectorial para lograr este objetivo. En lugar de transportar físicamente protones a través de la proteína, las reacciones que requieren la unión de protones ocurrirán en el lado extracelular, mientras que las reacciones que requieren la liberación de protones ocurrirán en el lado intracelular. La absorción de fotones de longitud de onda de 680 nm se utiliza para excitar dos electrones en P 680 a un nivel de energía más alto . Estos electrones de mayor energía se transfieren a la plastoquinona unida a proteínas (PQ A ) y luego a la plastoquinona libre (PQ B ). Esto reduce la plastoquinona (PQ) a plastoquinol (PQH 2 ), que se libera del PSII después de ganar dos protones del estroma. Los electrones del P 680 se reponen oxidando el agua a través del complejo que desprende oxígeno (OEC). Esto da como resultado la liberación de O 2 y H + hacia la luz, para una reacción total de [15]
Después de ser liberado del PSII, el PQH 2 viaja al complejo citocromo b 6 f , que luego transfiere dos electrones del PQH 2 a la plastocianina en dos reacciones separadas. El proceso que ocurre es similar al ciclo Q en el Complejo III de la cadena de transporte de electrones. En la primera reacción, el PQH 2 se une al complejo en el lado de la luz y un electrón se transfiere al centro hierro-azufre que luego lo transfiere al citocromo f , que luego lo transfiere a la plastocianina. El segundo electrón se transfiere al hemo b L , que luego lo transfiere al hemo b H , que luego lo transfiere a PQ. En la segunda reacción, un segundo PQH 2 se oxida, añadiendo un electrón a otra plastocianina y al PQ. Ambas reacciones juntas transfieren cuatro protones a la luz. [2] : 782–783 [17]

En la cadena de transporte de electrones, el complejo I (CI) cataliza la reducción de ubiquinona (UQ) a ubiquinol (UQH 2 ) mediante la transferencia de dos electrones del dinucleótido de nicotinamida y adenina reducido (NADH), que transloca cuatro protones de la matriz mitocondrial al IMS. : [18]
El complejo III (CIII) cataliza el ciclo Q. El primer paso implica la transferencia de dos electrones del UQH 2 reducido por CI a dos moléculas de citocromo c oxidado en el sitio Q o . En el segundo paso, dos electrones más reducen UQ a UQH 2 en el sitio Qi . La reacción total es: [18]
El complejo IV (CIV) cataliza la transferencia de dos electrones del citocromo c reducido por CIII a la mitad de oxígeno completo. La utilización de un oxígeno completo en la fosforilación oxidativa requiere la transferencia de cuatro electrones. Luego, el oxígeno consumirá cuatro protones de la matriz para formar agua, mientras que otros cuatro protones se bombean al IMS, para dar una reacción total [18].
{{cite journal}}: Citar diario requiere |journal=( ayuda )