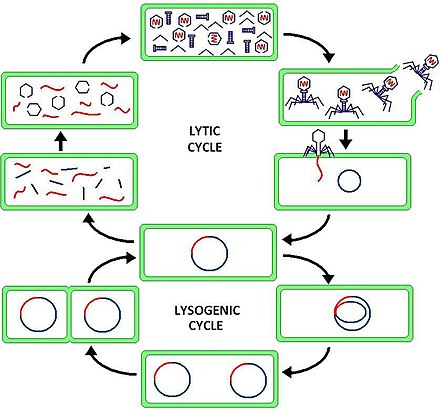

La lisogenia , o ciclo lisogénico , es uno de los dos ciclos de reproducción viral (siendo el ciclo lítico el otro). La lisogenia se caracteriza por la integración del ácido nucleico del bacteriófago en el genoma de la bacteria huésped o la formación de un replicón circular en el citoplasma bacteriano . En esta condición, la bacteria continúa viviendo y reproduciéndose normalmente, mientras que el bacteriófago permanece en estado latente en la célula huésped. El material genético del bacteriófago, llamado profago , puede transmitirse a las células hijas en cada división celular posterior, y eventos posteriores (como la radiación ultravioleta o la presencia de ciertas sustancias químicas) pueden liberarlo, provocando la proliferación de nuevos fagos a través de la vía lítica. ciclo. [1]
Los ciclos lisogénicos también pueden ocurrir en eucariotas , aunque el método de incorporación del ADN no se comprende completamente. Por ejemplo, los virus del VIH pueden infectar líticamente a los humanos o permanecer inactivos (lisogénicos) como parte del genoma de las células infectadas, manteniendo la capacidad de volver a la lisis en un momento posterior. [2] El resto de este artículo trata sobre la lisogenia en huéspedes bacterianos .
La diferencia entre los ciclos lisogénicos y líticos es que, en los ciclos lisogénicos, la propagación del ADN viral se produce a través de la reproducción procariótica habitual, mientras que un ciclo lítico es más inmediato porque da como resultado que se creen muchas copias del virus muy rápidamente y la La célula se destruye. Una diferencia clave entre el ciclo lítico y el ciclo lisogénico es que este último no lisa la célula huésped de inmediato. [3] Los fagos que se replican únicamente a través del ciclo lítico se conocen como fagos virulentos, mientras que los fagos que se replican utilizando ciclos líticos y lisogénicos se conocen como fagos templados . [1]
En el ciclo lisogénico, el ADN del fago se integra primero en el cromosoma bacteriano para producir el profago. Cuando la bacteria se reproduce, el profago también se copia y está presente en cada una de las células hijas. Las células hijas pueden continuar replicándose con el profago presente o el profago puede salir del cromosoma bacteriano para iniciar el ciclo lítico. [1] En el ciclo lisogénico el ADN del huésped no se hidroliza, pero en el ciclo lítico el ADN del huésped se hidroliza en la fase lítica.
Los bacteriófagos son virus que infectan y se replican dentro de una bacteria. Los fagos templados (como el fago lambda ) pueden reproducirse utilizando tanto el ciclo lítico como el lisogénico. [ cita necesaria ]
La forma en que un fago decide en qué ciclo entrar depende de una variedad de factores. [4] Por ejemplo, si hay varios otros fagos infectantes (o si hay una alta multiplicidad), es probable que el fago utilice el ciclo lisogénico. Esto puede ser útil para ayudar a reducir la proporción general de fagos a huéspedes y, por lo tanto, evitar que los fagos maten a sus huéspedes, aumentando así el potencial de supervivencia del fago, lo que convierte a esto en una forma de selección natural. Un fago puede decidir salir del cromosoma y entrar en el ciclo lítico si se expone a agentes que dañan el ADN, como la radiación ultravioleta y productos químicos. Otros factores con potencial para inducir la liberación templada de fagos incluyen la temperatura, el pH, la presión osmótica y la baja concentración de nutrientes. [5] Sin embargo, los fagos también pueden volver a entrar espontáneamente en el ciclo lítico. En el 80-90% de las infecciones unicelulares, los fagos entran en el ciclo lisogénico. En el otro 10-20%, los fagos entran en el ciclo lítico. [ cita necesaria ]
A veces es posible detectar en qué ciclo entra un fago observando la morfología de la placa en el cultivo de placas bacterianas. [6] Dado que los fagos que entran en el ciclo lítico matan las células bacterianas del huésped, las placas aparecerán claras (foto A). Las placas también pueden parecer tener un anillo similar a un halo alrededor del borde, lo que indica que estas células no fueron completamente lisadas. Por el contrario, infectar fagos que entran en el ciclo lisogénico producirá placas turbias o turbias, ya que las células que contienen el fago lisogénico no se lisan y pueden seguir creciendo (foto B). Sin embargo, también se sabe que existen excepciones a esta regla, donde los fagos no templados todavía exhiben placas turbias y los fagos mutantes templados pueden generar placas claras como resultado de la pérdida de la capacidad de formación de lisógeno. [ cita necesaria ]
Vea una comparación de placas claras y turbias, formadas por fagos líticos y lisogénicos, respectivamente, en Phage Discovery Guide.
Los métodos de detección de fagos liberados del ciclo lisogénico incluyen microscopía electrónica, extracción de ADN o propagación en cepas sensibles. [5]
A través del ciclo lisogénico, el genoma del bacteriófago no se expresa sino que se integra en el genoma de la bacteria para formar el profago . [7] En su forma inactiva, se transmite un profago cada vez que la célula huésped se divide. Si los profagos se activan, pueden salir del cromosoma bacteriano y entrar en el ciclo lítico, donde se someten a copia de ADN, síntesis de proteínas, ensamblaje de fagos y lisis. [4] Dado que la información genética del bacteriófago se incorpora a la información genética de la bacteria como profago, el bacteriófago se replica pasivamente a medida que la bacteria se divide para formar células bacterianas hijas. [7] En este escenario, las células bacterianas hijas contienen profago y se conocen como lisógenos . Los lisógenos pueden permanecer en el ciclo lisogénico durante muchas generaciones, pero pueden cambiar al ciclo lítico en cualquier momento mediante un proceso conocido como inducción. [7] Durante la inducción, el ADN del profago se extrae del genoma bacteriano y se transcribe y traduce para producir proteínas de cubierta para el virus y regular el crecimiento lítico. [7]

Un ejemplo de un virus que utiliza el ciclo lisogénico a su favor es el virus del herpes simple. [9] Después de entrar por primera vez en el ciclo lítico e infectar a un huésped humano, entra en el ciclo lisogénico. Esto le permite viajar a las neuronas sensoriales del sistema nervioso y permanecer sin ser detectado durante largos períodos de tiempo. En el caso del herpes genital, la latencia se establece en los ganglios de la raíz dorsal lumbosacra, las neuronas del nervio espinal. [10] El virus del herpes puede entonces salir de esta etapa latente y volver a entrar en el ciclo lítico, provocando síntomas de la enfermedad. Por lo tanto, si bien los virus del herpes pueden entrar en los ciclos lítico y lisogénico, la latencia permite que el virus sobreviva y evada la detección por parte del sistema inmunológico debido a la baja expresión de genes virales.
El organismo modelo para estudiar la lisogenia es el fago lambda. La integración del profago (también conocida como recombinación homóloga), el mantenimiento de la lisogenia, la inducción y el control de la escisión del genoma del fago en la inducción se describen en detalle en el artículo sobre el fago lambda . [6]
Los bacteriófagos son parásitos porque infectan a sus huéspedes, utilizan maquinaria bacteriana para replicarse y, en última instancia, lisan las bacterias. Los fagos templados pueden generar ventajas y desventajas para sus huéspedes a través del ciclo lisogénico. Durante el ciclo lisogénico, el genoma del virus se incorpora como profago y un represor impide la replicación viral. No obstante, un fago templado puede escapar de la represión para replicarse, producir partículas virales y lisar las bacterias. [11] El fago templado que escapa a la represión sería una desventaja para las bacterias. Por otro lado, el profago puede transferir genes que mejoran la virulencia del huésped y la resistencia al sistema inmunológico. Además, el represor producido por el profago que impide que se expresen los genes del profago confiere inmunidad a la bacteria huésped frente a la infección lítica por virus relacionados. [11]
Recientemente se ha descrito otro sistema, arbitrium , para bacteriófagos que infectan varias especies de Bacillus , en el que la decisión entre lisis y lisogenia se transmite entre bacterias mediante un factor peptídico . [12] [13]
En algunas interacciones entre fagos lisogénicos y bacterias, puede ocurrir la conversión lisogénica, que también puede denominarse conversión de fagos. Es cuando un fago templado induce un cambio en el fenotipo de la bacteria infectada que no forma parte de un ciclo fágico habitual. Los cambios a menudo pueden afectar a la membrana externa de la célula, haciéndola impermeable a otros fagos o incluso aumentando la capacidad patógena de la bacteria para un huésped. De esta manera, los bacteriófagos templados también desempeñan un papel en la propagación de factores de virulencia , como exotoxinas y exoenzimas, entre las bacterias. Este cambio luego permanece en el genoma de la bacteria infectada y se copia y se transmite a las células hijas.
Se ha demostrado que la conversión lisogénica permite la formación de biopelículas en Bacillus anthracis [14]. Las cepas de B. anthracis curadas de todos los fagos no pudieron formar biopelículas, que son comunidades bacterianas adheridas a la superficie que permiten a las bacterias acceder mejor a los nutrientes y sobrevivir al estrés ambiental. [15] Además de la formación de biopelículas en B. anthracis , la conversión lisogénica de Bacillus subtilis , Bacillus thuringiensis y Bacillus cereus ha mostrado una mayor tasa o extensión de la esporulación. [14] La esporulación produce endosporas , que son formas metabólicamente latentes de la bacteria que son altamente resistentes a la temperatura, la radiación ionizante, la desecación, los antibióticos y los desinfectantes. [14]
También se ha demostrado que las bacterias no virulentas se transforman en patógenos altamente virulentos mediante la conversión lisogénica con los factores de virulencia transportados por el profago lisogénico. [16] Los genes de virulencia transportados dentro de los profagos como elementos genéticos autónomos discretos, conocidos como imbéciles , confieren una ventaja a las bacterias que benefician indirectamente al virus a través de una mayor supervivencia del lisógeno. [14]
Ejemplos:
Se han propuesto estrategias para combatir determinadas infecciones bacterianas bloqueando la inducción del profago (la transición del ciclo lítico al ciclo lisogénico) mediante la eliminación de agentes de inducción in vivo . [16] Las especies reactivas de oxígeno (ROS), como el peróxido de hidrógeno, son agentes oxidantes fuertes que pueden descomponerse en radicales libres y causar daños en el ADN de las bacterias, lo que conduce a la inducción de profagos. [16] Una estrategia potencial para combatir la inducción del profago es mediante el uso de glutatión , un potente antioxidante que puede eliminar los intermediarios de los radicales libres. [16] Otro enfoque podría ser provocar una sobreexpresión del represor CI, ya que la inducción del profago solo ocurre cuando la concentración del represor CI es demasiado baja. [dieciséis]