
En química de coordinación , un ligando [a] es un ion o molécula con un grupo funcional que se une a un átomo central de metal para formar un complejo de coordinación . La unión con el metal generalmente implica la donación formal de uno o más pares de electrones del ligando , a menudo a través de bases de Lewis . [1] La naturaleza de la unión metal-ligando puede variar de covalente a iónica . Además, el orden de enlace metal-ligando puede variar de uno a tres. Los ligandos se consideran bases de Lewis, aunque se conocen casos raros que involucran "ligandos" ácidos de Lewis . [2] [3]
Los metales y metaloides están unidos a ligandos en casi todas las circunstancias, aunque se pueden generar iones metálicos "desnudos" gaseosos en un alto vacío. Los ligandos en un complejo dictan la reactividad del átomo central, incluidas las tasas de sustitución de ligandos, la reactividad de los propios ligandos y la reacción redox . La selección de ligandos requiere una consideración crítica en muchas áreas prácticas, incluidas la química bioinorgánica y medicinal , la catálisis homogénea y la química ambiental .
Los ligandos se clasifican de muchas maneras, entre ellas: carga, tamaño (volumen), identidad del átomo o átomos coordinadores y número de electrones donados al metal ( denticidad o hapticidad ). El tamaño de un ligando se indica mediante su ángulo de cono .
La composición de los complejos de coordinación se conoce desde principios del siglo XIX, como el azul de Prusia y el vitriolo de cobre . El avance clave se produjo cuando Alfred Werner concilió fórmulas e isómeros . Demostró, entre otras cosas, que las fórmulas de muchos compuestos de cobalto (III) y cromo (III) pueden entenderse si el metal tiene seis ligandos en una geometría octaédrica . Los primeros en utilizar el término "ligando" fueron Alfred Werner y Carl Somiesky, en relación con la química del silicio. La teoría permite comprender la diferencia entre cloruro coordinado e iónico en los cloruros de amina de cobalto y explicar muchos de los isómeros previamente inexplicables. Resolvió el primer complejo de coordinación llamado hexol en isómeros ópticos, derribando la teoría de que la quiralidad estaba necesariamente asociada con los compuestos de carbono. [4] [5]
En general, los ligandos se consideran donantes de electrones y los metales aceptores de electrones, es decir, bases de Lewis y ácidos de Lewis , respectivamente . Esta descripción se ha semicuantificado de muchas maneras, por ejemplo, el modelo ECW . El enlace se describe a menudo utilizando los formalismos de la teoría de orbitales moleculares. [6] [7]
Los ligandos y los iones metálicos se pueden ordenar de muchas maneras; un sistema de clasificación se centra en la "dureza" del ligando (véase también la teoría de ácido/base duro/blando ). Los iones metálicos se unen preferentemente a ciertos ligandos. En general, los iones metálicos "duros" prefieren ligandos de campo débil, mientras que los iones metálicos "blandos" prefieren ligandos de campo fuerte. Según la teoría de orbitales moleculares, el HOMO (orbital molecular ocupado más alto) del ligando debe tener una energía que se superponga con el LUMO (orbital molecular desocupado más bajo) del metal preferencial. Los iones metálicos unidos a ligandos de campo fuerte siguen el principio de Aufbau , mientras que los complejos unidos a ligandos de campo débil siguen la regla de Hund .
La unión del metal con los ligandos da como resultado un conjunto de orbitales moleculares, donde el metal puede identificarse con un nuevo HOMO y LUMO (los orbitales que definen las propiedades y la reactividad del complejo resultante) y un cierto orden de los 5 orbitales d (que pueden estar llenos o parcialmente llenos de electrones). En un entorno octaédrico , los 5 orbitales d, que de otro modo estarían degenerados, se dividen en conjuntos de orbitales de 3 y 2 (para una explicación más detallada, consulte la teoría del campo cristalino ):
La diferencia de energía entre estos dos conjuntos de orbitales d se denomina parámetro de desdoblamiento, Δ o . La magnitud de Δ o está determinada por la intensidad de campo del ligando: los ligandos de campo fuerte, por definición, aumentan Δ o más que los ligandos de campo débil. Ahora los ligandos se pueden ordenar según la magnitud de Δ o (consulte la tabla siguiente). Este orden de los ligandos es casi invariable para todos los iones metálicos y se denomina serie espectroquímica .
Para los complejos con un entorno tetraédrico, los orbitales d se dividen nuevamente en dos conjuntos, pero esta vez en orden inverso:
La diferencia de energía entre estos dos conjuntos de orbitales d se denomina ahora Δ t . La magnitud de Δ t es menor que la de Δ o , porque en un complejo tetraédrico solo 4 ligandos influyen en los orbitales d, mientras que en un complejo octaédrico los orbitales d están influenciados por 6 ligandos. Cuando el número de coordinación no es ni octaédrico ni tetraédrico, la división se vuelve correspondientemente más compleja. Sin embargo, para los fines de la clasificación de ligandos, las propiedades de los complejos octaédricos y el Δ o resultante han sido de interés principal.
La disposición de los orbitales d en el átomo central (determinada por la "fuerza" del ligando) tiene un fuerte efecto en prácticamente todas las propiedades de los complejos resultantes. Por ejemplo, las diferencias de energía en los orbitales d tienen un fuerte efecto en los espectros de absorción óptica de los complejos metálicos. Resulta que los electrones de valencia que ocupan orbitales con un carácter significativo de orbital 3 d absorben en la región de 400-800 nm del espectro (rango UV-visible). La absorción de luz (lo que percibimos como el color ) por estos electrones (es decir, la excitación de electrones de un orbital a otro orbital bajo la influencia de la luz) se puede correlacionar con el estado fundamental del complejo metálico, que refleja las propiedades de enlace de los ligandos. El cambio relativo en la energía (relativa) de los orbitales d como función de la intensidad de campo de los ligandos se describe en los diagramas de Tanabe-Sugano .
En los casos en que el ligando tiene LUMO de baja energía, dichos orbitales también participan en el enlace. El enlace metal-ligando se puede estabilizar aún más mediante una donación formal de densidad electrónica de vuelta al ligando en un proceso conocido como enlace hacia atrás . En este caso, un orbital lleno basado en el átomo central dona densidad al LUMO del ligando (coordinado). El monóxido de carbono es el ejemplo preeminente de un ligando que se une a los metales mediante donación hacia atrás. Complementariamente, los ligandos con orbitales llenos de baja energía de simetría pi pueden servir como donantes pi.

Los ligandos se clasifican según la cantidad de electrones que "donan" al metal. Los ligandos L son bases de Lewis . Los ligandos L están representados por aminas , fosfinas , CO , N 2 y alquenos . Los ejemplos de ligandos L se extienden para incluir dihidrógeno e hidrocarburos que interactúan mediante interacciones agósticas . Los ligandos X son haluros y pseudohaluros . Los ligandos X generalmente se derivan de precursores aniónicos como el cloruro, pero incluyen ligandos donde las sales de anión realmente no existen, como el hidruro y el alquilo. [8] [9]
Especialmente en el área de la química organometálica , los ligandos se clasifican según el "Método CBC" para la clasificación de enlaces covalentes, popularizado por MLH Green y "se basa en la noción de que hay tres tipos básicos [de ligandos]... representados por los símbolos L, X y Z, que corresponden respectivamente a ligandos neutros de 2 electrones, 1 electrón y 0 electrones". [10] [11]
Muchos ligandos son capaces de unirse a iones metálicos a través de múltiples sitios, generalmente porque los ligandos tienen pares solitarios en más de un átomo. Tales ligandos son polidentados. [12] Los ligandos que se unen a través de más de un átomo a menudo se denominan quelantes . Un ligando que se une a través de dos sitios se clasifica como bidentado y tres sitios como tridentado . El " ángulo de mordida " se refiere al ángulo entre los dos enlaces de un quelato bidentado. Los ligandos quelantes se forman comúnmente uniendo grupos donantes a través de enlaces orgánicos. Un ligando bidentado clásico es la etilendiamina , que se deriva de la unión de dos grupos de amoníaco con un enlace de etileno (−CH 2 CH 2 −). Un ejemplo clásico de un ligando polidentado es el agente quelante hexadentado EDTA , que puede unirse a través de seis sitios, rodeando completamente algunos metales. El número de veces que un ligando polidentado se une a un centro metálico se simboliza mediante " κ n ", donde n indica el número de sitios por los cuales un ligando se une a un metal. El EDTA 4− , cuando es hexidentado, se une como un ligando κ 6 , las aminas y los átomos de oxígeno del carboxilato no son contiguos. En la práctica, el valor n de un ligando no se indica explícitamente sino que se asume. La afinidad de unión de un sistema quelante depende del ángulo de quelación o ángulo de mordida .
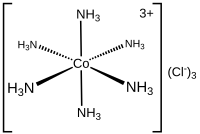
La denticidad (representada por κ ) es una nomenclatura que describe el número de átomos no contiguos de un ligando unido a un metal. Este descriptor se omite a menudo porque la denticidad de un ligando suele ser obvia. El complejo tris(etilendiamina)cobalto(III) podría describirse como [Co(κ 2 -en) 3 ] 3+ .
Los complejos de ligandos polidentados se denominan complejos quelatos . Suelen ser más estables que los complejos derivados de ligandos monodentados . Esta estabilidad mejorada, denominada efecto quelato , suele atribuirse a efectos de entropía , que favorecen el desplazamiento de muchos ligandos por un ligando polidentado.
Relacionado con el efecto quelato está el efecto macrocíclico . Un ligando macrocíclico es cualquier ligando grande que rodea al menos parcialmente al átomo central y se une a él, dejando el átomo central en el centro de un anillo grande. Cuanto más rígido y mayor sea su denticidad, más inerte será el complejo macrocíclico. El hemo es un ejemplo, en el que el átomo de hierro está en el centro de un macrociclo de porfirina , unido a cuatro átomos de nitrógeno del macrociclo de tetrapirrol. El complejo dimetilglioximato de níquel, muy estable , es un macrociclo sintético derivado de la dimetilglioxima .
La hapticidad (representada por la letra griega η ) se refiere a la cantidad de átomos contiguos que forman un sitio donante y se unen a un centro metálico. La notación η se aplica cuando varios átomos están coordinados. Por ejemplo, η 2 es un ligando que se coordina a través de dos átomos contiguos. El butadieno forma complejos η 2 y η 4 según la cantidad de átomos de carbono que estén unidos al metal. [13] [14] [15]
Los ligandos trans-spanning son ligandos bidentados que pueden abarcar posiciones de coordinación en lados opuestos de un complejo de coordinación. [16]
A diferencia de los ligandos polidentados, los ligandos ambidentados pueden unirse al átomo central en uno de dos (o más) lugares, pero no en ambos. Un ejemplo es el tiocianato , SCN − , que puede unirse tanto al átomo de azufre como al átomo de nitrógeno. Tales compuestos dan lugar a isomería de enlace .
Por lo tanto, los polidentados y los ambidentados son dos tipos diferentes de ligandos polifuncionales (ligandos con más de un grupo funcional ) que pueden unirse a un centro metálico a través de diferentes átomos de ligando para formar varios isómeros. Los ligandos polidentados pueden unirse a través de un átomo Y otro (o varios más) al mismo tiempo, mientras que los ligandos ambidentados se unen a través de un átomo O de otro. Las proteínas son ejemplos complejos de ligandos polifuncionales, generalmente polidentados.
Un ligando puente une dos o más centros metálicos. Prácticamente todos los sólidos inorgánicos con fórmulas simples son polímeros de coordinación , que consisten en centros de iones metálicos unidos por ligandos puente. Este grupo de materiales incluye todos los haluros y pseudohaluros de iones metálicos binarios anhidros. Los ligandos puente también persisten en solución. Los ligandos poliatómicos como el carbonato son ambidentados y, por lo tanto, se encuentran a menudo unidos a dos o tres metales simultáneamente. Los átomos que forman puentes entre metales a veces se indican con el prefijo " μ ". La mayoría de los sólidos inorgánicos son polímeros en virtud de la presencia de múltiples ligandos puente. Los ligandos puente, capaces de coordinar múltiples iones metálicos, han atraído un interés considerable debido a su uso potencial como bloques de construcción para la fabricación de conjuntos multimetálicos funcionales. [17]
Los ligandos binucleantes unen dos iones metálicos. [18] Por lo general, los ligandos binucleantes presentan ligandos puente, como fenóxido, pirazolato o pirazina, así como otros grupos donantes que se unen a solo uno de los dos iones metálicos.
Algunos ligandos pueden unirse a un centro metálico a través del mismo átomo pero con un número diferente de pares solitarios . El orden de enlace del enlace metal-ligando se puede distinguir en parte a través del ángulo de enlace metal-ligando (M−X−R). Este ángulo de enlace a menudo se conoce como lineal o doblado con más discusión sobre el grado en que se dobla el ángulo. Por ejemplo, un ligando imido en forma iónica tiene tres pares solitarios. Un par solitario se utiliza como donante sigma X, los otros dos pares solitarios están disponibles como donantes pi de tipo L. Si ambos pares solitarios se utilizan en enlaces pi, entonces la geometría M−N−R es lineal. Sin embargo, si uno o ambos de estos pares solitarios no son enlazantes, entonces el enlace M−N−R está doblado y la extensión de la curvatura habla de cuánto enlace pi puede haber. El óxido nítrico η 1 puede coordinarse con un centro metálico de manera lineal o doblada.
Un ligando espectador es un ligando polidentado de coordinación estrecha que no participa en reacciones químicas, pero elimina sitios activos en un metal. Los ligandos espectadores influyen en la reactividad del centro metálico al que están unidos.
Los ligandos voluminosos se utilizan para controlar las propiedades estéricas de un centro metálico. Se utilizan por muchas razones, tanto prácticas como académicas. Desde el punto de vista práctico, influyen en la selectividad de los catalizadores metálicos, por ejemplo, en la hidroformilación . De interés académico, los ligandos voluminosos estabilizan sitios de coordinación inusuales, por ejemplo, coligandos reactivos o números de coordinación bajos. A menudo, los ligandos voluminosos se emplean para simular la protección estérica que brindan las proteínas a los sitios activos que contienen metales. Por supuesto, un volumen estérico excesivo puede impedir la coordinación de ciertos ligandos.

Los ligandos quirales son útiles para inducir asimetría dentro de la esfera de coordinación. A menudo, el ligando se emplea como un grupo ópticamente puro. En algunos casos, como las aminas secundarias, la asimetría surge tras la coordinación. Los ligandos quirales se utilizan en catálisis homogénea , como la hidrogenación asimétrica .
Los ligandos hemilábiles contienen al menos dos grupos de coordinación electrónicamente diferentes y forman complejos donde uno de ellos se desplaza fácilmente del centro metálico mientras que el otro permanece firmemente unido, un comportamiento que se ha descubierto que aumenta la reactividad de los catalizadores en comparación con el uso de ligandos más tradicionales.
Los ligandos no inocentes se unen a los metales de tal manera que la distribución de la densidad electrónica entre el centro metálico y el ligando no es clara. Describir la unión de ligandos no inocentes a menudo implica escribir múltiples formas de resonancia que tienen contribuciones parciales al estado general.
Prácticamente todas las moléculas y todos los iones pueden servir como ligandos para (o "coordinarse con") metales. Los ligandos monodentados incluyen prácticamente todos los aniones y todas las bases de Lewis simples. Por lo tanto, los haluros y pseudohaluros son ligandos aniónicos importantes, mientras que el amoníaco , el monóxido de carbono y el agua son ligandos de carga neutra particularmente comunes. Las especies orgánicas simples también son muy comunes, ya sean aniónicas ( RO − y RCO−
2) o neutros ( R 2 O , R 2 S , R 3− x NH x y R 3 P ). Las propiedades estéricas de algunos ligandos se evalúan en términos de sus ángulos de cono .
Además de las bases de Lewis y los aniones clásicos, todas las moléculas insaturadas también son ligandos, que utilizan sus electrones pi para formar el enlace coordinado. Además, los metales pueden unirse a los enlaces σ en, por ejemplo, los silanos , los hidrocarburos y el dihidrógeno (véase también: Interacción agóstica ).
En complejos de ligandos no inocentes , el ligando está unido a los metales a través de enlaces convencionales, pero el ligando también es redox-activo.
En la siguiente tabla los ligandos están ordenados por intensidad de campo [ cita requerida ] (ligandos de campo débil primero):
Las entradas de la tabla están ordenadas por intensidad de campo, unión a través del átomo indicado (es decir, como ligando terminal). La "intensidad" del ligando cambia cuando el ligando se une en un modo de unión alternativo (por ejemplo, cuando forma un puente entre metales) o cuando la conformación del ligando se distorsiona (por ejemplo, un ligando lineal que se ve obligado a través de interacciones estéricas a unirse de manera no lineal).
En esta tabla se enumeran otros ligandos comunes en orden alfabético.
Un intercambio de ligando (también llamado sustitución de ligando ) es una reacción química en la que un ligando de un compuesto se reemplaza por otro. Se reconocen dos mecanismos generales: sustitución asociativa o sustitución disociativa .

La sustitución asociativa se parece mucho al mecanismo S N 2 de la química orgánica. Un ligando típicamente más pequeño puede unirse a un complejo insaturado y luego perder otro ligando. Normalmente, la velocidad de la sustitución es de primer orden al ingresar el ligando L y el complejo insaturado. [19]

La sustitución disociativa es común en los complejos octaédricos. Esta vía se parece mucho al mecanismo S N 1 de la química orgánica. La identidad del ligando entrante no afecta la velocidad. [19]
BioLiP [20] es una base de datos integral de interacciones proteína-ligando, con la estructura 3D de las interacciones proteína-ligando tomada del Protein Data Bank . MANORAA es un servidor web para analizar la interacción molecular conservada y diferencial del ligando en complejo con homólogos de estructura proteica del Protein Data Bank. Proporciona el vínculo a objetivos proteicos como su ubicación en las vías bioquímicas, SNP y expresión basal proteína/ARN en el órgano objetivo. [21]