El azul de Prusia (también conocido como azul de Berlín , azul de Brandeburgo , azul parisino y azul de París ) es un pigmento azul oscuro producido por la oxidación de sales de ferrocianuro ferroso . Tiene la fórmula química FeIII
4[FeII
( CN )
6]
3. El azul de Turnbull es químicamente idéntico, pero está elaborado a partir de diferentes reactivos y su color ligeramente diferente se debe a diferentes impurezas y tamaños de partículas.
El azul de Prusia se creó a principios del siglo XVIII y es el primer pigmento sintético moderno . Se prepara como una dispersión coloidal muy fina , porque el compuesto no es soluble en agua. Contiene cantidades variables [2] de otros iones y su apariencia depende sensiblemente del tamaño de las partículas coloidales. El pigmento se utiliza en pinturas , se hizo prominente en los grabados en madera japoneses aizuri-e (藍摺り絵) del siglo XIX y es el tradicional "azul" en los planos técnicos .
En medicina, el azul de Prusia administrado por vía oral se utiliza como antídoto para ciertos tipos de intoxicación por metales pesados , por ejemplo, por talio (I) e isótopos radiactivos de cesio . La terapia aprovecha las propiedades de intercambio iónico del azul de Prusia y su alta afinidad por ciertos cationes metálicos " blandos " . Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud , los medicamentos más importantes necesarios en un sistema básico de salud . [3]
El azul de Prusia prestó su nombre al ácido prúsico (cianuro de hidrógeno) que de él se deriva. En alemán, el cianuro de hidrógeno se llama Blausäure ('ácido azul'). Mientras que el químico francés Joseph Louis Gay-Lussac le dio su nombre al cianuro , de la palabra griega antigua κύανος ( kyanos , 'azul'/'cian'), debido a su color azul de Prusia.

El pigmento azul de Prusia es importante ya que fue el primer pigmento azul estable y relativamente resistente a la luz que se utilizó ampliamente desde la pérdida de conocimiento sobre la síntesis del azul egipcio . Los pintores europeos habían utilizado anteriormente una serie de pigmentos como el tinte índigo , el esmalte y la púrpura de Tiro , y el ultramar , extremadamente caro, elaborado con lapislázuli . Los pintores y artistas del grabado en madera japoneses tampoco tuvieron acceso a un pigmento azul duradero hasta que comenzaron a importar azul de Prusia de Europa. [4]
Fe azul de Prusia
7( CN )
18(también ( Fe
4[Fe(CN)
6]
3) · x Alto
2O ) probablemente fue sintetizado por primera vez por el pintor Johann Jacob Diesbach en Berlín alrededor de 1706. [5] [6] Se cree que el pigmento se creó accidentalmente cuando Diesbach usó potasa contaminada con sangre para crear un tinte rojo de cochinilla . El tinte original requería potasa, sulfato férrico y cochinilla seca. En cambio, la sangre, la potasa y el sulfato de hierro reaccionaron para crear un compuesto conocido como ferrocianuro de hierro que, a diferencia del pigmento rojo deseado, tiene un tono azul muy distintivo. [7] Su primer comerciante lo llamó Preußisch blau y Berlinisch Blau en 1709. [8] [9] [10]
El pigmento reemplazó fácilmente al costoso ultramar derivado del lapislázuli y fue un tema importante en las cartas intercambiadas entre Johann Leonhard Frisch y el presidente de la Academia Prusiana de Ciencias , Gottfried Wilhelm Leibniz , entre 1708 y 1716. [8] Se menciona por primera vez en una carta escrita por Frisch a Leibniz, del 31 de marzo de 1708. A más tardar en 1708, Frisch comenzó a promover y vender el pigmento en toda Europa. En agosto de 1709, el pigmento se denominó Preussisch blau ; En noviembre de 1709, Frisch utilizó por primera vez el nombre alemán Berlinisch Blau . El propio Frisch es el autor de la primera publicación conocida del azul de Prusia en el periódico Notitia Coerulei Berolinensis nuper inventi en 1710, como se puede deducir de sus cartas. Diesbach había trabajado para Frisch desde aproximadamente 1701.

Hasta la fecha, el Entierro de Cristo , fechado en 1709 por Pieter van der Werff (Galería de Pinturas, Sanssouci , Potsdam) es la pintura más antigua conocida en la que se utilizó el azul de Prusia. Hacia 1710 los pintores de la corte prusiana ya utilizaban este pigmento. Casi al mismo tiempo, el azul de Prusia llegó a París, donde Antoine Watteau y más tarde sus sucesores Nicolas Lancret y Jean-Baptiste Pater lo utilizaron en sus pinturas. [5] [11] François Boucher utilizó ampliamente el pigmento tanto para azules como para verdes. [12]
En 1731, Georg Ernst Stahl publicó un relato de la primera síntesis del azul de Prusia. [13] La historia no sólo involucra a Diesbach, sino también a Johann Konrad Dippel . Diesbach estaba intentando crear un pigmento lacustre rojo a partir de cochinilla, pero obtuvo el azul como resultado de la potasa contaminada que estaba usando. Tomó prestada la potasa de Dippel, quien la había utilizado para producir su aceite animal . Ninguna otra fuente histórica conocida menciona a Dippel en este contexto. Por lo tanto, hoy en día es difícil juzgar la fiabilidad de esta historia. En 1724, John Woodward finalmente publicó la receta. [14] [15] [16]
En 1752, el químico francés Pierre J. Macquer dio el importante paso de demostrar que el azul de Prusia podía reducirse a una sal de hierro y un nuevo ácido, que podía usarse para reconstituir el tinte. [17] El nuevo ácido, el cianuro de hidrógeno , aislado por primera vez del azul de Prusia en forma pura y caracterizado en 1782 por el químico sueco Carl Wilhelm Scheele , [18] finalmente recibió el nombre de Blausäure (literalmente "ácido azul") debido a su derivación de azul de Prusia, y en inglés pasó a ser conocido popularmente como ácido prúsico. El cianuro , un anión incoloro que se forma en el proceso de producción del azul de Prusia, deriva su nombre de la palabra griega que significa azul oscuro.
A finales del siglo XIX, el rabino Gershon Henoch Leiner , el Rebe jasídico de Radzin , teñió tzitziyot con azul de Prusia hecho con sepia , creyendo que este era el verdadero tinte techeiles . Aunque algunos han cuestionado su identidad como techeiles debido a su producción artificial, y afirmaron que si el rabino Leiner hubiera sido consciente de esto, se habría retractado de su posición de que su tinte era techeiles, [19] otros han cuestionado esto y afirmado que el rabino Leiner habría no se ha retractado. [20]
Desde principios del siglo XVIII, el azul de Prusia fue el color predominante del uniforme de los regimientos de infantería y artillería del ejército prusiano . [21] Como Dunkelblau (azul oscuro), este tono alcanzó una importancia simbólica y continuó siendo usado por la mayoría de los soldados alemanes para ocasiones ceremoniales y fuera de servicio hasta el estallido de la Primera Guerra Mundial, cuando fue reemplazado por el gris campo gris verdoso. ( Feldgrau ). [22]
El azul de Prusia se produce por oxidación de sales de ferrocianuro ferroso. Estos sólidos blancos tienen la fórmula M
2Fe[Fe(CN)
6] donde M+
= Na+
o k+
. El hierro de este material es totalmente ferroso, de ahí la ausencia de color intenso asociado con la valencia mixta. La oxidación de este sólido blanco con peróxido de hidrógeno o clorato de sodio produce ferricianuro y produce azul de Prusia. [23]
Una forma "soluble", K[Fe III Fe II (CN)
6] , que en realidad es coloidal , se puede fabricar a partir de ferrocianuro de potasio y hierro (III):
La reacción similar del ferricianuro de potasio y el hierro (II) da como resultado la misma solución coloidal, porque [Fe III (CN)
6]3-
se convierte en ferrocianuro.
El azul de Prusia "insoluble" se produce si, en las reacciones anteriores, se produce un exceso de Fe3+
está agregado:
A pesar de que se prepara a partir de sales de cianuro, el azul de Prusia no es tóxico porque los grupos cianuro están estrechamente unidos al hierro. [25] Tanto el ferrocianuro ((Fe II (CN) 6 ) 4− ) como el ferricianuro ((Fe III (CN) 6 ) 3− ) son cianometalatos poliméricos particularmente estables y no tóxicos debido a la fuerte coordinación del hierro con los iones cianuro. Aunque el cianuro se une bien a los metales de transición en general, como el cromo, estos compuestos de coordinación distintos del hierro no son tan estables como los cianuros de hierro, lo que aumenta el riesgo de liberación de iones CN- y , posteriormente, una toxicidad comparativa. [26]
En el pasado, se pensaba que la adición de sales de hierro (II) a una solución de ferricianuro producía un material diferente del azul de Prusia. El producto se llamaba tradicionalmente azul de Turnbull (TB). Sin embargo, los métodos de difracción de rayos X y difracción de electrones han demostrado que las estructuras de PB y TB son idénticas. [27] [28] Las diferencias en los colores de TB y PB reflejan diferencias sutiles en los métodos de precipitación, que afectan fuertemente el tamaño de las partículas y el contenido de impurezas.
El azul de Prusia es un polvo azul microcristalino . Es insoluble, pero los cristalitos tienden a formar un coloide. Estos coloides pueden pasar a través de filtros finos. [2] A pesar de ser uno de los compuestos sintéticos más antiguos conocidos, la composición del azul de Prusia permaneció incierta durante muchos años. Su identificación precisa se vio complicada por tres factores:


La fórmula química del azul de Prusia insoluble es Fe.
7(CN)
18 · x alto
2O , donde x = 14–16. La estructura se determinó mediante espectroscopia IR , espectroscopia Mössbauer , cristalografía de rayos X y cristalografía de neutrones . Dado que la difracción de rayos X no puede distinguir fácilmente el carbono del nitrógeno en presencia de elementos más pesados como el hierro, la ubicación de estos elementos más ligeros se deduce por medios espectroscópicos, así como observando las distancias a los centros de los átomos de hierro. La difracción de neutrones puede distinguir fácilmente los átomos de N y C y se ha utilizado para determinar la estructura detallada del azul de Prusia y sus análogos. [29]
PB tiene una estructura reticular cúbica centrada en las caras , con cuatro átomos de hierro III por celda unitaria. Los cristales de PB "solubles" contienen K intersticial+
iones; En cambio, el PB insoluble tiene agua intersticial. En los cristales de PB insolubles ideales, la estructura cúbica se construye a partir de secuencias Fe (II) –C – N – Fe (III), con distancias Fe (II) –carbono de 1,92 Å y distancias Fe (III) –nitrógeno de 2,03 Å. Una cuarta parte de los sitios de Fe(CN)
6las subunidades (supuestamente aleatorias) están vacantes (vacías), dejando tres de estos grupos en promedio por celda unitaria. [30] Los sitios de nitrógeno vacíos se llenan con moléculas de agua, que están coordinadas con Fe(III).

Los centros de Fe(II), que son de bajo espín , están rodeados por seis ligandos de carbono en una configuración octaédrica . Los centros de Fe(III), que tienen alto espín , están rodeados de forma octaédrica en promedio por 4,5 átomos de nitrógeno y 1,5 átomos de oxígeno (el oxígeno de las seis moléculas de agua coordinadas). Alrededor de ocho moléculas de agua (intersticiales) están presentes en la celda unitaria, ya sea como moléculas aisladas o unidas por enlaces de hidrógeno al agua coordinada. Vale la pena señalar que los hexacianoferratos solubles Fe (II o III) siempre están coordinados con el átomo de carbono de un cianuro, mientras que en el azul de Prusia cristalino los iones Fe están coordinados tanto con C como con N. [31]
La composición es notoriamente variable debido a la presencia de defectos reticulares, lo que permite que se hidrate en diversos grados a medida que se incorporan moléculas de agua a la estructura para ocupar los cationes vacantes. La variabilidad de la composición del azul de Prusia es atribuible a su baja solubilidad , lo que conduce a su rápida precipitación sin tiempo para alcanzar el equilibrio total entre sólido y líquido. [30] [32]
El azul de Prusia tiene un color intenso y tiende al negro y al azul oscuro cuando se mezcla con pinturas al óleo . El tono exacto depende del método de preparación, que dicta el tamaño de las partículas. El intenso color azul del azul de Prusia está asociado a la energía de la transferencia de electrones del Fe(II) al Fe(III). Muchos de estos compuestos de valencia mixta absorben ciertas longitudes de onda de luz visible resultantes de la transferencia de carga de intervalo . En este caso, se absorbe luz de color rojo anaranjado con una longitud de onda de alrededor de 680 nanómetros y, como resultado, la luz reflejada aparece azul.
Como la mayoría de los pigmentos de alto croma , el azul de Prusia no se puede mostrar con precisión en la pantalla de una computadora. El PB es electrocrómico y cambia de azul a incoloro tras la reducción . Este cambio es causado por la reducción del Fe (III) a Fe (II), eliminando la transferencia de carga de intervalo que causa el color del azul de Prusia.

Debido a que es fácil de fabricar, barato, no tóxico y de color intenso, el azul de Prusia ha atraído muchas aplicaciones. Se adoptó como pigmento muy poco después de su invención y casi de inmediato se utilizó ampliamente en pinturas al óleo, acuarelas y teñidos. [34] Los usos dominantes son los pigmentos: alrededor de 12.000 toneladas de azul de Prusia se producen anualmente para su uso en tintas negras y azuladas . El material también contiene una variedad de otros pigmentos. [23] El azul de ingeniero y el pigmento formado en los cianotipos , dándoles su nombre común de planos . Ciertos crayones alguna vez fueron coloreados con azul de Prusia (más tarde reetiquetado como azul medianoche ). Del mismo modo, el azul de Prusia es la base para el pavonado de la ropa .
Según el Observatorio de Nanomateriales de la Unión Europea, las nanopartículas de azul de Prusia se utilizan como pigmentos en algunos ingredientes cosméticos.
La capacidad del azul de Prusia para incorporar cationes metálicos monovalentes (Me + ) lo hace útil como agente secuestrante de ciertos metales pesados tóxicos . El azul de Prusia de calidad farmacéutica, en particular, se utiliza en personas que han ingerido talio (Tl + ) o cesio radiactivo ( 134 Cs + , 137 Cs + ). Según la Agencia Internacional de Energía Atómica (OIEA), un hombre adulto puede comer al menos 10 g de azul de Prusia al día sin sufrir daños graves. La Administración de Alimentos y Medicamentos de EE. UU. (FDA) ha determinado que "las cápsulas de azul de Prusia de 500 mg, cuando se fabrican bajo las condiciones de una Solicitud de Nuevo Medicamento aprobada, pueden considerarse una terapia segura y eficaz" en ciertos casos de intoxicación. [35] [36] La radiogardasa (cápsulas insolubles de azul de Prusia [37] ) es un producto comercial para la eliminación del cesio-137 del intestino , de forma indirecta del torrente sanguíneo , interviniendo en la circulación enterohepática del cesio-137, [38] reduciendo el tiempo de residencia interna (y la exposición) en aproximadamente dos tercios. En particular, se utilizó para adsorber y eliminar 137
cs+
del organismo de los envenenados en el accidente de Goiânia en Brasil. [2]
El azul de Prusia es una tinción histopatológica común utilizada por los patólogos para detectar la presencia de hierro en muestras de biopsia , como en muestras de médula ósea . La fórmula de tinción original, conocida históricamente (1867) como " azul de Prusia de Perls " en honor a su inventor, el patólogo alemán Max Perls (1843-1881), utilizaba soluciones separadas de ferrocianuro de potasio y ácido para teñir el tejido (ahora se usan combinadas, justo antes). tinción). Los depósitos de hierro en el tejido forman entonces el tinte violeta azul de Prusia y se visualizan como depósitos azules o violetas. [39]
El azul de ingeniero , azul de Prusia en una base aceitosa, es el material tradicional utilizado para raspar a mano superficies metálicas como placas de superficie y cojinetes . Se aplica una capa delgada de pasta que no se seca a una superficie de referencia y se transfiere a los puntos altos de la pieza de trabajo. Luego, el fabricante de herramientas raspa, apedrea o elimina de otro modo los puntos altos marcados. Es preferible el azul de Prusia porque no desgasta las superficies de referencia extremadamente precisas como lo hacen muchos pigmentos molidos. Otros usos incluyen marcar los dientes de los engranajes durante el ensamblaje para determinar sus características de interfaz.
El azul de Prusia se forma en el ensayo de azul de Prusia para fenoles totales . Las muestras y los estándares fenólicos reciben cloruro férrico ácido y ferricianuro, que los fenoles reducen a ferrocianuro. El cloruro férrico y el ferrocianuro reaccionan para formar azul de Prusia. La comparación de la absorbancia a 700 nm de las muestras con los estándares permite la determinación de fenoles o polifenoles totales . [40] [41]
El azul de Prusia está presente en algunas preparaciones de pavonado para ropa , como el Azulado de la señora Stewart . [42]
El azul de Prusia (PB) se ha estudiado por sus aplicaciones en el almacenamiento de energía electroquímica desde 1978. [43] El azul de Prusia propiamente dicho (el sólido Fe-Fe) muestra dos transiciones redox reversibles bien definidas en soluciones de K+. Los iones de potasio débilmente solvatados (así como Rb+ y Cs+, no mostrados) tienen el radio solvatado, que encaja perfectamente en el espacio de la cavidad en el Azul de Prusia, por lo que muestra picos agudos en la voltamperometría cíclica que se muestra a continuación. Por otro lado, los tamaños de Na+ y Li+ solvatados son demasiado grandes para la cavidad de PBA y la intercalación de estos iones es mucho más lenta. Los conjuntos de picos de bajo y alto voltaje en la voltametría cíclica corresponden a 1 y 2/3 de electrón por átomo de Fe, respectivamente. [44] El conjunto de alto voltaje se debe a la transición Fe+3/Fe+2 en los iones Fe de bajo espín coordinados con átomos de C. El conjunto de bajo voltaje se debe al ion Fe de alto espín coordinado con átomos de N. [45]
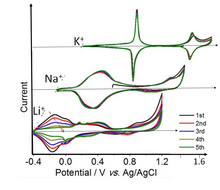
Es posible reemplazar los centros metálicos de Fe en el PB con diferentes iones metálicos como Mn, Co, Ni, Zn, etc. para formar análogos del azul de Prusia (PBA) electroquímicamente activos. Los PB/PBA y sus derivados se pueden utilizar como materiales de electrodos para la inserción y extracción reversible de iones alcalinos en baterías de iones de litio , baterías de iones de sodio y baterías de iones de potasio .
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )